
- •Изучение математической модели фармакокинетики
- •Самостоятельная работа студентов во внеаудиторное время
- •Средства для самоподготовки студентов во внеаудиторное время
- •Теоретическая часть
- •Самостоятельная работа студентов во время практического занятия
- •Выполнение работы
- •Примерные тестовые задания для самоконтроля
Самостоятельная работа студентов во внеаудиторное время
Задание 1.
Изучить теоретический материал занятия, используя рекомендуемую литературу, по следующей логической структуре учебного материала:
1. Моделирование как метод познания:
а) понятие модели;
б) элементы процесса моделирования
2. Значение метода для медицины
3. Классификация моделей:
а) вещественные;
б) энергетические;
в) информационные.
4. Математические модели:
а) детерминированные;
б) вероятностные
5. Основные этапы моделирования
6. Показатели качества модели
7. Основные фармакокинетические показатели
8. Методы оценки основных фармакокинетических показателей:
а) однокамерная модель;
б) двухкамерная и многокамерная модели;
Задание 2.
Подготовить реферативные сообщения на темы:
1. Нелинейные модели
2. Перфузионные модели
Средства для самоподготовки студентов во внеаудиторное время
1. Учебная и методическая литература
а) основная
– Ремизов А.Н. Медицинская и биологическая физика: Учеб. для вузов / А.Н.Ремизов, А.Г.Максина, А.Я.Потапенко. – 10-е изд., стереотип. – М.: Дрофа, 2011. – 558 с.: ил.
– Ремизов А.Н. Сборник задач по медицинской и биологической физике: Учеб. пособие / А.Н.Ремизов, А.Г.Максина. – М.: Дрофа, 2011. – 189 с.: ил.
– Баранов А.П. Сборник задач и вопросов по медицинской физике / А.П.Баранов. – Минск.: Высш. Школа, 2003. – 120 с.
– Физика и биофизика: Учебник / Под ред. В.Ф.Антонова. – М.: Ф50 ГЭОТАР-Медиа, 2008. – 480 с.: ил.
– Лекционный материал и данные методические указания;
б) дополнительная
– Фармакокинетика / Каркищенко Н.Н.[и др.]. – Ростов, 2001. – 79 с.
– Сергиенко В.И. Прикладная фармакокинетика: основные положения и клиническое применение / В.И. Сергиенко, Р. Джелифф, И.Б. Бондарева. – М.: Медицина, 2003. – 59 с.
– Сергиенко В.И. Математическая статистика в клинических исследованиях / В.И. Сергиенко, И.Б. Бондарева. – М.: Медицина, 2000. – 67 с.
2. Консультации преподавателей (еженедельно по индивидуальному графику).
Теоретическая часть
Моделирование как метод познания.
Моделирование в научных исследованиях стало применяться еще в глубокой древности и постепенно захватывало все новые области научных знаний: техническое конструирование, строительство и архитектуру, астрономию, физику, химию, биология и, наконец, медицину. Большие успехи и признание практически во всех отраслях современной науки принес методу моделирования XX в. Однако методология моделирования долгое время развивалась независимо отдельными науками. Отсутствовала единая система понятий, единая терминология. Лишь постепенно стала осознаваться роль моделирования как универсального метода научного познания. Термин «модель» широко используется в различных сферах человеческой деятельности и имеет множество смысловых значений. Рассмотрим только такие «модели», которые являются инструментами получения знаний. Модель - это такой материальный или мысленно представляемый объект, который в процессе исследования замещает объект-оригинал так, что его непосредственное изучение дает новые знания об объекте-оригинале. Под моделированием понимается процесс построения, изучения и применения моделей. Оно тесно связано с такими категориями, как абстракция, аналогия, гипотеза и др. Процесс моделирования обязательно включает и построение абстракций, и умозаключения по аналогии, и конструирование научных гипотез. Главная особенность моделирования в том, что это метод опосредованного познания с помощью объектов-заместителей. Модель выступает как своеобразный инструмент познания, который исследователь ставит между собой и объектом и с помощью которого изучает интересующий его объект. Именно эта особенность метода моделирования определяет специфические формы использования абстракций, аналогий, гипотез, других категорий и методов познания.
Необходимость использования метода моделирования определяется тем, что многие объекты (или проблемы, относящиеся к этим объектам) непосредственно исследовать или вовсе невозможно, или же это исследование требует много времени и средств. Процесс моделирования включает три элемента: 1) субъект (исследователь), 2) объект исследования, 3) модель, опосредствующую отношения познающего субъекта и познаваемого объекта.
Пусть имеется или необходимо создать некоторый объект А. Мы конструируем (материально или мысленно) или находим в реальном мире другой объект В - модель объекта А. Этап построения модели предполагает наличие некоторых знаний об объекте-оригинале. Познавательные возможности модели обуславливаются тем, что модель отражает какие-либо существенные черты объекта-оригинала. Вопрос о необходимости и достаточной мере сходства оригинала и модели требует конкретного анализа. Очевидно, модель утрачивает свой смысл как в случае тождества с оригиналом (тогда она перестает быть оригиналом), так и в случае чрезмерного во всех существенных отношениях отличия от оригинала.
Таким образом, изучение одних сторон моделируемого объекта осуществляется ценой отказа от отражения других сторон. Поэтому любая модель замещает оригинал лишь в строго ограниченном смысле. Из этого следует, что для одного объекта может быть построено несколько «специализированных» моделей, концентрирующих внимание на определенных сторонах исследуемого объекта или же характеризующих объект с разной степенью детализации.
На втором этапе процесса моделирования модель выступает как самостоятельный объект исследования. Одной из форм такого исследования является проведение «модельных» экспериментов, при которых сознательно изменяются условия функционирования модели и систематизируются данные о ее «поведении». Конечным результатом этого этапа является множество знаний о модели.
На третьем этапе осуществляется перенос знаний с модели на оригинал - формирование множества знаний об объекте. Этот процесс переноса знаний проводится по определенным правилам. Знания о модели должны быть скорректированы с учетом тех свойств объекта-оригинала, которые не нашли отражения или были изменены при построении модели. Мы можем с достаточным основанием переносить какой-либо результат с модели на оригинал, если этот результат необходимо связан с признаками сходства оригинала и модели. Если же определенный результат модельного исследования связан с отличием модели от оригинала, то этот результат переносить неправомерно.
Четвертый этап - практическая проверка получаемых с помощью моделей знаний и их использование для построения обобщающей теории объекта, его преобразования или управления им. Для понимания сущности моделирования важно не упускать из виду, что моделирование - не единственный источник знаний об объекте. Процесс моделирования «погружен» в более общий процесс познания. Это обстоятельство учитывается не только на этапе построения модели но и на завершающей стадии, когда происходит объединение и обобщение результатов исследования, получаемых на основе многообразных средств познания.
Моделирование - циклический процесс. Это означает, что за первым четырехэтапным циклом может последовать второй, третий и т.д. При этом знания об исследуемом объекте расширяются и уточняются, а исходная модель постепенно совершенствуется. Недостатки, обнаруженные после первого цикла моделирования, обусловленные малым знанием объекта и ошибками в построении модели, можно исправить в последующих циклах. В методологии моделирования, таким образом, заложены большие возможности саморазвития.
Значение метода для медицины.
Метод моделирования находит свое применение в медицине и сопутствующих ей науках. Метод моделирования в медицине является средством, позволяющим устанавливать все более глубокие и сложные взаимосвязи между теорией и опытом. В последнее столетие экспериментальный метод в медицине начал наталкиваться на определение границы, и выяснилось, что целый ряд исследований невозможен без моделирования. Если остановиться на некоторых примерах ограничений области применения эксперимента в медицине, то они будут в основном следующими:
а) вмешательство в биологические системы иногда имеет такойхарактер, что невозможно установить причины появившихся изменений(вследствие вмешательства или по другим причинам);
б) некоторые теоретически возможные эксперименты неосуществимывследствие низкого уровня развития экспериментальной техники;
в) большую группу экспериментов, связанных с экспериментированиемна человеке, следует отклонить по морально-этическим соображениям. Номоделирование находит широкое применение в области медицины не толькоиз-за того, что может заменить эксперимент. Оно имеет большоесамостоятельное значение, которое выражается в целом ряде преимуществ:
1.С помощью метода моделирования на одном комплексе данных можно разработать целый ряд различных моделей, по-разному интерпретировать исследуемое явление и выбрать наиболее плодотворную из них для теоретического истолкования.
2.В процессе построения модели можно сделать различные дополнения к исследуемой гипотезе и получить ее упрощение.
3. В случае сложных математических моделей можно применять ЭВМ.
4.Открывается возможность проведения модельных экспериментов (модельные эксперименты на подопытных животных).
Все это ясно показывает, что моделирование выполняет в медицине самостоятельные функции и становится все более необходимой ступенью в процессе создания теории.
Классификация моделей.
Существует множество классификаций моделей, наиболее общая из них разделяет все модели на вещественные, энергетические и информационные.
Под вещественными моделями принято понимать те, которые воспроизводят структуру объекта и взаимоотношения его частей. Примером таких моделей в медицине могут служить различные протезы, которые по внешнему виду похожи на реальные части тела, которые они замещают.
Энергетические модели используются для моделирования, функциональных взаимоотношений в изучаемых объектах. Эти модели по внешнему виду не напоминают моделируемые объекты, но их целью является выполнение функций этих объектов. Например, в медицине широко используются такие системы, как аппарат искусственной почки или искусственного дыхания. Имеется целый ряд разработок, в которых сочетаются свойства вещественных и энергетических моделей, то есть и по внешнему виду и по выполняемым функциям модели подобны заменяемым органам. К таким моделям относятся биоуправляемые протезы, искусственный хрусталик глаза, последние разработки в области искусственного сердца.
В отличии от первых двух моделей информационные модели производят описание объекта. В медико - биологических исследованиях до недавнего времени для описания работы биологических систем использовали преимущественно словесные модели. Однако с помощью словесных моделей затруднительно четко изложить закономерности работ изучаемого объекта. Поэтому все чаще используются математические модели, которые используют количественные соотношения между параметрами исследуемой биосистемы.
Математическая модель представляет собой систему математических соотношений - формул, функций, уравнений, систем уравнений и т.д., описывающих те или иные стороны изучаемого объекта, явления, процесса.
Использование математических моделей позволяет перейти к сжатому изложению гипотез и закономерностей, а главное, к широкому использованию компьютерных технологий.
Кроме рассмотренных трех классов моделей в медицине широко применяются биологические модели. Для изучения протекания патологических процессов, обработки новых методов хирургического вмешательства и изучения новых лекарственных средств широко используют биологические модели различных животных. Полученные результаты с определенной долей осторожности переносят на человека. В зависимости от целей исследования подбирают животных так, чтобы уровень организации изучаемой системы был близок к уровню организации таковой у человека. Например, биологической моделью наследственной артериальной гипертензии человека являются спонтанно гипертензивные крысы, выведенные Окамото и Аоки (1967) из популяции крыс линии Вистар -Киото. У спонтанно гипертензивных животных артериальное давление спонтанно повышается с 4 - 5 недели жизни ввиду реализации наследственных механизмов. Причем стадии развития болезни и ее осложнения аналогичные, как и при наследственной артериальной гипертензии человека.
Наибольшее значение в медицинских исследованиях получили математические модели. Обычно это система уравнений, описывающая взаимосвязь между переменным, характеризующими реальный физиологический процесс или систему. Математические модели подразделяются на детерминированные и вероятностные. В детерминированных моделях переменные и параметры предполагаются постоянными или описываются детерминированными функциями. В вероятностных моделях, характеризующие ее переменные и параметры являются случайными функциями или случайными величинами.
Детерминированные математические модели чаще всего представляют собой систему алгебраических или дифференциальных уравнений.
Вероятностные модели строятся по результатам экспериментального определения статических или динамических характеристик объектов на основе методов математической статистики.
Необходимость применения в медицине математических методов моделирования с использованием компьютерной техники диктуется тем, что с их помощью можно адекватно и в короткий срок обобщить сложную сущность явлений и процессов, описать и понять факты, выявить взаимосвязи, найти рациональное решение с гораздо большей полнотой и надежностью, чем это делается на базе словесных характеристик, элементарных рутинных расчетов.
На настоящий момент времени сформировалось представление о том, что может дать применение метода математического моделирования в медицине: систематизировать важные параметры (физиологически содержательные свойства) и определять общую чувствительность системы вариации каждого параметра, количественно оценивать трудно измеряемые и вообще не измеряемые показатели, быстро и эффективно проверять гипотезы без обращения к эксперименту, планировать эксперименты и исследования, предсказывать поведение реальной системы.
Успех математического моделирования в медицине зависит от того, насколько глубоко исследованы системы организма и на этой основе эффективно выделены информативные подпространства признаков. Авторы моделей в математическом описании функций организма отражают физические, биохимические, физиологические и структурные характеристики объекта исследования.
Важной проблемой математического моделирования в медицине является адекватность математического выражения биологического явления. Проблемность этой ситуации состоит в том, что математический аппарат создавался в расчете на изучение процессов неживой природы (механических, атомных, молекулярных), характеризующихся одномерным распределением, которое не свойственно биопроцессам.
Построение математических моделей биосистем подразумевает проведение экспериментальных исследований для получения количественных характеристик изучаемых процессов. В дальнейшем эти характеристики становятся объектом исследования и на их основе с учетом теоретических предпосылок строится модель, объясняющая функционирование изучаемого объекта. Наивысшей точкой такого обобщения является математическая модель, заменяющая реальный объект исследования. Построенная модель представляет собой некоторое упрощение реального объекта как по структуре, так и по сложности внешних и внутренних связей, но обязательно отражает те свойства объекта, которые являются целью исследования. В дальнейшем модель подвергается всесторонней проверке и корректировке для более полного соответствия модели и реального объекта. Рассмотрим более подробно основные этапы моделирования:
1.Постановка задачи, которая заключается в определении цели исследования и моделирования на основании некоторой первоначальной гипотезы.
2.Построение функциональной системы объекта - определение входов и выходов, режимов изменения входных воздействий, исследуемых режимов (норма, патология).
3.Планирование эксперимента. На этом этапе определяют режимы изменения входных сигналов, внутренних состояний системы, производится обработка комплекса контрольно - измерительной аппаратуры.
4.Проведение серии пробных опытов для обработки методики исследований, приемлемости принятых допущений, проверки исходной гипотезы.
5.Проведение основной серии опытов для получения статических и динамических характеристик.
6.Предварительная статистическая обработка материала, полученного на стадии экспериментирования с биосистемой.
7.Выбор типа и вида модели на основании анализа результатов статистической обработки данных.
8.Определение параметров модели по результатам экспериментов. 9.Всестороннее исследование математической модели биосистемы с
целью определения достоверности и границ применимости модели. Сравнение результатов, полученных с помощью модели и реального объекта, позволяет определить основные показатели качества модели:
информативность, оценивается корреляцией между экспериментальным значением отклика системы на внешние воздействия и значением отклика, рассчитанным по модели;
адекватность, означает отражение моделью с заданной точностью определенной совокупности свойств объекта;
• устойчивость коэффициентов регрессии и структуры модели. Направленность на клиническое применение определила особые
требования к математическим моделям: необходимость отражения математических процессов и компенсаторных сдвигов, лечебных воздействий (медикаментозных, измерение режима вентиляции, жидкостного баланса и пр.), представление клинического контроля, оценку модели в реальном времени, а также наличие интерактивного интерфейса в терминах, принятых в клинике.
В настоящее время возрос интерес к использованию методов математического моделирования при создании новых лекарственных средств. Хранение и обработка информации о структуре и биологическом действии химических соединений, поиск оригинальных базовых структур во внутрифирменных и коммерчески доступных банках данных, установление связи структура - свойство и оптимизация свойств активных субстанций, анализ структурных особенностей новых биологических мишеней действия лекарств, моделирование взаимодействия лиганд - рецептор, минимизация функционально активных фрагментов эндогенных биорегуляторов, комбинаторная химия - вот лишь некоторые из проблем, эффективное решение которых было бы невозможно без современных компьютерных технологий.
В июне 1996 года на базе Института биомедицинский химии РАМН создано Российское отделение Международного общества по анализу количественных соотношений структура - активность и молекулярному моделированию, что позволило расширить возможности компьютерного прогнозирования. В результате работы коллектива в этом направлении была создана компьютерная система РА88, которая одновременно предсказывает вероятность более чем 100 фармакологических эффектов и механизмов действия вещества на основе его структурной формулы. Эффективность применения этого подхода к планированию скрининга составляет около 800%, а точность компьютерного прогноза на 300% превосходит предсказание экспертов.
Итак, одним из конструктивных инструментов получения новых знаний и решений в медицине является метод математического моделирования. Процесс математизации медицины - частое проявление взаимопроникновения научных знаний, повышающее эффективность лечебно - профилактической работы.
Основные фармакокинетические показатели.
В последние два тысячелетия фармакокинетика (ФК) становится все в большей степени прикладной наукой. Появился даже новый термин «прикладная фармакокинетика». Дальнейшее научное развитие ФК продолжается с точки зрения совершенствования применяемого математического аппарата, аналитических методов, методики изменений, углубленного изучения и обоснования физиологических основ. Но уже
сейчас становится традиционной клинической практикой применение ФК - принципов для оптимизации фармакотерапии. Известно много примеров, когда на основе ФК - моделирования удавалось разработать практические подходы индивидуализации терапии лекарственными препаратами и их сочетаниями. Несмотря на кажущуюся привлекательность такого подхода, важно понимать его ограничения на данном этапе и условия, создающие такие ограничения.
Любой, даже самый простой расчет суточной дозы назначаемого препарата по известным формулам или номограммам, неявно предполагает использование ФК - модели при разработке методики таких расчетов. Непосредственное же применение ФК - моделирования для индивидуализации режимов дозирования имеет, безусловно, ряд важных преимуществ. В общем виде можно сказать, что моделирование позволяет восстановить и визуализировать полный ФК - профиль изменения концентрации препарата в организме в периоды времени между ее измерениями в ходе терапевтического лекарственного мониторинга (TJIM). А это, в свою очередь, дает возможность сопоставить во времени данные в ФК пациента, или о клиническом ответе на проводимую терапию. При этом в некоторых случаях удается выявить, например, уровни препарата в крови пациента, приводящие к появлению дозозависимых побочных эффектов или наоборот, относящиеся к периоду успешной терапии, т.е. оценить индивидуальную чувствительность пациента к проводимой терапии. Моделирование позволяет предсказать концентрацию препарата в камерах модели, недоступных для непосредственных измерений, что важно, если показатели эффекта в большей степени коррелируют с концентрациями в этих камерах. Моделирование позволяет оценить реальные колебания концентрации препарата при дозировании его неравными дозами через неравные промежутки времени, что важно, например, для предотвращения дозозависимых побочных эффектов.
Кроме того, моделирование позволяет рассчитать режим дозирования с учетом пола, возраста массы тела пациента, показателей его почечной и печеночной функции и т.п., необходимый для достижения выбранной терапевтической цели с максимальной точностью, что важно при использовании препаратов с низкими значениями терапевтических индексов. ФК - модели позволяют прогнозировать доставку препарата к месту действия, например, антибиотика в глубь очага воспаления, и прогнозировать возможный эффект от проводимой терапии. Даже отсутствие точных данных о возбудителе заболевания и его чувствительность к назначаемым антибактериальным препаратам, даже в отсутствие данных пациента можно моделировать граничные кривые эффекта для так называемого худшего и лучшего случаев, а затем сравнивать возможные схемы дозирования назначаемых антибиотиков. Такой прогноз помогает предвидеть возможные результаты планируемой терапии, сравнивать различные схемы дозирования с точки зрения их эффективности и безопасности.
Все эти возможности появляются в результате разработки подходящей ФК - модели, структура которой позволяет максимально упрощенно, но с приемлемой точностью, описывать поведение препарата в организме. Проводя образные сравнения, ФК - модели в медицине можно сопоставить со сказками в литературе. Сказки тоже можно считать в некоторой степени моделями реальной жизни, они также аккумулируют огромный жизненный опыт в упрощенной и доступной для понимания форме. Точно так же, как и сказки, ФК - модели не соответствуют реальности в полной мере, но являются, бесспорно, полезными. Не была еще создана ФК - модель, полностью учитывающая все сложные детали моделируемого процесса, реальность значительно более многогранна. Тем не менее популяционные ФК - модели с допустимой степенью подробности количественно описывают поведение лекарственных препаратов в организме, тем самым в удобной
форме позволяют хранить наш предыдущий клинический опыт и использовать его затем для подбора индивидуальной терапии новому пациенту.
В настоящее время не создан единый, одинаково хороший для всех лекарственных препаратов, подход к использованию данных TJIM для оптимизации лекарственной терапии. Тем не менее определены общие принципы, и их игнорирование может привести к тому, что измеренные в ходе достаточно трудоемкой и дорогостоящей процедуры TJIM значения концентрации препарата у пациента могут быть неправильно интерпретированы и оказаться бесполезными. А значит, важным является изучение и понимание ключевых элементов прикладной ФК, а также разработка и оптимизация стратегий её наиболее эффективного использования в клинической практике.
Рис.1.
Схематичное представление процессов
всасывания, распределения и элиминации
препарата.
Распространение препаратов в организме обеспечивается системой кровообращения. В крови лекарственный препарат быстро распределяется между плазмой и эритроцитами, между белками плазмы и жидкой частью плазмы. Поскольку большинство лекарственных препаратов состоит из молекул относительно маленького размера, достаточно легко проходящими стенку капилляров, они проникают во внеклеточную жидкость практически всех органов. Большинство препаратов является также в достаточной степени липофильными, что позволяет им проходить сквозь клеточные мембраны и распределяться во внутриклеточной жидкости различных тканей. Таким образом, во всем организме происходит распределение введенного лекарственного препарата между жидкостями организма, а также белками и другими макромолекулами, находящимися в жидких средах или являющимися компонентами клеток. Такое упрощенное описание процесса распределения препарата позволяет условно представить организм как систему отдельных камер, или компонентов, содержащих фракции, или части, введенной дозы препарата. Переход части препарата из одной камеры в другую ассоциируется с константой скорости (К), величина которой определяет, насколько быстро протекает этот процесс.
Переход препарата из крови во внесосудистое пространство (внеклеточную и внутриклеточную жидкости, ткани) называется его распределением. Распределение препарата - это обычно быстрый и обратимый процесс. Так, вскоре после внутривенного введения препарат достигает равновесного распределения между плазмой, эритроцитами, другими жидкими средами и тканями организма. В результате достижения этого динамического равновесия изменение концентрации препарата в плазме отражает изменения концентрации препарата в других тканях, включая место действия.
Выведение препарата, или элиминация, обеспечивается экскрецией (из крови в мочу или другие экскреторные камеры, такие, как желчь, слюна, грудное молоко), а также биотрансформации препарата в тканях или плазме. Процессы элиминации, обычно необратимые, включающие все способы экскреции и метаболической инактивации: выведение почками или легкими, с желчью, с экскрементами, через кожу, биотрансформацию и т.п., -
ответственные за выведение препарата из организма. Динамика процессов абсорбции, распределения и элиминации препарата представлена на рис.2.

Рис. 2. Кривые изменения количества препарата.
1 - в месте всасывания, 2 - в центральной камере, 3 - в камере накопления выводимого из крови препарата. Кривые нормированы на значение перорального введения дозы препарата.
После достижения сосудистого русла препарат одновременно является объектом распределения и элиминации. Однако обычно процессы распределения протекают быстрее и завершаются до того, как основная часть препарата будет выведена из организма. В рамках предположения о практически мгновенном достижения равновесного распределения препарата весь организм может рассматриваться как один компартмент. Конечно, такое упрощение не может быть справедливо для всех препаратов. Для многих из них концентрация в плазме, измеренная через достаточно короткий промежуток времени после внутривенного введения, явно демонстрирует незавершенную фазу распределения. Это означает, что измеримая часть введенной дозы элиминирует быстрее, чем достигается равновесное распределение. Для моделирования поведения таких препаратов в организме и описания изменения их концентрации в крови во времени обычно бывает достаточно двух камер: центральной, с достаточно быстрым распределением, и периферической, характеризующейся более медленным достижением равновесного распределения. Количественную оценку элиминируемого препарата дает клиренс препарата (С1) - объем крови (в общем виде тест-ткани), очищаемый от препарата за единицу времени (мл/мин, мл/(мин-кг), мл/(мин-1.73м ) и т.п.). Последние единицы измерения часто записывают как мл/мин/кг, мл/мин/ 1.73 м2.
Концентрации препарата в крови, измеренные через короткий временной интервал после внутривенного введения одинаковых доз двух препаратов, могут существенно различаться по величине. Это происходит из-за различий в физических и химических свойствах препаратов, приводящих к различиям в распределении и степени связывания.
После достижения равновесного распределения концентрация препарата в различных частях организма редко бывает одинакова. Часто препарат плохо проникает в различные системы или ткани организма, например, центральную нервную систему (ЦНС) или же жировую ткань. И возможно наоборот, препарат достаточно хорошо проникает в какие-то ткани, связывается там и накапливается. Вещества могут накапливаться в соединительной и костной ткани. Некоторые препарата в большом количестве обнаруживаются в клеточных депо. Жировые депо могут задерживать липофильные соединения. Таким образом, концентрация препарата в различных органах и тканях может быть как намного больше, так и намного меньше, чем в плазме. Однако, несмотря на это, после достижения равновесного распределения концентрация препарата в плазме отражает факторы, влияющие на распределение, и простое линейное соотношение связывает количество препарата в организме (А) с его концентрацией в плазме (С).
Коэффициент пропорциональности между количеством введенного препарата и его концентрацией называется кажущимся объемом распределения (V). Обычно объем распределения измеряется в литрах или нормируется на массу тела (л/кг) или площадь поверхности тела (л/1.73м ).
Вообще нормирование ФК - параметров в основном проводится для усреднения и сравнения индивидуальных значений в случае существенно различающихся масс или размеров. Для большинства препаратов кажущийся объем распределения не зависит от концентрации. Тогда увеличенная вдвое внутривенно введенная доза препарата приводит к увеличению вдвое концентрации препарат в плазме. Такая пропорциональная зависимость является индикатором линейной фармакокинетики.
Кажущийся объем распределения обычно характеризует препарат в большей степени, чем биологическую систему, хотя некоторые патофизиологические и другие факторы могут приводить к изменениям этого объема. Величина V редко соответствует объему плазмы, внеклеточному объему или объему общей жидкости организма. Значения V могут быть от нескольких литров до нескольких сотен литров у «среднего» пациента массой 70 кг. Так, например, средний кажущийся объем распределения карбамазепина равен 0.8 - 2 л/кг.
Между кажущимся и реальным объемами распределения препарата обычно существует принципиальное различие. По определению, кажущийся объем распределения представляет собой константу пропорциональности между концентрацией препарата в плазме и общим количеством препарата в организме. Значения действительного объема распределения связаны с объемом жидких сред организма. Величина действительного объема распределения препарата никогда не превышает общего количества воды в организме, которое составляет примерно 60% массы тела человека, или 42 л у человека массой 70кг. Жидкости организма можно условно поделить на три компартмента: васкулярный, или сосудистый, внеклеточный и внутриклеточный. Внеклеточная жидкость, составляющая примерно третью часть общей жидкости организма (примерно 15л у человека массой 70кг), включает в себя плазму крови (приблизительно 4% массы тела, или Зл при массе 70кг и при общем объеме крови 5 - 6л), спинномозговую жидкость, внутриглазную жидкость и жидкое содержимое ЖКТ. У человека массой
70кг приблизительно 25л приходится на внутриклеточную жидкость. Васкулярный объем, включая внутриклеточную жидкость эритроцитов, обычно в два раза превышает объем плазмы и составляет порядка 6л. Однако в рамках ФК - моделирования принято условно выделять компартменты в соответствии со степенью доступности для проникновения препарата. При этом центральной камерой обычно считается кровь и сильно васкуляризованные ткани, а периферической - ткани, менее доступные для кровоснабжения.
Кажущийся объем распределения обычно не эквивалентен анатомическому объему, а отражает распределение препарата и степень его связывания в организме. Так, если препарат связывается преимущественно белками крови, кажущийся объем распределения будет меньше, чем действительный. С другой стороны, преимущественное связывание препарата во внесосудистом пространстве приводит к превышению значения кажущегося объема распределения над реальным. Таким образом, сопоставления значения кажущегося объема распределения конкретного препарата с объемом некоторых физиологических жидкостей организма может помочь в понимании процесса распределения препарата. Исходя из того, что расчет V предполагает одинаковую концентрацию препарата по всему объему его распределения, надо понимать, что величины V, превышающие объем жидкости в организме, могут получатся в результате накопления препарата в каком-либо участке тканей. Так, например, значение V=0.05л/кг говорит о том, что препарат распределяется во внеклеточной жидкости, а значения V=0.06 - 0.6л/кг свидетельствуют о том, что препарат распределяется в жидких средах всего организма. Более высокие значения этого показателя предполагают накопление препарата в тканях. Тем не менее такое деление достаточно условно. Так, например, средние значение кажущегося объема распределения аминогликозидов оценивается как 0.2 - 0.З л/кг. Было замечено, что у «тяжелых» пациентов, нуждающихся в интенсивной терапии, в среднем эти значения возрастают до 0.35 - 0.50.
Поскольку обычно значения V относительно низкие, в течение длительного времени считалось, что распределение препарата в тканях минимально.
Некоторые красители, способные циркулировать в сосудистом русле, могут применяться для оценки объема плазмы или объема крови при известном гематокрите. Такие вещества, как ионы хлоридов или бромидов, которые распределяются достаточно быстро во внеклеточной жидкости, но не проходят через клеточные мембраны, могут применяться для оценки объема внеклеточной жидкости. Общий объем жидкости организма может быть приблизительно оценен по распределению тяжелой воды (D20) или определенных липофильных, но слабо связывающихся веществ, таких как антипирин.
В фармакокинетике принято считать такие параметры, как клиренс и кажущийся объем распределения независимыми и имеющими физиологическое обоснование. Так, клиренс напрямую отражает механизмы элиминации препарата, а кажущийся объем распределения - процесс установления равновесного распределения препарата в организме.
Способы введения препарата.
Пути введения лекарственных веществ подразделяются на энтеральные и парентеральные в зависимости от того, связаны ли они с ЖКТ. Кроме того, существуют внутри - и внесосудистые пути введения. Путь введения оказывает существенное, а порой решающее влияние на поступление лекарственного вещества в системный кровоток, иными словами, на биодоступность препарата.
При перроральном введении препараты, подвергающиеся интенсивному метаболизму, могут при первичном прохождении через кишечную стенку и главным образом печень в процессе абсорбции подвергаться метаболическим превращениям (рис.3).
Рис.3.
Эффект первичного прохождения
лекарственного вещества через печень.
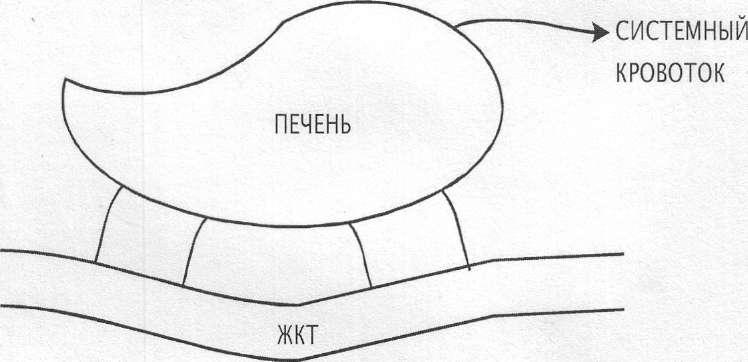
Такой вид биотрансформации часто называют пресистемным метаболизмом. Явление пресистемного метаболизма имеет большое значение в фармакокинетике. Оно ограничивает степень биодоступности многих лекарственных веществ, несмотря на их полное всасывание в ЖКТ. Кроме того, образующиеся в результате этого процесса метаболиты могут вызвать нежелательные побочные явления. С другой стороны, явление пресистемного метаболизма целенаправленно используется при создании пролекарств, способных более полно всасываться и/или обладающих другими преимуществами по сравнению с исходным веществом.
Внутривенное введение. Сразу после быстрого внутривенного введения (болюсного) введения препарат становится объектом распределения одного или нескольких способов элиминации. Большинство препаратов распределяются достаточно быстро. Элиминация препарата после достижения равновесного распределения для многих препаратов описывается в рамках кинетики первого порядка. Это означает, что скорость протекания такого процесса пропорциональна количеству, или концентрации субстрата (препарата), в системе. Константа пропорциональности называется кинетикой скорости процесса. Кинетика таких лекарственных препаратов достаточно хорошо описывается традиционной однокамерной линейной ФК - моделью.
При этом можно записать следующее уравнение, отражающее динамику процесса:
![]()
![]() ,
где
,
где
А - количество препарата в организме в момент времени t,
АЕ - количество препарата, элиминировавшего из организма (количество препарата, выведенного из организма различными путями, а также превращенного в метаболиты) к моменту времени t,
![]()
![]() -
константа скорости элиминации в данном
случае процесса первого порядка.
-
константа скорости элиминации в данном
случае процесса первого порядка.
Константа скорости элиминации представляет собой сумму соответствующих констант, относящихся к различным путям элиминации (ч-1, день-1 и т.п.).
С учетом соотношения между количеством препарата в организме и его концентрацией в плазме можно переписать предыдущее уравнение так:
![]()
![]() , или
, или
![]()
![]() .
.
Интегрируя полученное уравнение по времени в пределах от 0 до 1, получим соотношение
![]()
![]() ,
,
которое представляет собой зависимость натуральных логарифмов от времени. Последнее уравнение демонстрирует, что после установления равновесного распределения препарата такая зависимость является линейной.
При условии практически мгновенного распределения препарата после его внутривенного введения начальная концентрация препаратора в плазме Со является функцией введенной дозы (Div) и кажущегося объема распределения (V):
![]()
![]() ,
,
Значит, измерив концентрацию препарата в плазме в различные моменты времени после внутривенного введения и построив по имеющимся измерениям график линейной зависимости 1пС от t, можно графическим методом оценить такие значения ФК - параметров, как константа скорости элиминации и кажущийся объем распределения препарата. Этот метод оценки ФК - параметров называется линейной регрессией. Он достаточно прост, однако имеет ряд существенных недостатков: требует измерения концентраций после достижения равновесного распределения и в пределах одного и того же интервала дозирования. Метод предполагает практически мгновенное установление равновесного распределения, хотя известно, что для многих препаратов его установление требует некоторого промежутка времени. Кроме того, последнее уравнение обычно дает завышенную оценку кажущегося объема распределения препарата.
Константу скорости элиминации можно вычислить также исходя из соотношения

 ,
где
,
где
T1/2 - период полувыведения препарата, или время полувыведения
(промежуток времени, который требуется для снижения концентрации препарата на 50%), определяемый непосредственно из построенного графика. В рамках линейной кинетики, или кинетики первого порядка, период полувыведения - величина постоянная, не зависит от дозы или начальной концентрации препарата в плазме. При этом он может быть выражен через независимые ФК- препараты как
![]()
![]() .
.
Внутривенное
введение препарата с постоянной скоростью
в течение короткого промежутка времени
(короткая внутривенная инфузия препарата).
Некоторые
препараты, требующие внутривенного
введения, не вводятся болюсно во избежание
возможной токсичности в результате
такого мгновенного резкого повышения
их концентрации в крови. Например, такие
препараты, как теофиллин, прокаинамид,
многие антибиотики, вводятся в течение
50-60 минут и более. Изменение количества
препарата в крови (А) во время внутривенного
введения с постоянной скоростью k0
(например, мг/мин) и в соответствии с
процессом элиминации первого порядка
с константой скорости kel
задается уравнением: ![]()
![]() .
.
В этом случае также предлагается, что равновесное распределение препарата в организме достигается практически мгновенно (традиционная однокамерная ФК - модель).
Концентрация в плазме растет во время инфузии. В момент окончания внутривенного введения желаемой дозы препарата за время Т концентрация препарата в плазме достигает максимального значения и далее снижается в соответствии с линейной кинетикой.
Уравнение справедливо, если предположить достижение равновесного распределения препарата в момент окончания инфузии.
Типичный ФК - профиль концентрации препарата в плазме во время и после окончания короткой инфузии представлен на рис. 4.

Рис.4. Общий вид ФК - кривой при внутривенном введении препарата с помощью короткой инфузии.
Оценить кажущийся объем распределения препарата в этом случае можно, рассмотрев уравнение для максимальной концентрации. Такая оценка тоже не является достаточно точной, но она обычно вернее, чем полученная из соответствующего уравнения для болюсного введения препарата.
Максимальная, или пиковая, концентрация после внутривенной инфузии всегда меньше, чем после болюсного введения эквивалентной дозы препарата. Чем меньше скорость внутривенной инфузии определенной дозы препарата, тем ниже будет достигаемая максимальная концентрация препарата в плазме. Кроме того, поскольку Cmах представляет собой линейную функцию от скорости введения ko, увеличение в определенное число раз скорости введения (за счет соответствующего увеличения вводимой дозы при сохранении продолжительности инфузии Т) приводит к возрастанию максимальной концентрации препарата в плазме в то же число раз.
Непрерывная инфузия препарата с постоянной скоростью.
Непрерывное введение лекарственных средств с целью создания их постоянной концентрации в крови может осуществляться с помощью внутривенной или внутриартериальной инфузии. Такой внутрисосудистый способ введения препарата моделируется при условии мгновенного его появления в центральной камере модели.
ФК-профиль концентрации препарата в плазме при таком способе введения представлен на рис. 5. Видно, что в течение некоторого времени концентрация препарата растет, но при продолжении инфузии достигает своего предельного уровня – плато, или стационарного уровня (Сss). Такая стационарная концентрация устанавливается, когда количество препарата в организме достигает уровня, при котором скорость элиминации препарата (в случае линейной кинетики kel∙A) становится равной постоянной скорости поступления препарата (ko). Если скорость поступления препарата становится равной скорости его элиминации, изменение количества препарата в организме dA/dt=0 или изменение концентрации препарата dC/dt=0 - это означает, что стационарное состояние достигнуто. При таком способе внутривенного введения в рамках линейной кинетики устанавливающаяся со временем стационарная концентрация равна: Css=ko/(kel ∙V).

Рис. 5. Общий вид ФК-кривой при введения препарата путем продолжительной внутривенной инфузии с постоянной скоростью.
Cчитается, что при таком режиме дозирования после достижения стационарного состояния концентрация препарата в крови поддерживается на постоянном уровне. Конечно, реальности колебания концентрация препарата в крови происходят и в этом случае из-за флуктуаций показателей процесса элиминации и скорости инфузии, но они незначительны. Создание постоянного желаемого уровня препарата с помощью непрерывной инфузии с постоянной скоростью (кинетический процесс нулевого порядка, скорость протекания которого постоянна) в течение выбранного интервала дозирования является оптимальным способом введения многих лекарственных препаратов.
С клинической точки зрения также интересно, сколько времени занимает процесс установления желаемой стационарной концентрации препарата при таком режиме его введения. Для препаратов, поведение которых в организме может быть описано линейной однокамерной моделью (быстрое распределение), известно достаточно простое соотношение между временем установления такой стационарной концентрации и периодом полувыведения препарата. Половина стационарного уровня концентрации достигается за время, равное периоду полувыведения. За следующий период инфузии, равный четырем периодам полувыведения, уровень концентрации достигает значения в пределах 10% коридора вблизи желаемого стационарного уровня. А время достижения концентрации препарата около 97% от ее стационарного уровня составляет порядка 5 периодов полувыведения. Получается, что скорость приближения к плато концентрации препарата в крови в случае его непрерывного внутрисосудистого введения не зависит от скорости этого введения и определяется только параметрами процесса элиминации самого препарата (kel или Т1/2).
Внесосудистое введение. При пероральном, внутримышечном и других способах внесосудистого введения препарата необходимо учитывать процесс всасывания препарата из места введения. Скорость изменения количества препарата в организме зависит от скорости абсорбции и скорости элиминации:
![]()
![]() .
.
Чем быстрее препарат всасывается, тем больше будет значение его пиковой концентрации после получения определенной дозы и тем меньше будет интервал времени достижения этой максимальной концентрации.
Процесс всасывания многих лекарственных препаратов может быть достаточно хорошо приближен кинетикой первого порядка с константой скорости абсорбции kabs. Тогда при условии линейного процесса элиминации препарата, то есть кинетики первого порядка с константой скорости элиминации kel, скорость изменения количества препарата в единственной камере такой ФК - модели может быть выражена:
![]()
![]() ,
где
,
где
А - количество препарата в организме, Aabs - количество препарата в месте всасывания.
Как обычно, интегрируя последнее уравнение и переходя с помощью кажущегося объема распределения (V) от количества препарата к его концентрации в крови (С), получаем уравнение изменения концентрации препарата во времени для традиционной линейной однокамерной ФК - модели:

 , где
, где
F - фракция, или часть, введенной дозы препарата (D), достигшая кровотока.
Константа скорости всасывания обычно больше, чем константа скорости элиминации. В этом случае после окончания процесса всасывания препарата последнее уравнение упрощается и описывается только процесс элиминации.
Надо заметить, что до недавнего времени внутрисосудистая непрерывная инфузия препарата с постоянной скоростью была единственным доступным способом создания постоянного уровня концентрации в крови или тканях. В настоящее время разработаны различные лекарственные формы препаратов для перорального, интравагинального, внутримышечного введения, обеспечивающие поступление препарата в кровь с постоянной скоростью в соответствии с кинетикой нулевого порядка.
Повторяющееся (интермиттирующее) дозирование. Рассмотрим достаточно часто встречающийся режим лекарственной терапии - введение одинаковых доз препарата через одинаковые промежутки времени (интервал
дозирования). Если рассматривать динамику концентрации препарата в плазме после его внесосудистого введения в рамках отдельного интервала дозирования, то концентрация сначала растет, затем снижается в соответствии с соотношением скоростей всасывания, распределения и выведения.
Методы оценки основных фармакокинетических показателей.
Однокамерная модель.
Подробное описание всех деталей процесса распределения препарата во внутренней среде организма представляет собой исключительно сложную задачу. Модель, детально описывающая этот процесс, включала бы огромное количество различных параметров, которые все равно было бы невозможно идентифицировать по нескольким измерениям концентрации препарата в крови. Поэтому такая модель оказалась бы бесполезна с практической точки зрения. Фармакокинетика ограничивается формальным описанием процессов переноса вещества, приводящих к количественным изменениям концентрации препарата в организме. Поэтому в рамках ФК появляется возможность строить достаточно простые математические модели кинетики изучаемого препарата, включающие лишь несколько основных ФК - параметров. Мы покажем, как параметры таких кинетических моделей удается идентифицировать по крайне ограниченным измерениям концентрации препарата в тест - ткани. Такой упрощенный подход к моделированию без учета молекулярных механизмов приводит к уровню формализации, допускающему использование хорошо разработанного аппарата математического моделирования и теории оптимизации. Для описания кинетических процессов используются динамические модели - системы дифференциальных уравнений. При построении ФК - модели принимается во внимание принцип простоты, справедливый для биологической кинетики и означающий, что модель процесса должна содержать минимальное число уравнений. Вместе с тем число уравнений должно быть достаточным для описания главной функции процесса.
ФК при модельном подходе к анализу данных принято выделять в качестве единиц системы камеры (или компартменты), и само моделирование носит название камерное (или компартментное). Камера
может не иметь никаких пространственных ограничений в анатомическом смысле и необязательно должна совпадать с определенным органом. ФК - камера - это часть организма, в которой равномерно распределен препарат. Для целей фармакокинетического моделирования выделяется такое число камер, которое необходимо в этом случае для адекватного модельного описания имеющихся опытных данных.
Минимальным числом камер является одна, соответственно, получающаяся при этом модель - однокамерная. Как говорилось выше, если равновесие между кровью и тканями достигается достаточно быстро по сравнению с процессами всасывания, биотрансформации и экскреции, организм может быть представлен одной камерой (с кажущимся объемом распределения V) все молекулы препарата в которой с равной вероятностью могут быть выведены. Поскольку весь организм при этом представлен единственной камерой, предполагается ФК - однородность всех тканей, в которые способен проникнуть препарат. Это не означает, что препарат равномерно распределен во всех органах и тканях организма, это означает только, что в рассматриваемый период времени соотношения между уровнями препарата в тест - ткани и других тканях организма остаются постоянными. В соответствии с законами линейной кинетики скорость изменения количества препарата в единственной камере однокамерной модели пропорциональна его количеству в камере. Т.е. в рамках линейной кинетики предполагается, что сразу после введения препарата непосредственно в тест-камеру его концентрация в этой единственной камере модели становится равновесной и убывает по моноэкспоненциальному закону (с константой скорости элиминации Kel) без видимой фазы распределения. Тогда после внутрисосудистого введения дозы препарата D его концентрация снижается во времени в соответствии со следующим уравнением:
C(t)
=
С
о
ехр{-
kel∙t}
= ![]()
![]() exp{-kel∙t}.
exp{-kel∙t}.
На рис. 6 представлены схемы двух вариантов структуры однокамерной модели для описания различных способов введения препарата:
поступление всего препарата непосредственно в тест-камеру (внутривенное введение: болюсное или постоянная инфузия);
постепенное поступление препарата в тест-камеру из некоторого депо (учитывает процесс абсорбции при внесосудистом введении).
а б
Рис.
6.
Схема однокамерной модели в случае
внутривенного (а) и внесосудистого (б)
способа введения препарата.
Двухкамерная и многокамерные модели.
Некоторое усложнение модели кинетики с увеличением числа камер модели до двух и более может быть произведено в случае, если математический анализ ФК - данных показывает неадекватность описания их моделью с более простой структурой или необходимость такого усложнения диктуется известными свойствами данного препарата.
При наличии достаточного числа измерений концентрации простейшим графическим способом такой проверки и подбора структуры модели для описания ФК - препарата является представление получающегося ФК - препарата в логарифмическом масштабе. Невозможность достаточно хорошей аппроксимации наблюдений, полученных после внутривенного введения, прямой (метод линейной регрессии), визуальное обнаружение перегибов регрессионной линии говорит, скорее всего, о многокамерном характере поведения изучаемого препарата. В этом случае предлагается быстрое распределение препарата в одной камере, а затем относительно медленный обмен с другой или несколькими камерами. При этом считается, что в совокупности тканей и биологических жидкостей организма с фармакокинетической точки зрения можно выделить, по меньшей мере, две камеры, которые отличаются степенью доступности для проникновения препарата. Поскольку проникновение препарата в ту или иную ткань зависит от ее кровоснабжения, относительно доступными для препаратов обычно считают кровь, интерстициальную жидкость и сильно васкуляризованные ткани сердца, мозга, легких, печени, почек, эндокринных желез, а менее доступными - все остальные ткани.
Линейной многокамерной модели соответствует система дифференциональных уровней баланса масс с постоянными коэффициентами (константами скорости переноса). Изменение количества (или концентрации) препарата в каждой камере модели представляет собой разность между скоростью поступления препарата в камеру и скоростью распределения или выведения из нее. Эти модели, так же как и однокамерная модель, могут описывать различные варианты введения препарата (входы модели). Так,
двухкамерная модель состоит из центральной и периферической камер, которые формализуют две группы тканей и между которыми предлагается обратимый обмен препаратам. Обычно применяемая схема модели представлена на рис. 7.

Рис. 7. Общая схема двухкамерной (1 - центральная и 2 - периферическая камера) модели для внесосудистого (перорального) введения препарата.
Считается, что препарат поступает в центральную камеру и необратимо выводится только из центральной камеры. При использовании такой модели появляются еще два дополнительных параметра: константы скоростей обмена между камерами K12 и К21. Так, кинетическая система уравнений двухкамерной линейной ФК-модели может быть записана следующим образом:
![]()
![]() +
+![]()
![]() ,
,
![]()
![]() , где
, где
X1, X2 - количества препарата в центральной и периферической камерах модели. С помощью начальных условий можно задать болюсное внутривенное введение препарата: X1(0) = D; X2(0) = 0.
Наблюдения за системой, т.е. измерения крови в моменты времени ti задаются следующим уравнением:
![]()
![]() , где
, где
V1 - кажущийся объем распределения препарата в центральной камере модели.
Общая форма зависимости в виде суммы двух экспонент для концентрации препарата в центральной камере двухкамерной модели в случае внутривенного введения имеет вид:
![]()
![]() .
.
Часто фазу относительно быстрого снижения концентрации в центральной камере модели, характеризующуюся скоростным параметром α, называют фазой распределения, а фазу относительно медленного снижения концентрации, характеризуются скоростным параметром β - фазой элиминации. Однако надо иметь в виду, что такое деление достаточно условно, поскольку невозможно разделить эти фазы или соответствующие им процессы во времени.
В ходе моделирования переход от количества препарата к его концентрации в центральной камере производится с помощью коэффициента пропорциональности - кажущегося объема распределения препарата в центральной камере (V1). Тогда после внутривенного введения препарата объем его распределения в центральной камере может быть оценен как V1 =D/(A1+A2).
Значение V1 обычно меньше, чем значение соответствующего кажущегося объема распределения препарата (V). Поэтому высокие значения концентраций препарата в крови (D/V1) могут создаваться сразу после его болюсного внутривенного введения. Несмотря на достаточно быстрое снижение этих концентраций, для некоторых препаратов высокие их уровня могут оказаться опасными. Помочь в решении этой проблемы может относительно медленное внутривенное введение таких препаратов. Известно, что после любого другого способа введения создаваемые пиковые концентрации всегда будут ниже, чем после болюсного. Такие различия в значениях концентрации препарата, который распределяется практически мгновенно, зависят от времени инфузии и периода полувыведения препарата. Так, длительность инфузии должна быть сравнима с периодом полувыведения препарата для того, чтобы можно было наблюдать 50% снижения пиковой концентрации. На практике бывает достаточно инфузии меньшей длительности, поскольку многие препараты имеют выраженную фазу распределения и демонстрируют многокомпартментное поведение после их внутривенного введения. Начальное быстрое снижение концентрации препарата в крови после внутривенного болюсного введения определяется в основном константой скорости α - фазы распределения препарата, или периодом полураспределения, то есть 0.693/α.
В случае двухкамерной модели также вводится понятие кажущегося объема распределения препарата в периферической камере модели. Найти значение кажущегося объема распределения препарата в периферической камере достаточно сложно, поскольку обычно концентрации препарата измеряются лишь в центральной камере. Чаще всего количество препарата в периферической камере, рассчитываемое в процессе моделирования, нормируется на массу тела пациента.
Для характеристики фармакокинетики препарата в обеих камерах вводится понятие кажущегося объема распределения в момент квазистационарного состояния (Vss), то есть состояния, при котором скорость изменения количества препарата в периферической камере во времени равна 0:
![]()
![]() , где
, где
Х2
- количество препарата в периферической
камере. При таком условии можно оценить
отношение количества препарата в
периферической камере к его концентрации
в центральной камере как ![]()
![]() ∙
∙![]()
![]() , а кажущийся объем распределения в
системе двух камер при квазистационарном
состоянии как отношение количества
препарата, присутствующего в организме
после установления квазистационарного
состояния (X1+Х2),
к концентрации препарата в центральной
камере:
, а кажущийся объем распределения в
системе двух камер при квазистационарном
состоянии как отношение количества
препарата, присутствующего в организме
после установления квазистационарного
состояния (X1+Х2),
к концентрации препарата в центральной
камере:
Vss
= ![]()
![]() ,
,
Важным свойством стационарного объема распределения является его независимость от параметров процесса элиминации. Однако с помощью показателя Vss можно рассчитывать общее количество препарата в обеих камерах модели только после установления квазистационарного состояния. Поэтому наряду с понятием стационарного объема распределения используется также понятие кажущегося объема распределения в β - фазе (Vβ). Значение такого кинетического объема распределения препарата можно связать со значением кажущегося объема распределения препарата в центральной камере:
![]()
![]() .
.
:Можно сказать, что сразу после внутривенного введения в нулевой момент общий объем распределения препарата определяется объемом его распределения в центральной камере. По мере распределения препарата в периферической камере общий объем распределения возрастет, достигая величин Vss и Vβ .
В
случае линейной двухкамерной модели
выражение для общего клиренса после
внутривенного введения препарата
аналогично случаю однокамерной модели:
Сl
=
Ке1
∙ ![]()
![]() .
.
Нельзя в рамках двухкамерной модели путать скоростные константы Ке1 и β. Значение константы скорости элиминации (Ке1) при этом может быть оценена по значению константы скорости β.
Кроме того, при увеличении числа камер до двух и более вводится понятие клиренса распределения, или клиренса препарата, характеризующего его перенос между камерами.
Если для адекватного описания ФК - препарата требуется камерная модель большей размерности, мы будем говорить, что для этого препарата характерен многокамерный тип поведения в организме. В ФК специально выделяют класс линейных многокамерных моделей с элиминацией препарата только из центральной камеры (multiple-compartment mammillary model).
В случае линейной многокамерной модели общий вид зависимости концентрации в тест - камере от времени после получения дозы D препарата можно выразить как линейную комбинацию n экспонент.
С ростом размерности задачи растут вычислительные трудности при использовании любого из методов. Однако на практике, особенно при использовании данных TJIM, число камер модели редко выбирается больше трех. Тем не менее любая ФК - модель обязательнo должна быть проверена с точки зрения структурной идентифицируемости, то есть возможности получения однозначной оценки её параметров по имеющимся наблюдениям.
Если речь идет об исследовании фармакокинетики препарата, при использовании многокамерных моделей возникает вопрос об определении числа камер, оптимального для адекватного описания имеющихся ФК - данных. Решение этого вопроса во многом зависит от наличия информации об изучаемом препарате. Кроме того, выбор структуры и идентифицируемость параметров модели определяются и распределением моментов измерений во времени. Так, моменты времени взятия проб тест - ткани должны обеспечивать возможность идентификации ФК - параметров всех фаз поступления, распределение и выведение препарата. Ограниченная измерительная информация не позволит выявить сложный характер поведения препарата, что будет приводить к выбору модели меньшей размерности. В дальнейшем при использовании такой модели появление новых измерений может выявить её неадекватность и невозможность описания реальных данных на основе такой упрощенной модели. Это особенно важно при изучении препаратов, не имеющих фармакокинетических аналогов. При этом обычно проводят предварительное ФК - исследование, предусматривающее отбор возможно большего числа проб тест - ткани, а затем на его основе пытаются уточнить характер поведения препарата в организме и установить оптимальный протокол проведения основного ФК - исследования. Таким образом, не только структура ФК - модели зависит от имеющихся измерений концентрации, но и схема измерений, в свою очередь, зависит от того, какой ФК - моделью предполагается аппроксимировать получаемые наблюдения.
При использовании данных TЛM для индивидуализации фармакотерапии речь может идти о выборе ФК - модели, которая бы, не противореча информации о характере поведения препарата в организме, давала возможность достаточно хорошо описать имеющиеся ограниченные данные TJIM, и главное, достаточно точно прогнозировать изменение ФК - профиля в ответ на изменение режима модели дозирования. Возникает задача выбора адекватной модели минимальной размерности. Оптимизация процедуры TJIM и выбор подходящей стратегии измерений концентрации может помочь в этом случае получить максимум информации с помощью взятия минимума проб. Опыт показывает, что для многих препаратов достаточно хорошие результаты оптимизации терапии могут быть получены в случае грамотного проведения процедуры TJIM на основе традиционных однокамерной и двухкамерной моделей фармакокинетики. Таким образом, даже такие относительно простые ФК - модели оказываются полезными для индивидуализации фармакотерапии.
