
10_Gidroliz_soley
.pdf
CH3COONH4 = NH4+ + CH3COO .
Уравнения гидролиза:
CH3COONH4 + H2O  NH 3
NH 3  H 2O + CH3COOH;
H 2O + CH3COOH;
NH4+ + CH3COO + HOH
+ HOH 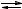 NH 3
NH 3  H 2O + CH3COOH.
H 2O + CH3COOH.
Константу гидролиза таких солей рассчитывают по формуле
Kг |
Kw |
. |
|
KоснованияKкислоты |
|||
|
|
Значение рН растворов таких солей зависит от относительной силы кислоты и основания, образующих соль. Константы диссоциации уксусной
кислоты |
и |
гидрата |
аммиака |
равны: |
K |
CH 3 COOH |
1,8 10 |
5 |
и |
|||
|
|
|||||||||||
K |
NH 3 H 2 O |
1,8 10 |
5 |
, поэтому среда в растворе данной соли нейтральная. |
|
|||||||
|
|
|
||||||||||
Вобщем случае, если Kоснования Kкислоты , реакция раствора соли
слабощелочная, если Kоснования Kкислоты , реакция раствора соли слабокислая,
если Kоснования Kкислоты , реакция раствора соли нейтральная, pH = 7.
Гидролиз соли (NH4)2S.
Соли слабого основания и слабой многоосновной кислоты в растворе гидролизованы практически полностью:
(NH4)2S + HOH  NH4HS + NH 3
NH4HS + NH 3  H 2O ,
H 2O ,
NH4HS + HOH  NH 3
NH 3  H 2O + H2S.
H 2O + H2S.
Соли одноосновных слабых кислоты и слабых оснований
Гидролиз соли Al(CH3COO)3.
Соли слабых одноосновных кислот и слабых оснований при гидролизе образуют осадки основных солей и слабые кислоты:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Al(CH3COO)3 + HOH |
Al(OH)(CH3COO)2↓ + CH3COOH, |
Al(OH)(CH3COO)2 + HOH |
Al(OH)2CH3COO↓ + CH3COOH. |
НЕОБРАТИМЫЙ ГИДРОЛИЗ
Гидролиз солей многоосновными слабых кислот и слабых оснований
Гидролиз солей многоосновных слабых кислот (летучих или малорастворимых) и слабых оснований протекает необратимо с образованием слабой кислоты и слабого основания
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Такие соли в водных растворах не существуют.
Совместный гидролиз солей
Совместный гидролиз проходит, если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al3+, Fe3+, Cr3+, NH4+ и др.), а другая - анион слабой кислоты (СO32 , SiO32 , S2
и др.). В результате образуются кислота и основание.
Примеры.
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl; 2Al3+ + 3S2 + 6H2O = 2Al(OH)3 + 3H2S.
+ 6H2O = 2Al(OH)3 + 3H2S.
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl;
2NH4+ + SiO32 + (H2O) = 2NH3 + H2SiO3.
+ (H2O) = 2NH3 + H2SiO3.
Cовместный гидролиз солей слабых оснований типа M(OH)2 (M – Cu, Ni, Co, Mn, Mg и другие) и солей угольной кислоты приводит к образованию основных солей и угольной кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4;
2Cu2+ + 2CO32 + H2O = (CuOH)2CO3 + CO2.
+ H2O = (CuOH)2CO3 + CO2.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Процесс протекает необратимо, поскольку один из продуктов - H2CO3
разлагается с образованием газообразного вещества.
Знание закономерностей гидролиза необходимо при практическом использовании растворов солей. К примеру, при очистке природных и сточных вод от катионов металлов гидролиз стремятся усилить, сделать необратимым,
чтобы продукты реакции можно было удалить в виде осадков. Напротив,
гидролиз при синтезе неорганических веществ в водных растворах – неприятное осложнение. В получаемом веществе появляются примеси продуктов гидролиза. Например, при получении сульфата меди (II) в его кристаллы попадает примесь (CuOH)2SO4. Поэтому кристаллизацию сульфата меди (II) производят из растворов, содержащих некоторое количество серной кислоты, добавленной с целью подавления гидролиза.
ЗАКЛЮЧЕНИЕ
 Гидролиз соли - процесс обменного взаимодействия ионов соли с молекулами воды.
Гидролиз соли - процесс обменного взаимодействия ионов соли с молекулами воды.
 Гидролизу подвергаются соли, образованные
Гидролизу подвергаются соли, образованные  слабыми кислотами и сильными основаниями;
слабыми кислотами и сильными основаниями;
слабыми основаниями и сильными кислотами;
слабыми кислотами и слабыми основаниями.
 Количественные характеристики гидролиза солей - константа гидролиза и степень гидролиза.
Количественные характеристики гидролиза солей - константа гидролиза и степень гидролиза.
 Чем слабее основание или кислота, образующие соль, тем больше степень гидролиза соли.
Чем слабее основание или кислота, образующие соль, тем больше степень гидролиза соли.
 Степень гидролиза увеличивается при повышении температуры и разбавлении раствора.
Степень гидролиза увеличивается при повышении температуры и разбавлении раствора.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

 Гидролиз солей, образованных многоосновными слабыми кислотами
Гидролиз солей, образованных многоосновными слабыми кислотами
(летучими или малорастворимыми) и слабыми основаниями, протекает
необратимо.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1.Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.– СПб: Химиздат, 2001. - 512 с.: ил.
2.Степин Б.Д., Цветков А.А. Неорганическая химия: Учебник для вузов /
Б.Д. Степин, А.А. Цветков.– М.: Высш. шк., 1994.- 608 с.: ил.
3.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.:
Химия, 2000. - 592 с.: ил.
4.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов,
обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 3-е
изд., испр. - М.: Высш. шк., 2007. - 527 с.: ил.
5.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия": в 3 т.
Т. 1: Физико-химические основы неорганической химии / М.Е. Тамм,
Ю.Д. Третьяков / под ред. Ю.Д. Третьякова. - М.: Академия, 2004. –
240 с.: ил.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
