
KORROZ_LABOR_2009_6
.pdfго металла, станет равным нулю, а анодный ток протектора будет равен по абсолютной величине катодному току защищаемой детали.
Дальнейшее смещение компромиссного потенциала в отрицательном направлении нежелательно, т.к. при этом возрастает количество выделяющегося на детали водорода, что может привести к растворению его в металле и привести к ухудшению его механических свойств.
2. Методика работы
В данной работе использован метод коррозионных диаграмм. Применение компьютера (программа написана на языке Pascal) позволяет быстро рассчитывать характеристики коррозионного процесса и демонстрировать на коррозионной диаграмме изменения в ходе поляризационных кривых, произошедшие в результате изменения того или иного параметра.
Перед началом компьютерного моделирования студенту необходимо получить задание у преподавателя и приготовить исходные данные. Ввод данных производится с клавиатуры. Значения величин отделяются друг от друга пробелами. В этом случае до нажатия клавиши «Enter» могут быть внесены исправления в строке данных.
Программа позволяет после построения коррозионной диаграммы вернуться к результатам расчетов. После изменения параметров коррозионного процесса на коррозионной диаграмме появляются два графика: исходный (базовый) и измененный. При повторном изменении параметров базовый вариант графика остается.
Моделирование электродных процессов может быть проведено также с использованием электронных таблиц в пакете Excel.
3. Порядок работы
На первом этапе работы необходимо с клавиатуры компьютера ввести величины, необходимые для расчета равновесных потенциалов предполагаемых анодного и катодного процессов. Компьютер рассчитывает равновесные потенциалы по уравнению (7.3) и может выдать сообщение о невозможности корро-
31
зии металла в данных условиях, после чего предлагает изменить параметры процессов. В том случае, если коррозия исследуемого металла в данных условиях возможна, предлагается ввести кинетические константы анодного и ка-
тодного процессов (константы b и iO в уравнениии Тафеля). После их ввода производится расчет величин коррозионного тока и компромиссного потенциала, а после ввода молярной массы корродирующего металла – расчет скорости коррозии. Затем по выбранному исследователем шагу изменения потенциала (количеству точек на графике (10–20)) рассчитываются значения анодных и катодных токов и потенциалов, после чего программа переходит в графический режим и на дисплее появляется демонстрационный график.
На втором этапе работы предлагается изменить какие-либо параметры процессов с целью проследить их влияние на величины коррозионного тока и компромиссного потенциала.
Можно изменить: 1) активности окисленных форм реагентов; 2) площади анодных и катодных участков; 3) тафелевские константы анодного процесса; 4) тафелевские константы катодного процесса. Можно также отказаться от изменений и выйти из программы. После нажатия выбранной клавиши, соответствующей пункту меню, компьютер запрашивает изменяемые параметры, а затем представляет для сравнения два графика: начальный вариант и вариант после изменения параметров.
При исследовании эффективности протекторной защиты первый этап работы выполняют так же, как и при исследовании влияния параметров на характеристики коррозионного процесса. На втором этапе работы предлагается ввести необходимые величины для расчета равновесного потенциала анодного процесса на протекторе, а затем кинетические константы этого процесса. Для построения графиков (варианты без протектора и с протектором) необходимо задать шаг изменения потенциала при расчетах анодных токов защищаемого металла и протектора и катодного тока. Чем меньше будет шаг изменения потенциала (т.е. больше расчетных значений), тем точнее будет выполнено построение коррозионной диаграммы.
32

Если предложенный вариант протекторной защиты окажется неэффективным, можно изменить некоторые параметры: 1) активности окисленных форм реагентов в анодных процессах на защищаемом металле и протекторе; 2) площадь поверхности протектора; 3) тафелевские константы анодного процесса на протекторе. Изменение параметров можно проводить неоднократно, добиваясь наиболее оптимального варианта.
Результаты заносят в таблицу.
|
|
|
|
|
|
Таблица 4.1 |
|
|
|
|
|
|
|
|
|
Изменяемый |
ϕap |
ϕкp |
Iкор |
ϕстац |
Са |
Vкор |
|
параметр |
|
||||||
|
|
|
|
|
|
|
|
Контрольные вопросы:
1.Какие процессы протекают на границе металл–электролит при электрохимической коррозии металлов в кислотах?
2.Как определить равновесные потенциалы этих процессов?
3.Каково условие установления компромиссного потенциала?
4.Какими способами можно снизить скорость электрохимического растворения металла?
33
РАБОТА № 5. КАТОДНАЯ ЗАЩИТА МЕТАЛЛОВ ОТ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Цель работы – исследование влияния плотности катодного тока от внешнего источника питания на скорость анодного растворения металлов в электролитах, оценка эффективности электрохимической зашиты.
1. Теоретические основы метода катодной защиты
Скорость коррозии металлов, контактирующих с растворами электролитов, существенно зависит от величины электродного потенциала. Смещение потенциала в отрицательном направлении внешним током приводит к уменьшению скорости растворения металла. При увеличении плотности катодного тока и достижении равновесного потенциала металла процесс коррозии может полностью прекратиться.
В качестве вспомогательных электродов (анодов) обычно используют стальные изделия (обрезки балок, рельсов и т.п.) или графит. Необходимый электродный потенциал защищаемой конструкции можно поддерживать с помощью стабильного электрода сравнения и подключенного к нему потенциостата, регулирующего величину выпрямленного тока.
Метод удобно использовать для электрохимической защиты подземных трубопроводов, телефонных кабелей, стальных свай в грунте, внешних поверхностей подземных нефтяных или бензиновых цистерн, внутренних поверхностей стальных цистерн для воды и химических реактивов.
Рассмотрим сущность метода катодной защиты на примере коррозии железа (стали) в растворе серной кислоты. Электрохимический процесс коррозии складывается из анодного (5.1) и катодного (5.2) этапов:
Fe = Fe2+ + 2e , |
(5.1) |
2H + +2e = H 2 . |
(5.2) |
Для упрощения рассуждений примем, что система не слишком удалена от равновесия и на коррозионной диаграмме наблюдается линейная связь плотно-
34

сти тока и перенапряжения (см. рис. 5.1). В отсутствие защитного тока от внешнего источника питания, на металле установится стационарный потенциал
(ϕс , мВ), при котором скорости анодного ( Ia , мА/см2) и катодного ( Iк ,
мА/см2) этапов одинаковы:
|
|
|
Ia = Iк |
= Ic . |
(5.3) |
|||
Максимальная скорость коррозия (Vmax, моль/м2с) в этом случае будет |
||||||||
определяться величиной анодного тока Ia : |
|
|||||||
|
|
|
Vmax |
= |
Ia |
. |
(5.4) |
|
|
|
|
|
|||||
|
|
|
|
|
|
2FS |
|
|
гдепостояннаяФарадеяF = 96500 Кл/моль, аS – площадьповерхностиобразца, м2. |
||||||||
I |
|
|
|
|
|
|
|
|
Iз |
К |
|
|
|
|
|
А |
|
Iк |
d |
b |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Iкор |
iвн |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Iа |
|
|
a |
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ϕ |
|
|
ϕр |
ϕ |
ст1 |
ϕ |
ст |
|
ϕр |
|
|
ме |
|
|
|
к |
|
||
Рис. 5.1. Коррозионная диаграмма «плотность тока–потенциал» в условиях катодной защиты: А – анодная поляризационная зависимость; К – катодная поляризационная зависимость
При подключении защищаемого образца к отрицательному полюсу источника тока и смещении его потенциала в отрицательном направлении скорость анодной полуреакции (5.1) будет уменьшаться, а катодной (5.2) – увеличиваться. При этом соотношение (5.3) нарушается. Например, при потенциале
ϕст1 (см. рис. 5.1):
Iк > Ia . |
(5.5) |
35
Уменьшение скорости анодной стадии при пропускании катодного тока эквивалентно уменьшению скорости коррозии стального образца. Внешний ток
Iвн, необходимый для смещения потенциала до значения ϕ с т 1 , представляет разность между катодным и анодным токами.
(5.6)
Его величина на рис. 5.1 равна отрезку аb. Когда потенциал корроди-
рующего металла сравняется с равновесным для анодной стадии ϕ pa , скорость электрохимической коррозии уменьшится до нуля. Ток, обеспечивающий пол-
ную катодную защиту, называется током полной защиты IЗ. Его величине на рис. 5.1 соответствует отрезок cd.
Таким образом, при полной защите образца скорость анодной стадии равна нулю, а скорость катодной стадии определяется величиной внешнего тока, полностью расходуется на восстановление окислителя. Выделяющийся при этом водород может привести к ряду нежелательных последствий: вспучиванию и отслаиванию органических покрытий, водородному охрупчиванию и растрескиванию металла. Поэтому чрезмерная перезащита стальных конструк-
ций токами, превышающими IЗ, недопустима.
Сместить стационарный потенциал металла в отрицательном направлении можно также обеспечив электрический контакт с другим металлом (протектором), имеющим в данной среде более отрицательный равновесный потенциал ϕпрр (см. рис. 5.2). Так как равновесные потенциалы могут сильно из-
меняться в зависимости от активностей потенциалопределяющих ионов, то в первом приближении можно ориентироваться на стандартные потенциалы ме-
таллов. Например, для стального образца (ϕFe0 = −0, 44 В) можно в качестве протектора выбрать цинк (ϕZn0 =−0,76 В). В этом случае стационарный потен-
циал электрохимической системы устанавливается таким, чтобы суммарный анодный ток был равен (по модулю) суммарному катодному току. Предполо-
36
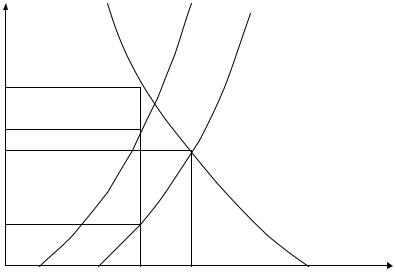
жим, что весь катодный процесс будет сосредоточен на катодных участках защищаемого металла (т.е. катодная вольтамперная характеристика К останется прежней). Как видно из рис. 5.2, величина анодного тока, протекающего через
защищаемую деталь, снизится от Iкор до Iмеа . Такая защита будет тем эффек-
тивнее, чем больше будет площадь металла-протектора, чем более отрицательным будет равновесный потенциал анодного процесса на протекторе и чем больше будет плотность тока обмена этого процесса (т.е. чем круче будет его анодная вольтамперная характеристика).
Эффективность защиты обычно выражают через коэффициент торможе-
ния γ или степень защиты Z. Коэффициент торможения показывает, во сколь-
ко раз уменьшается скорость коррозии в результате применения катодной защиты:
|
|
γ = |
Vнз |
, |
(5.7) |
|
|
V |
|||
|
|
|
|||
|
|
|
з |
|
|
где V нз и Vз |
– скорость коррозии незащищенного и защищенного образцов |
||||
соответственно. |
|
|
|
|
|
I |
К |
|
Апр |
|
Аме |
Iк
Iпра
Iкор
Iмеа
ϕр |
ϕр |
ϕ" |
ϕ |
ст |
ϕр |
ϕ |
пр |
ме |
ст |
|
пр |
|
Рис. 5.2. Коррозионная диаграмма при защите металла протектором
37
Степень защиты указывает на то, насколько полно удалось подавить коррозию благодаря применению этого метода:
Z = |
V нз |
− V з |
|
|
|
|
. |
(5.8) |
|
|
|
|||
|
|
V нз |
|
|
При полной защите образца скорость коррозии становится равной нулю, коэффициент торможения – бесконечности, а степень защиты – единице.
2.Описание установки и порядок проведения эксперимента
Вработе исследуют катодную защиту стальных образцов в растворе серной кислоты. Пять стальных образцов зачищают наждачной бумагой, тщательно протирают и взвешивают на аналитических весах. Затем каждый из них погружают в отдельный стакан с кислотой. Образцы в первых трех стаканах и вспомогательные электроды из свинца соединяют последовательно, как показано на рис. 5.3 и подключают к внешнему источнику постоянного тока. К крайнему стальному образцу подключается отрицательный полюс источника тока, к крайнему свинцовому – положительный. Уровень кислоты в стаканах выбира-
ется таким, чтобы площадь соприкосновения с кислотой (S, см2) у каждого по-
следующего образца увеличивалась приблизительно в два раза по сравнению с предыдущим. Это необходимо для того, чтобы при пропускании одинакового по величине электрического тока (I, мА) плотность тока ( i , мА/см2) на меж-
фазной границе заметно изменялась.
i = |
I |
, |
(5.9) |
|
S |
||||
|
|
|
Величина пропускаемого тока (50–80 мA) контролируется амперметром. В четвертый стакан вспомогательный электрод не погружается, так как через стальной образец, находящийся в нем, ток не пропускается и образец корродирует без защиты. Пятый образец соединяют проводником электрического тока с цинковым протектором и помещают их в пятый стакан с кислотой.
38

Рис. 5.3. Схема установки для исследования катодной зашиты металлов от коррозии: 1 – источник питания постоянного тока; 2 – реостат; 3 – амперметр;
4 – вспомогательные свинцовые электроды; 5 – исследуемые стальные электроды
Длительность эксперимента составляет 10 минут. Во время опыта необходимо произвести замеры электродного потенциала каждого из стальных образцов. Для этого в каждый из пяти стаканов последовательно помещают медный электрод сравнения и относительно него вольтметром измеряют потенциал стального электрода. Для уменьшения омического падения напряжения в электролите и повышения точности измерения разности потенциалов медный электрод необходимо размещать вблизи стального. После отключения тока стальные электроды вынимают из электролита, промывают водой и сушат. Затем их взвешивают и производят замер величины поверхности, контактирующей с кислотой.
Результаты измерений записывают в табл. 5.1. На основании табличных данных рассчитывают скорость коррозии (V, моль/см2):
V = |
mo −mк |
, |
(5.10) |
MSτ |
где mo и mк , – начальная и конечная масса стального электрода, г;
М– молярная масса железа, г/моль;
S – площадь рабочей поверхности электрода, см2;
τ – время опыта, с.
39

По уравнениям (5.7)–(5.9) рассчитывают коэффициент торможения, степень защиты и плотность катодного тока. Оформляя отчет к данной лабораторной работе, строят графические зависимости электродного потенциала, коэффициента торможения и степени защиты от плотности тока.
|
|
|
|
|
|
Таблица 5.1 |
|
|
Результаты испытаний |
|
|
||||
|
|
|
|
|
|
|
|
Результаты измерений |
|
|
|
Номер образца |
|
|
|
1 |
2 |
3 |
4 |
5 |
|||
|
|||||||
Рабочая поверхность S, см2 |
|
|
|
|
|
|
|
Начальная масса mO, г |
|
|
|
|
|
|
|
Конечная масса mK, г |
|
|
|
|
|
|
|
Убыль (mO – mK), г |
|
|
|
|
|
|
|
Электродный потенциал, В
Скорость коррозии V, моль/см2·с
Коэффициент торможения γ
Степень защиты Z
Плотность тока, мА/см2
В выводах кратко резюмируют полученные результаты, обсуждают влияние плотности катодного тока на эффективность защиты, дают практические рекомендации о выборе оптимальных условий зашиты.
Контрольные вопросы:
1.В чем заключается сущность метода катодной защиты?
2.Как выражается эффективность защиты?
3.Каков порядок проведения работы?
4.Что характеризует ток полной защиты?
5.В чем заключаются недостатки метода катодной защиты?
40
