- •Физические свойства.[1]
- •2.Водородная связь
- •3. Ассоциативные структуры воды(ас).
- •3.1. Геометрические параметры ас
- •Ион гидроксония
- •542.22 Cm-1 , 1747.71 cm-1 , 1747.71 cm-1 , 3570.33 cm-1 , 3760.27 cm-1 , 3761.06 cm-1 .
- •141.04 Cm-1 , 209.15 cm-1 , 225.59 cm-1 , 235.26 cm-1 , 402.28 cm-1 ,
- •822.96 Cm-1 ,1641.66 cm-1 , 1645.51 cm-1 , 3542.08 cm-1 , 3667.11 cm-1 , 3791.57 cm-1 , 3883.53 cm-1 .
- •Тример воды
- •Литература
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ им. В. Н. Каразина
Кафедра химического материаловедения
Квантово-химические расчёты димера и тримера воды
Курсовая работа
студента группы Х-131
Химического факультета
ЗЯБКО НИКИТЫ АЛЕКСАНДРОВИЧА
Научный руководитель
Харьков 2011
РЕФЕРАТ
ЗЯБКО Н. А. Квантово-химические расчёты димера и тримера воды. –
Рукопись.
Страниц - 45 , рисунков - 24 ,таблиц - , литературных источников - 16 .
Произведина оброботка литературного материала в котором рассматривались расчёты как и геометрических так и квантово-энергетических параметров кластеров воды.
Было уделено отдельное внимание димеру и тримеру воды, в плане практичесой проверки адекватности полученных из литературы данных.
Высказаны выводы относительно закономерностей изменения определённых параметров в ряду мономер ------ димер ------- тример.
ABSTRACT
Zyabko N.A Quantum-chemical calculations of the dimer and trimer of water. -
Manuscript.
Pages - 45, figures - 24 , tables - , literary sources – 16 .
Produced the processing of literary material which looked like calculations of geometrical and quantum-energy parameters of water clusters.
Was paid special attention to the dimers and trimers of the water in terms of practical verification of the adequacy of the data obtained from literature.
Made conclusions about the regularities in changes of certain parameters in a row: monomer ----- dimer ----- trimer.
ABSTRACT
Zyabko N.A. Quantenchemische Berechnungen der Dimere und Trimere von Wasser. -
Manuskript.
Seiten - 45 , Zahlen – 24, Tabellen - , literarischen Quellen - 16 .
Produziert die Verarbeitung von Material, das literarische wie Berechnungen von geometrischen und Quanten-Energie-Parameter von Wasser-Clustern angesehen.
Bezahlt wurde besonderes Augenmerk auf die Dimere und Trimere des Wassers in der praktischen Prüfung der Eignung der Daten aus der Literatur.
Made Rückschlüsse auf die Regelmäßigkeiten in Änderungen von bestimmten Parametern in einer Zeile: Monomer ----- Dimer ----- Trimer.
Содержание
Вода. Физически свойства.
Водородная связь.
Ассоциативные структуры воды
3.1. Геометрические и энергетические параметры АС
3.2. Спектральные(ИК) параметры AC.
КХ расчёты димера и тримеров воды
Выводы
Литература
1. Вода. Физические свойства.
Вода́ (оксидводорода) —химическое веществов виде прозрачнойжидкости, не имеющейцвета(в маломобъёме),запахаивкуса(принормальных условиях).Химическая формула:Н2O. Втвёрдомсостоянииназываетсяльдомилиснегом, а вгазообразном— водянымпаром. Около 71 % поверхностиЗемлипокрыто водой (океаны,моря,озёра,реки,лёдна полюсах).[1]
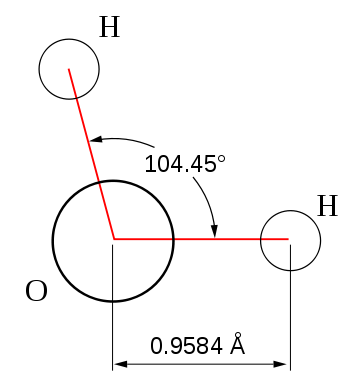
Рис.1. Схематическое изображение молекулы воды.
Является хорошим сильнополярнымрастворителем. В природных условиях всегда содержит растворённые вещества (соли,газы).
Вода имеет ключевое значение в создании и поддержании жизнина Земле, в химическом строенииживых организмов, в формированииклиматаипогоды.
Виды воды[1]
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом. Водный париоблакавнебе,морская водаиайсберги, горныеледникии горныереки,водоносные слоив земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Мягкая водаижёсткая вода— по содержанию катионов кальция и магния
По изотопам молекулы:
Лёгкая вода(обычная)
Тяжёлая вода(дейтериевая)
Сверхтяжёлая вода(тритиевая)
По названию:
Талая вода
Пресная вода
Дождевая вода
Морская вода
Подземные воды
Минеральная вода
Солоноватая вода(en:Brackish water)
Питьевая вода,Водопроводная вода
Дистиллированная водаидеионизированная вода
Сточные воды
Ливневая водаилиповерхностные воды
Мёртвая водаиЖивая вода— виды воды изсказок(со сказочными свойствами)
Святая вода— особый вид воды согласно религиозным учениям
Поливода
Структурированная вода— термин, применяемый в различныхнеакадемических теориях.
Физические свойства.[1]
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбыв замерзающихводоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
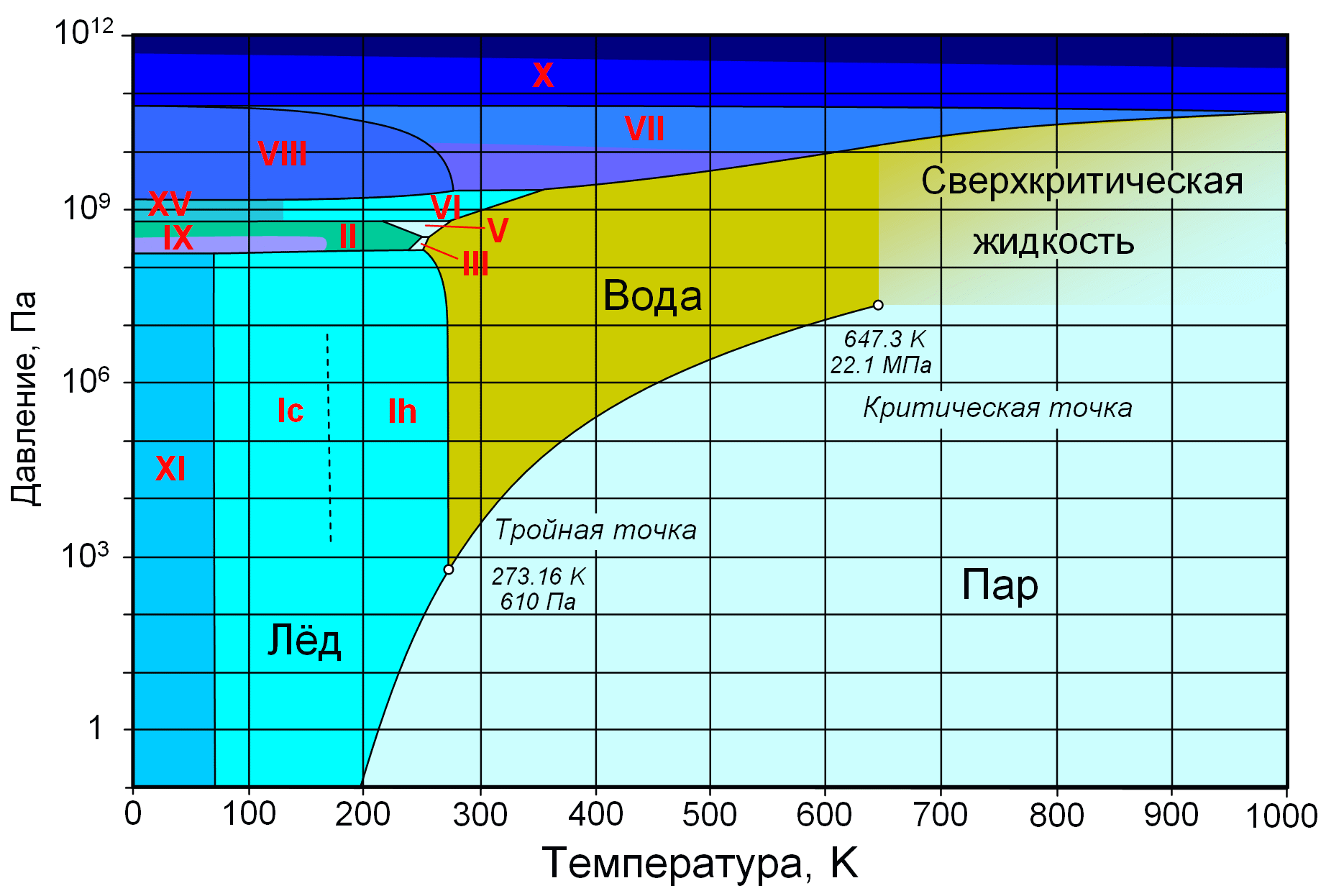
Рис.2. Фазовая диаграмма воды(римскимы числами обозначены модификации соответствующих фаз ).
Высокая температура и удельная теплота плавления(0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг ), по сравнению ссоединениями водородас похожим молекулярным весом.
Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрацияпротонов(точнее, ионовгидроксонияH3O+) и гидроксильных ионовHO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.[2]
Вода имеет показатель преломленияn=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественнымпарниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действиямикроволновой печи.
2.Водородная связь
|
Водородная связь (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.[2,3] Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.
В
образовании Н-связи определяющую роль
играет электроотрицательность
участвующих в связи атомов – способность
оттягивать на себя электроны химической
связи от атома – партнера, участвующего
в этой связи. В результате на атоме А
с повышенной электроотрицательностью
возникает частичный отрицательный
заряд
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия. В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом:
Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение.[3] Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As, Н3Sb. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) – результат образования водородных связей. В настоящее время надежный способ обнаружить Н-связи дают спектральные методы (чаще всего инфракрасная спектроскопия). Спектральные характеристики групп АН, связанных водородными связями, заметно отличаются от тех случаев, когда такая связь отсутствует. Кроме того, если структурные исследования показывают, что расстояние между атомами B – Н меньше суммы Ван-дер-Ваальсовых радиусов, то считают, что присутствие Н-связи установлено. Борная кислота В(ОН)3 имеет слоистую кристаллическую структуру, каждая молекула связана водородными связями с тремя другими молекулами. Упаковка молекул в слое образует паркетный узор, собранный из шестиугольников:
Рис.3. «Каркасная» структуры борной кислоты.[4] Большинство органических веществ не растворимо в воде, когда такое правило нарушается, то, чаще всего, это результат вмешательства водородных связей.
Кислород
и азот – основные доноры протонов,
они берут на себя функцию атома А в
рассмотренной ранее триаде
Существует эмпирическое правило: если органическое вещество содержит не более трех атомов углерода на один атом кислорода, то оно легко растворяется в воде:
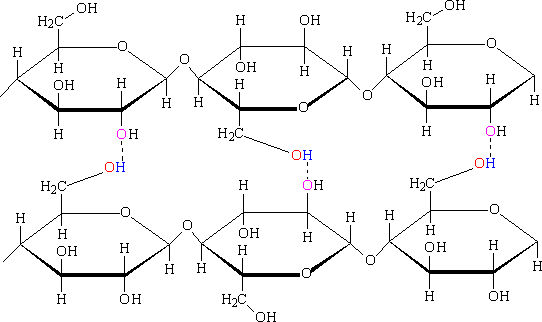
Рис.4. Графическое прояснение вышеприведенного закона.[4] Бензол весьма незначительно растворим в воде, но если заменить одну группу СН на N, то получим пиридин С5Н5N, который смешивается с водой в любых соотношениях. Важную роль играют водородные связи в полимерах и биополимерах. В целлюлозе – основном компоненте древесины – гидроксильные группы, расположены в виде боковых групп полимерной цепи, собранной из циклических фрагментов. Несмотря на сравнительно слабую энергию каждой отдельной Н-связи, их взаимодействие на всем протяжении полимерной молекулы приводит к столь мощному межмолекулярному взаимодействию, что растворение целлюлозы становится возможным лишь при использовании экзотического высокополярного растворителя – реактива Швейцера (аммиачный комплекс гидроксида меди).[5]
Рис.5. Целюлоза.
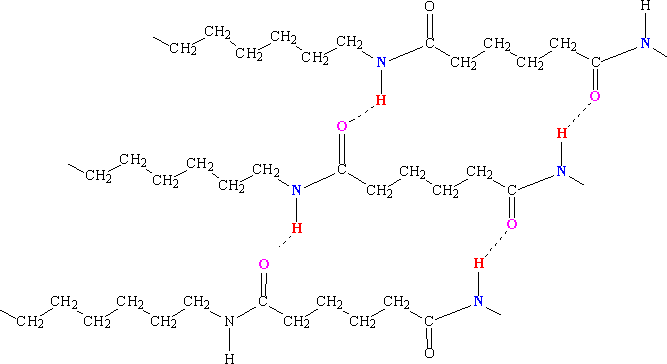
В полиамидах (капрон, нейлон) Н-связи возникают между карбонильными и аминогруппами >С=О···Н–N<, расположенными в соседних полимерных цепях:
Это приводит к образованию кристаллических областей в структуре полимера и увеличению его механической прочности.[5]
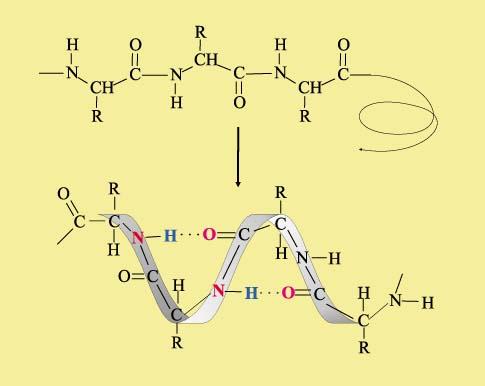
Аналогичным образом происходит объединение параллельно уложенных полимерных цепочек в белках, однако Н-связи предоставляют белковым молекулам также иной способ упаковки – в виде спирали, при этом витки спирали закреплены все теми же водородными связями, возникающими между карбонильной и аминогруппой:
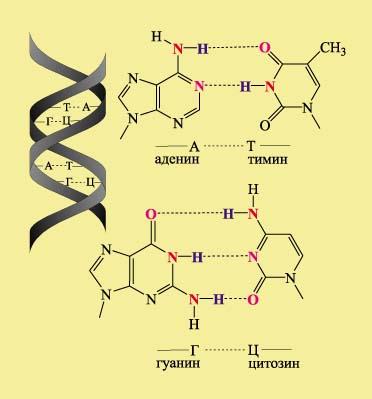
Рис.6. Фрагмент белка[5] В молекуле ДНК записана вся информация о конкретном живом организме в виде чередующихся циклических фрагментов, содержащих карбонильные и аминогруппы. Таких фрагментов четыре типа: аденин, тимин, цитозин и гуанин. Они расположены в виде боковых подвесков вдоль всей полимерной молекулы ДНК. Порядок чередования этих фрагментов определяет индивидуальность каждого живого существа., При парном взаимодействие карбонильных С=О и аминогрупп NH, а также аминогрупп NH и атомов азота, не содержащих водород, возникают Н-связи, именно они удерживает две молекулы ДНК в форме широко известной двойной спирали:
Рис. 7. Фрагмент ДНК
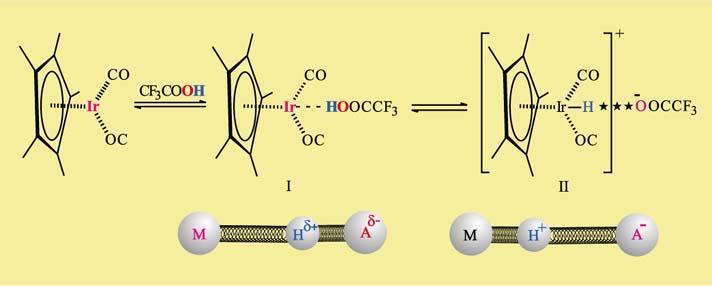
К образованию Н-связи (в роли акцепторов протонов) склонны комплексы некоторых переходных металлов; наиболее расположены к участию в Н-связи комплексы металлов VI–VIII групп. Для того, чтобы такая связь возникла в ряде случае необходимо участие мощного донора протона, например, трифторуксусной кислоты. На первой стадии (см. рисунок ниже) возникает Н-связь с участием атома металла иридия (комплекс I), играющего роль акцептора B. Далее при понижении температуры (от комнатной до –50° С) протон переходит к металлу и появляется обычная связь М–Н. Все превращения обратимы, в зависимости от температуры протон может передвигаться либо к металлу, либо к своему донору – аниону кислоты.[5] На второй стадии металл (комплекс II) принимает протон, а вместе с ним положительный заряд и становится катионом. Образуется обычное ионное соединение (как NaCl). Однако, перейдя к металлу, протон сохраняет свою постоянную тягу к различным акцепторам, в данном случае к аниону кислоты. В результате появляется Н-связь (отмечена звездочками), дополнительно стягивающая ионную пару:
|

 -
, а на атоме-партнере – положительный
-
, а на атоме-партнере – положительный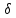 +, химическая связь при этом поляризуется.
+, химическая связь при этом поляризуется. (водородную
связь обычно обозначают точечной
линией). Атом А, химически связанный
с Н, называют донором протона (лат.
donare – дарить, жертвовать), а B – его
акцептором (лат. acceptor – приемщик). Чаще
всего истинного «донорства» нет, и Н
остается химически связанным с А.[3]
(водородную
связь обычно обозначают точечной
линией). Атом А, химически связанный
с Н, называют донором протона (лат.
donare – дарить, жертвовать), а B – его
акцептором (лат. acceptor – приемщик). Чаще
всего истинного «донорства» нет, и Н
остается химически связанным с А.[3]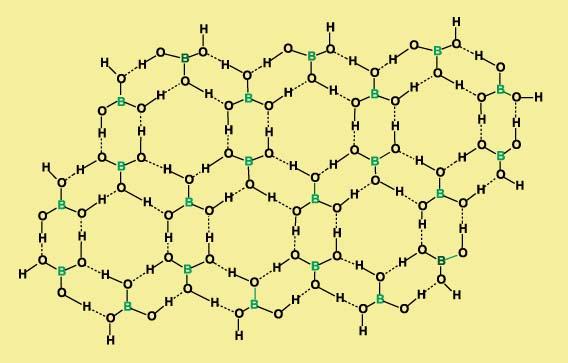
 Они
же, чаще всего, выступают в роли
акцепторов (атом B). Благодаря этому
некоторые органические вещества,
содержащие O и N в роли атома Б, могут
растворяться в воде (роль атома А
исполняет кислород воды). Водородные
связи между органическим веществом
и водой помогают «растащить» молекулы
органического вещества, переводя его
в водный раствор.
Они
же, чаще всего, выступают в роли
акцепторов (атом B). Благодаря этому
некоторые органические вещества,
содержащие O и N в роли атома Б, могут
растворяться в воде (роль атома А
исполняет кислород воды). Водородные
связи между органическим веществом
и водой помогают «растащить» молекулы
органического вещества, переводя его
в водный раствор.