
- •Расчет физико-химических свойств
- •Содержание
- •Введение
- •1. Метод аскадского
- •1.1. Сущность метода инкрементов
- •1.2. Расчет Ван-дер-ваальсовых объемов
- •Значения межмолекулярных радиусов ряда атомов
- •Значения длин связи между некоторыми атомами
- •(А) – полистирола, (б) – полидиметилсилоксана
- •2. Расчет основных физико-химических свойств полимеров
- •2.1 Характерные температуры полимеров
- •Температура стеклования
- •Температура плавления
- •Температура деструкции
- •2.2. Оптические свойства полимера Показатель преломления
- •Коэффициент оптической чувствительности по напряжению
- •2.3. Диэлектрическая проницаемость полимеров
- •2.4. Растворимость полимеров Плотность энергии когезии полимеров и параметр растворимости Гильдебранда
- •Критерий растворимости
- •2.5. Теплоемкость
- •3. Заключение
- •4. Задание для курсовой работы
- •Список литературы
- •Приложение 3.1 Значение параметров δi и γi различных атомов и типов межмолекулярного взаимодействия для расчета температуры плавления по формуле (8)
- •Приложение 3.2
- •Приложение 5.1 Атомные рефракции ряда атомов в органических соединениях по Эйзенлору для расчета коэффициента преломления
- •Приложение 5.2
- •Приложение 7 Величины ихарактеризующие вклады каждого атома и типа межмолекулярного взаимодействия в теплоемкость.
- •Приложение 8 Индивидуальное задание студентам для выполнения курсовой работы
- •450078, Г. Уфа, ул. Чернышевского, 145, к. 227; тел. (347) 278-69-85.
1.2. Расчет Ван-дер-ваальсовых объемов
Физический смысл ван-дер-ваальсового объема атома – его деформация (изменение объема) за счет химических связей, а физический смысл ван-дер-ваальсового объема повторяющегося звена – это собственный объем звена, занимаемый в полимере в случае плотной упаковки, поскольку ван-дер-ваальсовые радиусы соответствуют равновесному положению атомов звена относительно повторяющихся звеньев данной макромолекулы или соседних макромолекул [1, 2].
Ван-дер-ваальсовый объем атома Viописывается сферой с межмолекулярным радиусомR. Еслиi-ый атом химически связан с другими атомами, эти соседние атомы отсекают от него часть сферы, поскольку сумма межмолекулярных радиусов двух валентно-связанных атомов всегда больше, чем расстояние между их центрами (рис. 1). Это расстояние представляет собой длину химической связиdi. При межмолекулярном взаимодействии атомы не спрессовываются, а касаются друг друга, и это обстоятельство положено в основу определения молекулярных (Ван-дер-ваальсовых) радиусов с помощью рентгеноструктурного анализа [3].
Инкремент объема атома Viвычисляется как объем сферы этого атома минус объемы шаровых сегментов, отсекаемых на этой сфере соседними валентно-связанными атомами:
|
|
(4) |
где Vi– инкремент собственного объема атома,R– межмолекулярный (Ван-дер-ваальсовый) радиус этого атома,hi– высота шарового сегмента, который отсекается на данном атоме соседним химически связанным с ним атомом (рис. 1).

Рис. 1. Геометрические представления о межмолекулярном (а) и химическом (б) взаимодействии двух атомов
Величина hi рассчитывается как:
|
|
(5) |
г
Таблица
1
Атом R,
Å
Атом R,
Å C
1,80 F
1,50 H
1,17 Cl
1,78 N
1,36 Br
1,95 O
1,57 Si
2,10
Значения межмолекулярных радиусов ряда атомов
Таблица 2
Значения длин связи между некоторыми атомами
|
Связь * |
di, Å |
Связь |
di, Å |
Связь |
di, Å |
Связь |
di, Å |
Связь |
di, Å |
|
|
1,54 |
|
1,08 |
|
1,37 |
|
1,34 |
|
1,85 |
|
|
1,48 |
|
1,50 |
|
1,31 |
|
1,31 |
|
1,08 |
|
|
1,40 |
|
1,37 |
|
1,27 |
|
1,77 |
|
1,08 |
|
|
1,34 |
|
1,28 |
|
1,34 |
|
1,64 |
|
1,64 |
|
|
1,19 |
|
1,40 |
|
1,88 |
|
1,94 |
|
1,20 |
* – при одинаковых символах связи более длинная соответствует присоединению данного атома к алифатическому атому углерода, а более короткая – к ароматическому (приложение 1).
По значениям R и di можно рассчитать Ван-дер-ваальсовые объемы огромного числа комбинаций атомов, которые валентно связанны с другими разнообразными атомами. Для расчетов собственного объема повторяющегося звена полимера удобно иметь табулированные значения инкрементов объемов различных атомов. Результаты таких расчетов приведены в приложении 1. Ван-дер-ваальсовый объем повторяющегося звена полимеров складывается из инкрементов Vi для различных атомов, входящих в повторяющееся звено полимера [1, 2].
В качестве примера приведен расчет Ван-дер-ваальсового объема повторяющегося звена полистирола и полидиметилсилоксана. Во-первых, необходимо наглядно изобразить данные структуры и определить валентные связи между атомами (рис. 2).
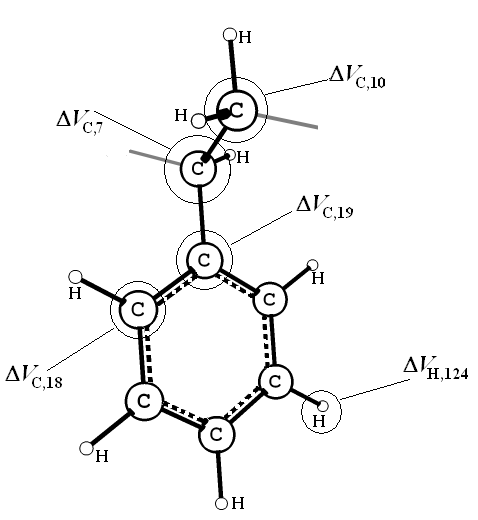

|
а |
б |
Рис. 2. Структуры повторяющихся звеньев полимеров:
