
- •Физические основы
- •Введение
- •1. Термодинамическая система. Основные параметры состояния системы
- •2. Уравнение состояния идеального газа. Идеальная газовая смесь
- •3. Термодинамические процессы
- •4. Внутренняя энергия термодинамической системы
- •5. Энтальпия
- •6. Эквивалентность теплоты и работы. Историческая справка
- •7. Особенности процессов передачи энергии в форме теплоты и работы
- •8. Первый закон термодинамики для замкнутой термодинамической системы
- •9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы при изменении объёма системы
- •10. Понятие теплоемкости
- •10.1. Общие сведения
- •10.2. Теплоёмкость газов
- •10.3. Теплоёмкость твёрдых и жидких тел
- •Значения температуры Дебая для некоторых веществ
- •11. Открытие энтропии
- •12. Второй закон термодинамики
- •13. Третий закон термодинамики
- •14. Основные соотношения для расчёта процессов в идеальном газе
- •15. Расчёт процессов в идеальном газе
- •15.1. Изохорный процесс
- •15.2. Изобарный процесс
- •15.3. Изотермический процесс
- •15.4. Адиабатный процесс
- •15.5 Политропный процесс
- •Значение показателя политропы n для основных термодинамических процессов в идеальном газе
- •Библиографический список
- •2.1. Уравнение Клапейрона
- •2.2. Понятие моль вещества
- •2.3. Закон Авогадро
- •2.4. Уравнение Клапейрона – Менделеева
- •3.1. Смеси идеальных газов
- •3.2. Парциальные давления в газовой смеси. Закон Дальтона
- •3.3. Приведённый объём компонента газовой смеси. Закон Амага
- •3.4. Химический состав газовой смеси
- •3.5. Газовая постоянная идеальной газовой смеси
- •3.6. Кажущаяся молярная масса идеальной газовой смеси
- •3.7. Удельный объём или плотность газовой смеси
- •3.6. Соотношение между массовыми и объёмными долями идеальной газовой смеси
- •4.1. Обратимые и равновесные процессы
- •5.1. Удельные объёмные и мольные теплоёмкости
- •5.2. Соотношения между удельными теплоёмкостями для газов и газовых смесей
- •5.3. Расчёт значений средних теплоёмкостей
- •5.4. Теплоёмкость смеси идеальных газов
- •6.1. Существование энтропии у реальных (не идеальных) газов
- •6.2. Существование энтропии у систем, находящихся в жидком или твёрдом состояниях
- •Оглавление
- •194021, Санкт-Петербург, Институтский пер., 5.
2.3. Закон Авогадро
Закон Авогадро был открыт экспериментальным путём в 1811 году и напрямую с числом Авогадро не связан. Формулируется он следующим образом.
При одинаковых давлениях и одинаковых температурах в равных объёмах различных идеальных газов содержится одинаковое число молекул, или, что то же самое, при одинаковых давлениях и одинаковых температурах моль различных идеальных газов занимает одинаковый объём.
Опытным путём установлено, что при нормальных условиях (н.у. То = 273,15 К и ро = 1 атм = 101325 Па) один киломоль любого идеального газа занимает объём 22,4136 ≈ 22,4 м3. Соответственно один моль будет занимать объём Vo = 22,4 · 10–3 м3.
Этот факт можно рассматривать, как следствие из закона Авогадро для н.у.
2.4. Уравнение Клапейрона – Менделеева
Как уже отмечалось (п. 2.1 данного приложения), путём обобщения экспериментальных данных было получено уравнение состояния идеального газа (1). Учитывая определение удельного объёма его можно переписать в виде:
![]() или
р V
= M
R
T, (1)
или
р V
= M
R
T, (1)
где V – объём газа, м3; M – масса газа, кг.
Соотношение (1) справедливо всегда, в частности, оно будет выполняться для одного киломоля некоторого идеального газа, находящегося при нормальных условиях. Для такого случая, исходя из (1), можно записать:
![]() , (2)
, (2)
где
ро
и То
– нормальные давление и температура
соответственно
ро
= 101325 Па, То
= 273,15 К;
![]() –
объём, который занимает один киломоль
идеального газа при н.у.
–
объём, который занимает один киломоль
идеального газа при н.у.![]() =
22,4 м3;
М1
– масса одного киломоля газа, кг.
=
22,4 м3;
М1
– масса одного киломоля газа, кг.
Значение массы одного киломоля (103 молей) газа определяется (см. п. 2.2 формулу (2)) следующим образом:
М1 = μ · 1 · 103, (3)
где μ – молярная масса газа, кг/моль.
Подставляя (3) в (2) получаем:
![]() или
или
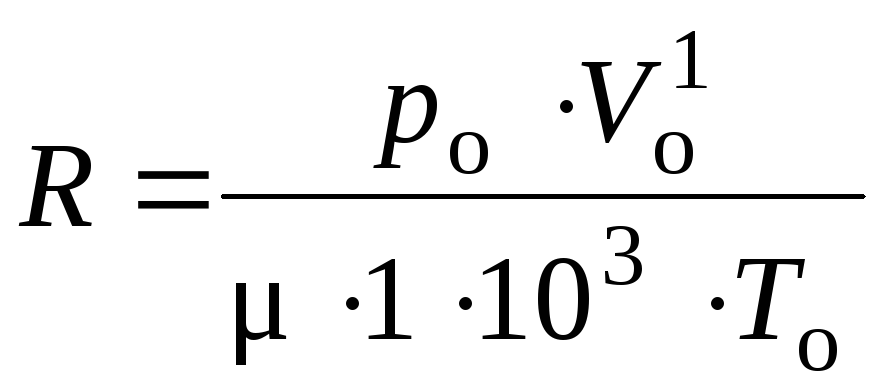 . (4)
. (4)
Подставляя
в (4) известные численные значения для
ро,
![]() иТо,
получаем:
иТо,
получаем:
![]() ,
Дж/(кг·К). (5)
,
Дж/(кг·К). (5)
Размерность у числа 8,314, стоящего в числителе (5) Дж/(моль·К). Это число обозначается буквой Rμ, Дж/(моль·К), и называется универсальной газовой постоянной.
С учётом такого обозначения вместо (5) можно записать:
![]() ,
Дж/(кг·К). (6)
,
Дж/(кг·К). (6)
Формула (6) позволяет определить значение газовой постоянной R для любого газа или газовой смеси, не прибегая к экспериментам, так как μ всегда известна.
Подставляя (6) в уравнение идеального газа (см. п.2.1 формула (1)) окончательно получаем уравнение состояния идеального газа в виде формулы Менделеева – Клапейрона:
![]() . (7)
. (7)
Приложение 3
3.1. Смеси идеальных газов
В технике часто расчёты проводятся не для чистых газов, а для газовых смесей.
Смесь идеальных газов можно рассматривать как идеальный газ, для которого уравнение состояния записывается в виде:
![]() или
или
![]() , (1)
, (1)
где рсм, υсм и Тсм – параметры состояния смеси – абсолютное давление, удельный объём и температура, соответственно, Па, м3/кг, К; Rсм – газовая постоянная смеси, Дж/(моль·К); Rμ – универсальная газовая постоянная, Rμ = 8,314 Дж/(моль·К); μсм – кажущаяся молярная масса смеси, кг/моль.
Чтобы иметь возможность проводить расчёты с использованием уравнения (1) необходимо знать значения величин υсм, Rсм, μсм.
Эти значения рассчитываются по известному химическому составу газовой смеси, который по условиям задачи всегда задан. (На практике он определяется с помощью газоанализатора).
