
Патофизиология (Пособие для резидентуры)
.pdf
ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ МИКРОЦИРКУЛЯЦИИ И МЕСТНОГО КРОВООБРАЩЕНИЯ |
9 |
создать с помощью лекарственных веществ. Для этого используют ганглиоблокаторы (вещества, замедляющие проведение импульсов в симпатических ганглиях), симпатолитики и адренолитические вещества (вещества, ингибирующие деятельность симпатических нервных синапсов).
В развитии миопаралитической артериальной гиперемии принимают участие образующиеся в окружающей ткани и стенке сосудов физиологически активные вещества. Это могут быть высвобождаемые из тучных клеток гистамин или вазодилататорные пептиды, образующиеся в тканях в результате повреждения (брадикинин, простагландин, простациклин и др.). Углекислый газ, молочная кислота, промежуточные продукты цикла Кребса, ионы калия, АДФ, аденозин и некоторые гормоны (например, натрийуретический гормон), NO (фактор релаксации), изменение рН в сторону ацидоза приводят к расширению артериол и капилляров. Выделяют различные виды патологической артериальной гиперемии:
Ангионевротическая гиперемия развивается в результате увеличения вазодилатирующего влияния, уменьшения вазоконстрикторных влияний.
Коллатеральная гиперемия – в результате сужения просвета артерии вследствие действия различных факторов происходит рефлекторное расширение ее проксимальных ветвей. При этом в центральной части области с нарушенным кровообращением развивается ишемия, а вокруг нее за счет расширения коллатералей – артериальная гиперемия.
Постанемическая гиперемия возникает в результате быстрого расширения артерий при ускоренном удалении свободной жидкости различного происхождения, накопившейся в полостях тела (плевральной, перитонеальной) и сдавливающей окружающие кровеносные сосуды, вызывая тем самым малокровие.
Вакатная гиперемия возникает в результате острого снижения атмосферного давления, приходящегося на поверхность тела (например, при использовании медицинских банок и т.д.).
Воспалительная гиперемия возникает в результате действия биологически активных веществ, образующихся в очаге повреждения.
Изменения микроциркуляции при артериальной гиперемии. При артериальной гиперемии в микроциркуляторных сосудах разница артериовенозных давлений, интенсивность кровообращения в капиллярах, внутрикапиллярное давление, а также количество функционирующих капилляров и венул возрастает. При этом увеличивается линейная и объемная скорость кровотока, что приводит к уменьшению диаметра осевого «цилиндра» кровотока (потока форменных элементов крови по центральной оси артериолы) /6/.
Повышение внутрикапиллярного давления увеличивает число функционирующих капилляров. В результате этого транскапиллярный обмен и лимфоток ускоряются. Если в стенке сосудов микроциркуляции возникают изменения, могут наблюдаться и кровоизлияния.
Признаки артериальной гиперемии. Вследствие переполнения артериальной кровью поверхностных сосудов кожи и слизистых оболочек, а также вследствие артериализации венозной крови (из-за увеличения содержания HbO2 в венозной крови) при артериальной гиперемии ткани приобретают ярко красный цвет. Температура поверхностных тканей повышается из-за ускорения их кровоснабжения артериальной кровью. Увеличение притока артериальной крови к органам и тканям приводит к ускорению реакций окисления и еще большему подъему температуры. Объем гиперемированной ткани или органа увеличивается. Расширение микрососудов, переполнение их кровью и увеличение в ткани содержания жидкостиприводиткувеличениюнапряжения(тургора) ткани.
Исход и значение артериальной гиперемии. Для организма артериальная гиперемия может иметь положительное и отрицательное значение. Так, при увеличении потребностей тканей важны ускоренная доставка кислорода и питательных веществ к ним, а также вывод из
101

|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
тканей продуктов метаболизма (физиологическая артериальная гиперемия). Роль артериальной гиперемии при этом можно расценить как положительную. При отсутствии необходимости в увеличении интенсивности кровообращения развитие артериальной гиперемии может иметь для организма отрицательное значение (патологическая артериальная гиперемия). Повышение местного давления в сосудах микроциркуляции приводит к нарушению целостности сосудистой стенки, просачиванию крови в ткани или переходу эритроцитов через сосудистую стенку (диапедез). Развитие таких изменений в ЦНС опасно. Например, при гипертоническом кризе приток большого объема крови к головному мозгу сопровождается шумом в ушах, головными болями, головокружением. В тяжелых случаях это может привести к геморрагическому инсульту.
9.6. Венознаягиперемия
Венозная гиперемия – полнокровие органов и тканей в результате затруднения оттока крови по венам. Ее также называют пассивной гиперемией или венозным застоем. Скорость кровотока в сосудах при этом снижается. Ниже приведены причины развития венозной гиперемии:
тромбы и эмболы в венах;компрессия вен извне опухолью, рубцом, отечной тканью и др.;
конституциональная слабость гладких мышц стенок вен;общие нарушения гемодинамики: недостаточность правого желудочка, ослабление
присасывающей функции грудной клетки (экссудативный плеврит, во время гемоторакса), затруднение кровотока в малом круге кровообращения (при пневмосклерозе, эмфиземе легких, при левожелудочковой недостаточности и т.д.).
Изменения микроциркуляции при венозной гиперемии. При венозном застое напол-
няются кровью венулы, которые до этого не функционировали, расширяются капилляры, расположенные вблизи венозной сети. Несмотря на то, что при венозной гиперемии общая площадь поперечного сечения сосудистого русла увеличивается, линейная скорость кровотока значительно снижается. Это приводит также к снижению объемной скорости кровотока и увеличению диаметра осевого «цилиндра» кровотока /6/. Итак, несмотря на расширение капиллярной сети и повышение внутрисосудистого давления, при венозной гиперемии снижается кровоснабжение органов и тканей. Давление повышается в той части вены, котороя располагается перед препятствием кровотоку. Это приводит к уменьшению артериовенозной разницы давлений и уменьшению скорости кровотока в артериях, капиллярах и венах. Если давление, создаваемое препятствием, повышаясь, становится равным диастолическому давлению в артериях, то во время диастолы сердца кровоток в сосудах останавливается, а при каждой систоле – вновь начинается. Такой кровоток называется толчкообразным. Если давление в венах перед препятствием превышает диастолическое давление в артериях, то ортоградный кровоток (с нормальным направлением) наблюдается только при систоле сердца. А в фазу диастолы из-за изменения градиента давления в сосудах наблюдается ретроградный (обратный) кровоток. Такой кровоток называется маятникообразным /7/.
Признаки венозной гиперемии. Во время венозной гиперемии снижение объемной скорости кровотока приводит к уменьшению поступления с кровью кислорода и питательных веществ к органу и замедлению вывода из ткани продуктов обмена. Поэтому уменьшается кровоснабжение ткани и в первую очередь, снабжение кислородом. Развивается циркуляторная и тканевая гипоксия. Вследствие увеличения теплоотдачи на поверхности тела температура кожи в отличие от внутренних органов понижается.
Повышение давления внутри капилляров и повышение проницаемости сосудистой стенки ведет к увеличению фильтрации жидкости в межклеточное пространство, затрудне-
102

ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ МИКРОЦИРКУЛЯЦИИ И МЕСТНОГО КРОВООБРАЩЕНИЯ |
9 |
нию реабсорбции (из-за уменьшения разности артериовенозных давлений), а это, в свою очередь, приводит к развитию отека. При венозной гиперемии объем органа увеличивается как за счет его кровенаполнения, так и за счет развития отека. Вследствие острого замедления скорости кровотока в капиллярах увеличивается переход кислорода крови в ткани, и большая часть гемоглобина оказывается восстановленной. Темно-красный цвет восстановленного гемоглобина под тонким слоем эпидермиса приобретает синюшный цвет, с чем и связывают развитие цианоза. Эти изменения в дистальных частях тела (например, на фалангах пальцев) называют акроцианозом.
Исходы венозной гиперемии. Длительная продолжительность венозной гиперемии приводит к напряжению вен, гипертрофии мышечного слоя их стенки /2/. Как результат вены принимают извилистый вид, развивается их варикозное расширение (варикоз) и флебосклероз. В результате длительной тканевой гипоксии функциональные элементы органов замещаются соединительной тканью. В качестве примера может служить развитие цирроза печени вследствие венозного застоя при сердечной недостаточности.
Закупорка тромбом таких магистральных сосудов, как воротная вена или нижняя полая вена, ведет к возникновению ряда общих гемодинамических расстройств. Так, задержка 90% крови в этих сосудах приводит к резкому снижению артериального давления, острому нарушению кровоснабжения сердца, мозга и других жизненно важных органов и летальному исходу.
В ряде случаев венозная гиперемия может быть полезной для организма. Например, незначительная циркуляторная гипоксия, возникающая при хроническом венозном застое, путем активации макрофагов и фибробластов стимулирует развитие соединительной ткани и ускоряет заживление ран. При туберкулезе легких здесь искусственно создают венозную гиперемию для ускорения развития соединительной ткани в туберкулезных кавернах. Развитие венозного застоя в очаге воспаления, облегчая эмиграцию лейкоцитов и предупреждая распространение инфекции, имеет защитное значение.
9.7. Ишемия
Ишемия – местное малокровие, возникающее в результате уменьшения или полного прекращения притока крови по артериям к тканям и органам.
По этиологии выделяют следующие виды ишемий: ангиоспастическую, обтурацион-
ную, компрессионную и ишемию, возникающую в результате неравномерного распределения крови в тканях.
Ангиоспастическая ишемия может развиться по нервному и гуморальному механизму. Это происходит в результате рефлекторного спазма артерий вследствие раздражения сосудосуживающих нервов или влияния физических (холод, тепло, механическое влияние), химических, биологических (бактерии, токсины) факторов. Иногда ангиоспазм может возникнуть условно рефлекторным путем (например, при эмоциональном перенапряжении). Помимо этого раздражение подкорковых структур, регулирующих сосудистый тонус, токсическими веществами или механическими факторами (опухоль головного мозга, кровоизлияние в мозг, повышение внутричерепного давления), воспаление промежуточного мозга сопровождаются острым ангиоспазмом.
Гуморальные механизмы ангиоспазма развиваются внутри- и внеклеточным путями. Причиной спазма артерий, развивающегося по внеклеточному механизму, являются циркулирующие в крови или синтезируемые в стенке сосудов вазоконстрикторы – катехоламины, ангиотензин-II, тромбин, эндотелин, лейкотриены и др.
Ангиоспазм, возникающий по внутриклеточному механизму, развивается в результате
103

|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
выхода из клетки ионов кальция и нарушения механизма сокращения с участием белков актина и миозина.
Обтурационная ишемия. Закупорка артерии тромбом или эмболом является причиной острой обтурационной ишемии. Атеросклеротические бляшки в стенке сосудов, склеротические изменения, возникающие в результате хронического воспалительного процесса (облитерирующий эндартериит), приводят к сужению просвета сосудов и увеличению сосудистого сопротивления кровотоку. Постепенное развитие таких изменений является причиной хронической обтурационной ишемии.
Компрессионная ишемия. Сжатие артерии или тканевой поверхности растущей опухолью, рубцовой тканью или инородным телом приводит к развитию компрессионной ишемии.
Ишемия, развивающаяся в результате неравномерного распределения крови между тканями – вследствие того, что в одну область организма поступает больше крови, в другой области возникает малокровие. Например, при быстром удалении асцитической жидкости из брюшной полости вследствие уменьшения давления, оказываемого на сосуды брюшной полости, артерии расширяются, к ним поступает больше крови, чем обычно, а в другие области тела поступает меньше крови. В таких случаях малокровие в тканях мозга может стать причиной потери сознания.
Изменения микроциркуляции при ишемии. Повышение сопротивления в артериях создает условия для снижения давления в сосудах микроциркуляции тканей и их сужения. В мелкокалиберных артериях и артериолах, расположенных дистально от области сужения или закупорки, давление снижается. Поэтому в сосудах микроциркуляторного русла уменьшается разность артериовенозных давлений, в капиллярах уменьшается линейная и объемная скорость кровотока.
Сужение артерий ведет к уменьшению поступления форменных элементов в капилляры
вобласти ишемии. Многие функционирующие капилляры превращаются в плазматические капилляры, затем в результате уменьшения внутрикапиллярного давления полностью выходят из строя. Таким образом, в ишемизированной области ткани уменьшается количество функционирующих капилляров.
Ослабление микрогемо- и микролимфоциркуляции при ишемии приводит с одной стороны к уменьшению снабжения тканей кислородом и энергией, с другой стороны – накоплению кислых продуктов обмена в тканях. Накопление недоокисленных продуктов обмена (молочная кислота, пировиноградная кислота и др.) становится причиной изменения рН в кислую сторону (ацидоза). Нарушения обмена веществ приводят сначала к обратимым, а затем необратимым повреждениям.
Расщепление аминокислот ускоряется, вследствие расхода на энергетические потребности клеток большого количества аминокислот, увеличивается содержание аммиака
втканях, синтез белков также уменьшается.
Уменьшение внутрикапиллярного давления уменьшает фильтрацию жидкости из сосудов в ткани. Несмотря на то, что при этом создаются благоприятные условия для реабсорбции жидкости из тканей в сосуды, уменьшение ее количества в межклеточном пространстве снижает скорость образования лимфы.
Признаки ишемии. При ишемии в результате сужения артериальных сосудов, уменьшения количества функционирующих капилляров цвет органа бледнеет. Уменьшение кровенаполнения органов и количества тканевой жидкости приводит к уменьшению их размера. Ослабление кровотока при ишемии приводит к снижению температуры поверхностных тканей. Это связано с уменьшением притока теплой артериальной крови в эту область, снижением обмена веществ и продолжением теплоотдачи. Вследствие того, что с поверхнос-
104

ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ МИКРОЦИРКУЛЯЦИИ И МЕСТНОГО КРОВООБРАЩЕНИЯ |
9 |
ти внутренних органов не происходит теплоотдачи, их температура при ишемии не изменяяется. При ишемии конечностей могут наблюдаться боль, онемение, чувство «ползания мурашек» и «иглоукалывания» (парестезии), периодические нарушения движений.
Исход ишемии зависит от ее продолжительности, скорости развития, локализации, степени развития коллатерального кровообращения, функционального состояния органов и тканей.
Остро возникшая и длительная ишемия в сравнении с медленно развивающейся и кратковременной ишемией приводит к более тяжелым последствиям.
Вследствие того, что чувствительность разных тканей к кислородному голоданию различна, изменения, развивающиеся в них при ишемии, возникают не одновременно. Особенно опасна ишемия центральной нервной системы. Недостаточность кровообращения головного мозга приводит к нарушению функции соответствующих центров. Например, ишемия двигательных центров в течение короткого времени ведет к развитию парезов и параличей. Сердечная мышца – в течение 20-40 минут, почки – в течение 40-50 минут толерантны к гипоксии. Если кровообращение в зоне ишемии не восстанавливается за определенный промежуток времени, наступает некроз ткани – инфаркт.
В то время как ишемия жизненно важных органов (сердце, мозг) может дать тяжелые осложнения, ишемия костей, хрящей и скелетных мышц протекает легко. По тяжести результатов ишемии почки, селезенка, легкие занимают среди вышеперечисленных органов промежуточное положение. Это связано с тем, что сердце, головной мозг и легкие имеют жизненно важное функциональное значение, энергетические процессы протекают в них быстро, степень развития коллатералей в них относительно низкая.
По степени развития коллатералей органы и ткани отличаются друг от друга. В скелетных мышцах, кишечной брыжейке, в легких общий просвет капилляров равен диаметру магистральных артерий или превосходит его. В связи с этим закупорка артерий, снабжающих такие органы и ткани, не вызывает острой ишемии в тканях. Общий просвет коллатералей, расположенных в миокарде, почках и селезенке, значительно меньше разветвления магистральной артерии. Окклюзия магистральной артерии в этих органах вызывает острую ишемию ткани. В стенке кишечника, желудке, мочевом пузыре, коже и надпочечниках обший просвет коллатералей несколько меньше диаметра кровоснабжающих их артерий, поэтому окклюзия артерий этих органов приводит к относительно легкой ишемии тканей и органов.
9.8. Инфаркт
Инфаркт – это некроз ткани вследствие нарушения кровоснабжения ткани. Инфаркт можно считать результатом ишемии с тяжелым течением. Инфаркт возникает вследствие тромбоза, эмболии и длительного спазма артерий. Повреждение стенки артерии, снижение скорости кровотока, слабое развитие коллатералей, снижение внутритканевого обмена создает условия для возникновения инфаркта. Согласно изменениям в некротизированной области выделяют 3 вида инфаркта: белый, красный, белый инфаркт с красной каймой.
В органах со слабым развитием коллатерального кровообращения (селезенка, почки и т.д.) встречается белый инфаркт. Это объясняется тем, что в области ишемии кровь не может поступать в суженные капилляры в связи с превращением их в плазматические капилляры. В результате тромбоэмболии мелких ветвей легочной артерии развивается красный (геморрагический) инфаркт легкого. В это время нарушается целостность стенки сосудов, эритроциты, вышедшие в межтканевое пространство, окрашивают ткань в красный цвет. В
105

|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
других случаях (инфаркт миокарда) развивается белый инфаркт с красной каймой. Образование красной полосы связано со сменой спазма парезом сосудов, расположенных на границе зоны некроза со здоровой частью ткани. В результате сосуды расширяются, в этой области наблюдается артериальная гиперемия и диапедез эритроцитов.
В развитии инфаркта выделяют 2 стадии: ишемия и некроз /2/.
На стадии ишемии превалируют дистрофические и некробиотические изменения. В зоне ишемии ускоряется анаэробный гликолиз, нарушается тканевое дыхание и взаимосвязь между процессами окисления и фосфорилирования. Клетки ускоренно используют запасы гликогена, изменяется их электролитный состав: ионы K+ и Mg2+ выходят из клетки, а ионы Na+ и Ca2+ переходят из крови и межклеточной жидкости внутрь клетки. Изменения обмена веществ приводят к снижению рН внутри клетки, денатурации белков цитоплазмы и отеку. На стадии некроза происходят процессы некроза и аутолиза.
Исход инфаркта зависит от состояния того органа и ткани, где происходит процесс, площади некроза. Иногда в зону некроза, подвергшейся организации, оседают соли кальция или в область геморрагического инфаркта оседают соединения железа (петрификация и гемосидероз). При развитии инфаркта в сердечной мышце, почках и селезенке некротизированная область уплотняется (коагуляционный некроз). А в результате инфаркта кишечника и мозга развивается колликвационный некроз, т.е. некротизированная зона смягчается. Область коагуляционного некроза часто подвергается процессу организации, на его месте образуется соединительная ткань (рубец). При колликвационном некрозе в результате аутолиза некротической зоны может образоваться циста. Вследствие нагноения цисты может образоваться абсцесс. Это одно из опасных осложнений инфаркта.
9.9. Стаз
Стаз – это остановка кровотока в микроциркуляторных сосудах органов и тканей. По патогенезу выделяют ишемический, венозный (застойный) и истинный капиллярный стаз.
Ишемический и венозный стаз развиваются соответственно в результате ишемии и венозной гиперемии и приводят к капиллярно-трофическим нарушениям.
Вэтиологии истинного капиллярного стаза принимают участие физические (тепло, холод), химические (яды, скипидар и др.) и биологические (токсины микроорганизмов) факторы.
Впатогенезе истинного капиллярного стаза играют роль 2 фактора:
агрегация эритроцитов внутри капилляров, образуя конгломераты, препятствует кровотоку;
повышение проницаемости сосудов приводит к сгущению крови, замедлению и оста-
новке кровотока в области стаза. Проагреганты (тромбоксан A2, AДФ, катехоламины), катионы (K+, Ca2+, Na+, Mg2+) и крупномолекулярные белки (глобулины, фибриноген) приводят к сгущению крови.
На начальных стадиях ишемического стаза диаметр капилляров уменьшается, а при
венозном (застойном) и истинном капиллярном стазе просвет капилляров увеличивается, от напряжения целостность стенки капилляров нарушается, и образуются микрогеморрагии. В просвете сосудов образуется большое количество микроагрегатов. В капиллярах, небольших артериях и венах образуются скопления близко расположенных друг к другу эритроцитов, развивается феномен сладжа. На начальных стадиях стаза свертывание крови не наблюдается. Стаз – это обратимый процесс: при своевременном устранении этиологического фактора
106

ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ МИКРОЦИРКУЛЯЦИИ И МЕСТНОГО КРОВООБРАЩЕНИЯ |
9 |
кровоток восстанавливается. При длительной продолжительности процесса форменные элементыподвергаются агглютинации, стазприобретаетнеобратимыйхарактер.
Исход стаза обычно зависит от того, в каком органе он развивается. В головном мозге, сердце и почках стаз может вызывать опасные осложнения. Длительный стаз приводит в тканях к капиллярно-трофическим изменениям – дистрофиям, а иногда к инфаркту.
9.10. Тромбоз
Процесс полной или неполной закупорки просвета поврежденного сосуда сгустком, состоящим из форменных элементов крови и стабилизированного фибрина, называется тромбозом. Сгусток, который в процессе тромбообразования посредством фибриновых нитей прочно прикрепляется к субэндотелиальному слою сосудистой стенки, называется
тромб.
Механизм образования тромба и его структура зависят от скорости кровотока. Основу артериального тромбоза (тромбы, образующиеся в артериях с высокой скоростью кровотока) составляет сосудисто-тромбоцитарный механизм, а венозного тромбоза (тромбы, образующиеся в венах с низкой скоростью кровотока) – коагуляционный механизм. Артериальные тромбы состоят из тромбоцитов, подвергнутых агрегации, и небольшого количества эритроцитов и лейкоцитов, осажденных в фибриновой сети. А венозные тромбы содержат в небольшом количестве тромбоциты и большом количестве лейкоциты и эритроциты, что придает тромбу гомогенный красный цвет. Поэтому для профилактики артериальных тромбозов используют антиагреганты, снижающие агрегацию тромбоцитов (ацетилсалициловую кислоту, клопидогрель и др.), а для профилактики и лечения венозных тромбозов – антикоагулянты прямого (гепарин) и непрямого (производные кумарина и др.) действия.
В образовании тромба важную роль играют три основных условия (триада Вирхова) (рис. 9.1):
–повреждение стенки сосудов. Возникает в результате действия физических (механиче-
ское повреждение, электротравма и др.), |
Тромбоз |
|
|||
химических, |
биологических |
(токсины |
|
|
|
микроорганизмов и др.) факторов, а также |
|
|
|
||
Уменьшение скорости |
|
|
|||
вследствие |
нарушения метаболизма в |
кровотока |
|
Гиперкоагуляция |
|
|
|
||||
стенке сосуда;
– нарушение активности свертывающей и противосвертывающей систем крови. В
образовании тромба повышение активности свертывающей системы крови в результате повышения концентрации прокоагулянтов, а также снижение активности противосвертывающей и фибринолитической систем имеет большое значение;
уменьшение скорости кровотока. Повышенное тромбообразование в венах (относительно артерий), в нижних конечностях (относительно верхних конечностей) подтверждает наличие связи между механизмом тромбообразования и скоростью кровотока. Повышение склонности к тромбообразованию на стадии декомпенсации недостаточности кровообращения, при соблюдении длительного постельного режима также связано с низкой скоростью кровотока.
Образование тромба связано с сосудисто-тромбоцитарным и коагуляционным
механизмами гемостаза. Основу сосудисто-тромбоцитарного механизма составляет нарушение целостности стенки сосуда и повышение способности тромбоцитов к адгезии и агрегации.
107
|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
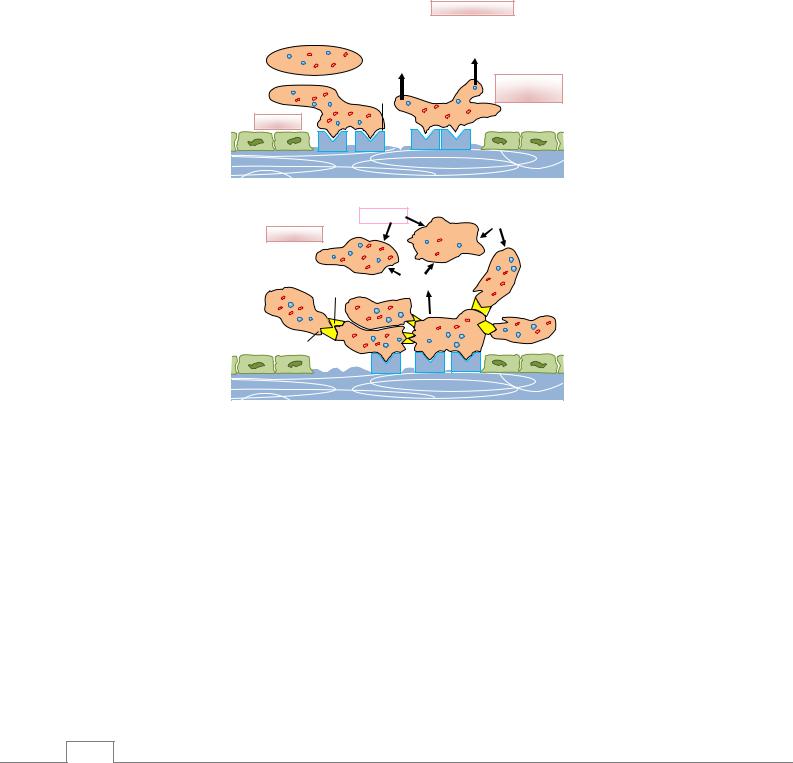
Основная причина адгезии тромбоцитов – деэндотелизация сосудистой стенки в результате ее повреждения (рис. 9.2). В результате этого особый белок, расположенный на субэндотелиальном слое – фактор Виллебранда, соединяясь с рецепторами на поверхности тромбоцитов (гликопротеин Ib – GpIb), обеспечивает адгезию тромбоцитов. Адгезированные тромбоциты активируются, и из них, а также из поврежденных тканей освобождаются вещества, обеспечивающие высокую агрегационную способность тромбоцитов (АДФ, тромбоксан A2 и др.). Под воздействием этих веществ другие рецепторы, расположенные на поверности тромбоцитов (GpIIb/IIIa), подвергаются конформативным изменениям и посредством фибриногеновых мостиков вовлекают и другие тромбоциты в этот процесс. Таким образом, образуется«пробка», состоящая изподвергнутых агрегации тромбоцитов.
|
Высвобождение |
|
Фибриноген |
|
|
Неактивные тромбоциты Тромбоспондин |
AДФ |
|
Тромбоцитарный |
Серотонин |
|
фактор-4 |
|
|
|
|
Деформация |
GpIb/IX |
|
тромбоцитов |
Адгезия |
|
|
vWF |
vWF |
|
Субэндотелиальный коллаген
A
Тромбин AДФ Агрегация 


Фибриноген Тромбоксан A2
GpIIb/IIIa
Б
Рис. 9.2. Образование тромба в поврежденных сосудах. А – адгезия тромбоцитов; Б – агрегация тромбоцитов /10/.
Из агрегированных (активированных) тромбоцитов освобождаются прокоагулянты (тромбопластин), что дает начало стадии коагуляции тромбообразования. Существует 2 пути коагуляции: внутренний и внешний. Внутренний путь начинается с активации XII фактора свертывания крови (фактора Хагемана), а внешний – с активации клеточных липопротеидов, называемых тканевым фактором (VII фактор свертывания). Оба пути приводят к активации X фактора, в результате чего протромбин превращается в тромбин. В свою очередь, от молекулы фибриногена под действием тромбина отделяются мелкомолекулярные пептидные цепи, что приводит к образованию фибрина. Под действием фибринстабилизирующего фактора (XIII фактор) образовавшиеся фибриновые мономеры полимеризуются и превращаются в нерастворимые фибриновые нити. Затем от тромба отделяется определенное количество плазмы, его объем уменьшается, т.е. происходит ретракция тромба. Фибрин, образовавшийся на поврежденных участках сосудов, под действием фибринолизина (плазмина) гидролитическим путем быстро расщепляется.
108

ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ МИКРОЦИРКУЛЯЦИИ И МЕСТНОГО КРОВООБРАЩЕНИЯ |
9 |
По составу различают белый, красный, смешанный и гиалиновый тромбы.
Белый тромб образуется, в основном, в артериях, состоит из тромбоцитов, фибриновых нитей и лейкоцитов. Красный тромб наиболее часто образуется в венах, содержит тромбоциты, фибриновые нити и большое количество эритроцитов. Смешанный тромб имеет многослойное строение, головная часть напоминает белый, тело – смешанный, а хвостовая часть – красный тромб; встречается в венах, в области аневризмы аорты, в полостях сердца. Гиалиновые тромбы состоят из преципитированных белков плазмы, лейкоцитов и расщепленных эритроцитов и тромбоцитов. Они встречаются в системе микроциркуляции, в основном, при инфекционных и септических процессах.
Исходы тромбоза. Тромбоз артерий приводит к ишемии, а тромбоз вен – к венозному застою. Ниже приведены возможные исходы тромбоза (рис. 9.3):
аутолиз. Тромбы могут подвергаться септическому и асептическому аутолизу. В благоприятных условиях мелкие тромбы под действием фибринолизина и неспецифических протеаз плазмы полностью расплавляются (асептический аутолиз). При попадании в тромб гноеродных бактерий происходит септический аутолиз;
закупорка тромбом просвета сосуда в месте его образования;
тромбоэмболия. Все тромбы могут привести к эмболии. Тромбоэмболия возникает в результате отрыва тромба или его части от стенки сосуда;
организация и реканализация (васкуляризация). Со временем в области присоединения тромба к сосудистой стенке эндотелиальные и гладкомышечные клетки, фибробласты пролиферируют внутри тромба и обеспечивают его организацию. Это приводит к утолщению сосудистой стенки в этой области. Затем образуются каналы, выстланные эндотелиальными клетками, т.е. происходит реканализация тромба. Иногда в область тромбообразования оседают соединения кальция (петрификация). В этом случае в стенках вен могут образоваться камни (флеболит).
Нижняя полая вена
Закупорка вены тромбом
Аутолиз тромба |
Тромбоэмболия |
Организация |
Реканализация |
|
легочных сосудов |
тромба |
тромба |
Рис. 9.3. Исходы тромбоза.
В областях, где не развиты коллатерали, закупорка сосуда тромбом может привести к некрозу (инфаркт). Особенно велика роль тромбоза коронарных артерий в развитии инфаркта миокарда. Атеросклероз, облитерирующий эндартериит, сахарный диабет являются факторами риска ускорения тромбообразования в артериях.
109

ЧАСТЬ I ОБЩАЯ ПАТОФИЗИОЛОГИЯ
9.11. Эмболия
Окклюзия просвета сосуда необычными частицами, приносимыми крово- и лимфотоком, называется эмболией, а эти частицы – эмболами.
По происхождению эмболы подразделяются на 2 группы – эндогенные и экзогенные. По локализации выделяют эмболы большого и малого кровообращения, а также эмболы системы воротной вены. Очень редко встречаются ретроградные эмболии. При этом эмболы, не подчиняясь законам гемодинамики, под своей тяжестью перемещаются в обратном кровотоку направлении (например, при уменьшении присасывающей силы грудной клетки). Парадоксальная эмболия возникает при перемещении эмбола по венам большого круга кровообращения и попадании его из правого желудочка, минуя малый круг кровообращения, в левый желудочек. Это происходит при неполном заращении межжелудочковой перегородки.
Кэкзогенным эмболам относятся воздушная, газовая, бактериальная и эмболия инородным телом.
Воздушная эмболия возникает при повреждении вен (яремных, подключичной и др.). Это связано с отрицательным давлением в венах и слабой сократительной особенностью этих вен.
Газовая эмболия развивается преимущественно при выполнении работ в кессонных условиях, например, у водолазов (при быстром переходе из среды с повышенным атмосферным давлением в нормальные условия), а также при разгерметизации летательных аппаратов.
Микробная эмболия возникает в результате попадания в общий кровоток микроорганизмов, дрожжевых грибков, паразитов (эхинококки). В результате расщепления инфицированного тромба также может образоваться микробная эмболия. Бактериальные эмболии приводят к образованию абсцессов в области закупорки просвета сосуда.
Кэндогенным эмболиям относятся тромбоэмболия, жировая, тканевая эмболии и эмболия околоплодными водами.
Тромбоэмболия – наиболее часто наблюдаемый вид эмболии, который возникает в результате отрыва тромба или его части от стенки сосуда (за счет асептического или гнойного аутолиза).
Тромбоэмболия наиболее часто встречается в легочных артериях (20%), редко – в портальной вене. Закупорка небольших ветвей легочной артерии приводит к развитию геморрагического инфаркта в легких, а окклюзия больших ветвей или ствола легочной артерии – к внезапной смерти. Причина внезапной смерти – возникновение пульмокоронарного рефлекса /1, 2/. Так, при тромбоэмболии легочной артерии, богато снабженной нервными рецепторами, происходит их сильное раздражение, что приводит к единовременному спазму бронхов, ветвей легочной артерии и коронарных артерий и рефлекторной остановке сердца.
Артериальная тромбоэмболия развивается на фоне таких заболеваний, как инфаркт миокарда, бактериальный эндокардит, атеросклероз. Тромбоэмболия мозговых артерий приводит к энцефаломаляции, эмболия мезентериальных (брыжеечных) артерий – к инфаркту кишечника, эмболия почечной артерии – к инфаркту почки, эмболия бедренной артерии – к гангрене нижних конечностей.
Жировая эмболия развивается в результате попадания капель жира в сосуды при нарушении целостности последних. Попадание в общий кровоток структур костного мозга при переломе длинных трубчатых костей, а также капель жира при повреждении подкожной
110
