
Патофизиология (Пособие для резидентуры)
.pdf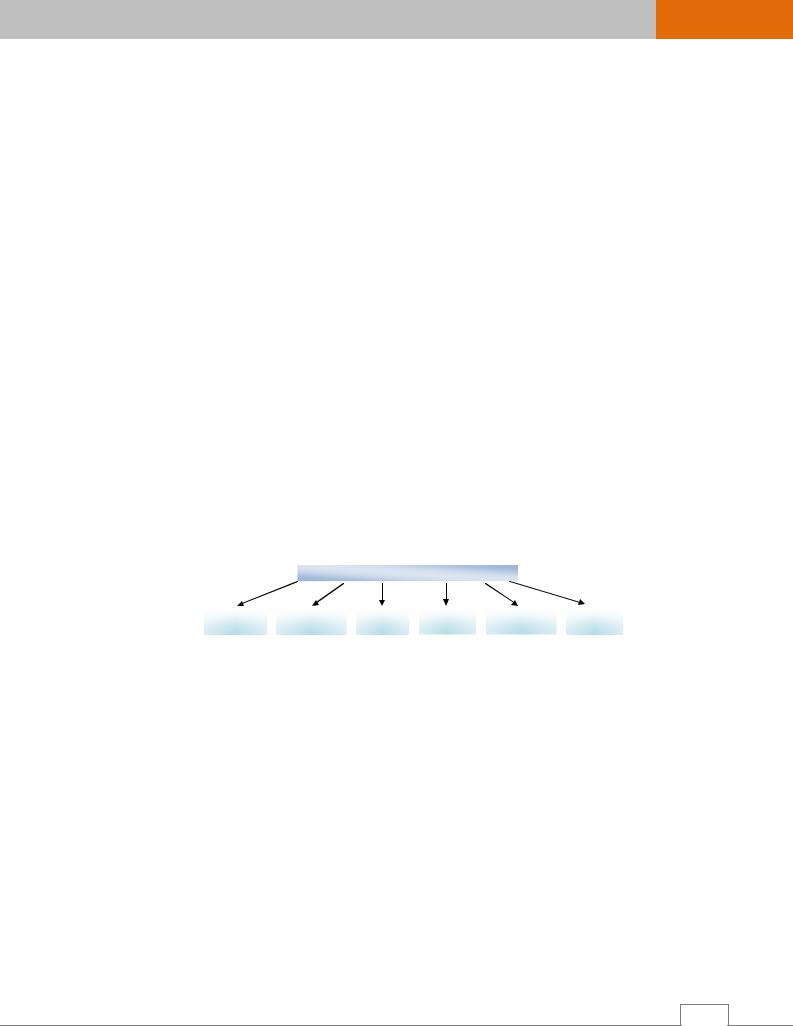
ТИПОВЫЕ НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ 14
растворы, богатые содержанием белка.
Нарушения обмена калия. В норме калий считается катионом внутриклеточной жидкости. 90% ионов калия содержится во внутриклеточном (110-150 ммоль/л), 10% во внеклеточном пространстве (4-5 ммоль/л). В организме 0,4% калия содержится в плазме крови. В норме в человеческий организм в течение дня должно поступать 2-4 г калия и приблизительно то же самое количество должно выводиться.
Большая часть внутриклеточного калия находится в связанном с белками, углеводами, фосфатами состоянии, а малая часть – в свободном состоянии (K+). В плазме и интерстициальной жидкости ионы калия бывают в ионизированной форме. Нарушение метаболизма калия проявляется в виде гипо- и гиперкалиемии.
Гиперкалиемия – это содержание в плазме крови ионов калия выше нормы. Это может быть вызвано несколькими причинами:
избыточное поступление калия в организм. Например, с пищей или лекарственными препаратами (бромид калия, хлорид калия, йодид калия и др.);
уменьшение экскреции калия почками. Например, при гипоальдостеронизме (болезнь Аддисона) и почечной недостаточности;
выход калия из клетки в кровь при повреждении клеток. Например, при травмах, ожогах, гемолизе, гипоксии, ишемии и некрозе, гипоинсулинизме.
При гиперкалиемии в мышцах наблюдаются гипотония, боль, паралич, гипорефлексия (рис. 14.23). При гиперкалиемии повышается активность парасимпатической нервной системы, нарушается автоматизм, проводимость сердца, что приводит к брадикардии. В это время на ЭКГ интервал P-R пролонгируется, комплекс QRS становится широким (за счет замедления проведения импульса), T зубец бывает высоким и остроконечным (в результате укорочения реполяризации). В норме концентрация калия в плазме крови составляет 3,5-5,5 ммоль/л. Если концентрация калия достигает 8-10 ммоль/л, наблюдается атриовентрикулярная или внутрижелудочковая блокада, если 13 ммоль/л – остановка сердца в фазе диастолы.
|
|
|
Основные проявления гиперкалиемии |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Мышечная |
|
Атония |
|
Параличи |
|
Боли в |
|
Брадикардия |
|
Аритмии |
||
гипотония |
|
кишечника |
|
мышц |
|
мышцах |
|
|
сердца |
|||
Рис. 14.23. Основные признаки гиперкалиемии /6/.
Коррекция гиперкалиемии. Для выведения K+ из организма используют несколько методов: использование диуретиков (например, фуросемид) и альдостероновых препаратов (эти препараты увеличивают экскрецию K+ с мочой и спустя несколько часов содержание калия снижается); применение диализа. Это можно проводить путем гемодиализа и перитонеального диализа. Спустя 3-4 часа от начала диализа снижается содержание K+ в крови. Перитонеальный диализ менее эффективный, но в определенной степени способствует снижению содержания K+.
Гипокалиемия – это содержание в плазме крови ионов калия ниже нормы. Гипокалиемия может развиться по нескольким причинам:
недостаточное поступление калия с пищей;
избыточная потеря организмом калия (полиурия, гиперальдостеронизм, синдром Кушинга, длительный прием мочегонных препаратов, диарея, рвота и др.);
ускоренный переход ионов калия из внеклеточного пространства внутрь клетки (при избытке инсулина, при алкалозе и др.).
При гипокалиемии вследствие нарушения нервно-мышечной возбудимости
231





ТИПОВЫЕ НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ 14
При |
гипомагниемии |
развивается |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ряд клинических признаков. Повыша- |
|
Основные проявления гипомагниемии |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ется нервно-мышечная возбудимость, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Повышение нервно- |
|
|
|
|
|
|
|
|
|
|
|
Повышение |
||||||
аритмия, |
тахикардия, |
повышение |
мышечной возбудимости |
|
|
|
|
|
|
|
|
|
|
|
артериального давления |
|||
артериального давления, отставание в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
росте, в тканях развиваются дистрофи- |
Тахикардия |
|
|
|
|
|
|
|
|
|
|
|
Гипотермия |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
ческие изменения. Повышение нервно- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
мышечной возбудимости |
характеризу- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Задержка роста |
|
|
|
|
|
|
|
|
|
|
|
Гипокальциемия |
||||||
ется тремором, спазмом мышц рук и |
организма |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
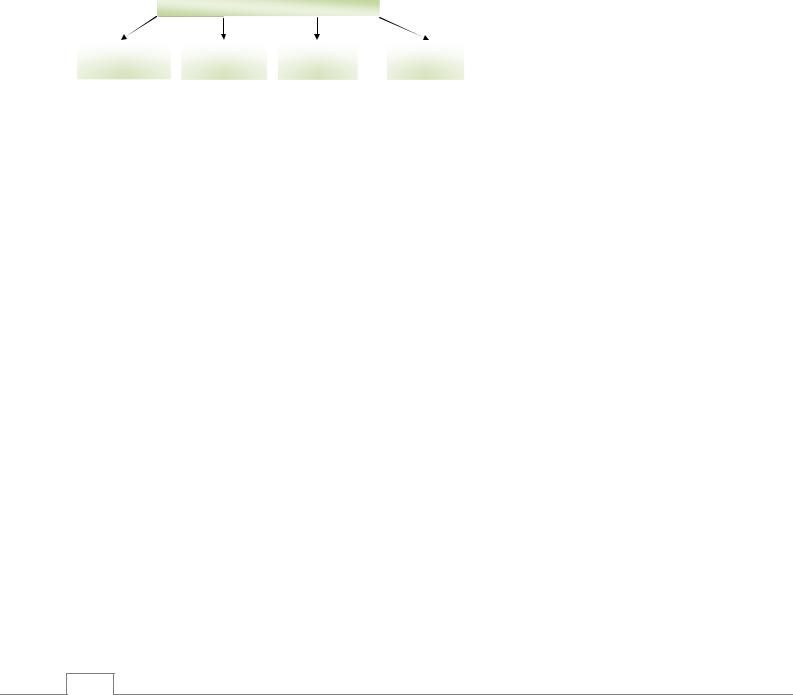
ног (рис. 14.30). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Коррекция гипомагниемии. Необхо- |
Аритмии |
|
|
|
|
|
|
|
|
|
|
|
Гипокалиемия |
|||||
сердца |
|
|
|
|
|
|
|
|
|
|
|
|||||||
димо устранить патологию, ведущую к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
снижению содержания магния в крови; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Нарушение усвоения |
|
|
|
|
|
|
|
|
|
|
|
Дистрофия |
|||||
назначить |
введение |
в организм |
|
пищи в кишечнике |
|
|
|
|
|
|
|
|
|
|
|
тканей |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
препаратов магния (например, раствора |
Рис. 14.30. Основные признаки гипомагниемии. |
|||||||||||||||||
сульфата магния), прием пищи, богатой содержанием магния (например, горох, лобья).
Железо. Как и макроэлементы, содержание железа в организме (приблизительно 3-5 г) составляет больше 0,001% общей массы тела. Однако железо оказывает свое биологическое действие, будучи не в свободном (ионизированном) состоянии, а в связанном с белками состоянии. Поэтому он относится к группе микроэлеминтов. Этот элемент входит в состав ряда белков в форме гема (гемоглобин, миоглобин, цитохром, каталаза, лактоферрин) и не гема (ферритин, гемосидерин, трансферрин, ксантиноксидаза, НАД-Н-дегидрогеназа). Железо обеспечивает доставку кислорода к тканям (в составе гемоглобина) и внутриклеточное окисление (в составе цитохрома). Железо, в основном, поступает в организм в составе пищевых продуктов. Транспорт железа, всасываемого из кишечника, осуществляется посредством белка трансферрина. Железо накапливается в депо (печень, селезенка, костный мозг) в виде ферритина и в малом количестве в виде нерастворимого
гемосидерина.
Нарушение обмена железа проявляется в виде гипер- и гипосидероза. Гиперсидероз развивается при усилении всасывания железа из кишечника, избыточном парэнтеральном введении препаратов железа, талассемии и т.д. Избыток железа накапливается в виде гемосидерина в ретикулоэндотелиальной системе клеток печени и селезенки (гемосидероз), что приводит к развитию фиброза. Токсическое действие высокой концентрации железа приводит к усилению образования свободных радикалов (реакция Фентона). Известно две наследственные формы гиперсидероза: атрансферринемия и первичный гемохроматоз. При гемохроматозе в тканях помимо гемосидерина накапливается пигментное вещество, называемое гемофусцин. В это время кожа окрашивается в бронзовый, а внутренние органы
вкоричневый цвет, развиваются цирроз печени и сахарный диабет (бронзовый диабет). При повышении содержания железа в организме он накапливается вместе с кальцием и фосфором
вточках окостенения скелета, и возникает хондродистрофия (болезнь Кашина-Бека). Гипосидероз развивается при недостаточном поступлении железа с пищей, а также при
снижении кислотности желудка (например, при атрофическом гастрите, гастрэктомии), снижении всасывания железа в кишечнике (например, после резекции кишечника, хроническом энтерите, недостаточности витамина С, превращающем Fe3+ в Fe2+), хронических кровопотерях, в периоды беременности и лактации, когда повышается потребность в железе. Одна из основных причин недостаточности железа – это низкое содержание меди и кобальта в организме. Гипосидероза проявляется в основном железодефицитной гипохромной микроцитарной анемией.
Фтор составляет основную составную часть костей и зубной эмали. В костях его содержание составляет 0,01-0,03%, а в зубной эмали – 0,01-0,02%. Избыточное содержание
237
|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
фтора в составе питьевой воды приводит к утолщению зубной эмали. В результате повышения содержания фтора в организме (флюороз) зубы повреждаются (на них появляются пятна).
Низкое содержание фтора в составе пищи является причиной кариеса. Было установлено, что фтор тормозит биосинтез сахаридов, необходимых для развития бактерий, вызывающих кариес. При недостаточности фтора в организме ускоряется биосинтез сахаридов и их избыточное количество, проникая в бактериальные клетки, ускоряет их жизнедеятельность.
Медь входит в состав ферментов, участвующих в жизненно важных процессах (тканевое дыхание, эритропоэз и гранулоцитопоэз). Медь ускоряет всасывание железа через стенку кишечника, вводит железо в состав цитохромоксидазы и гема. Также медь инактивирует инсулиназу, участвует в синтезе катехоламинов, пигментации кожи и волос, обеспечивает нормальное течение процессов кератинизации. Нарушение метаболизма меди проявляется в виде гипер- и гипокупреоза.
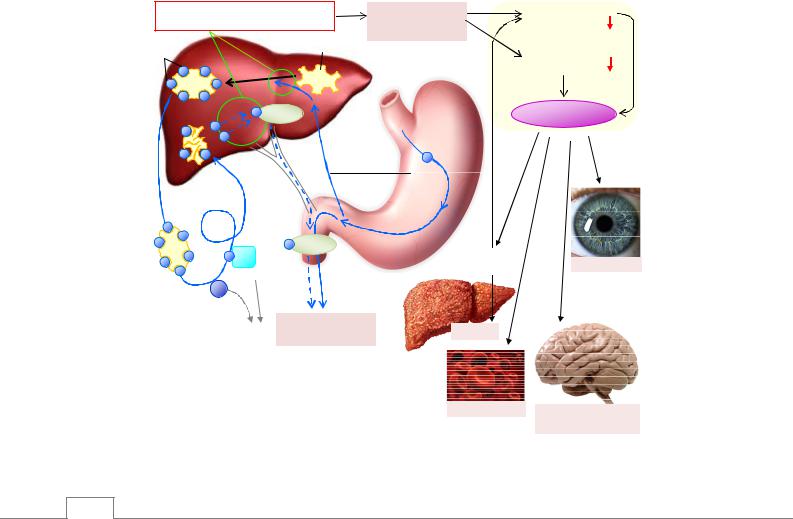
Болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия, гепатолентикулярная дегенерация), передаваемое аутосомно-рецессивным путем, сопровождается избыточным содержанием меди. При болезни Вильсона в результате генетического дефекта нарушается соединение меди с церулоплазмином в печени. В результате этого медь накапливается в гепатоцитах. Свободный церулоплазмин, переходя в кровь, быстро разрушается и снижается его содержание в крови. Свободная медь, которая накапливается в печени, повреждает гепатоциты, переходя в кровь, соединяется с аминокислотами, и образующийся комплекс из-за плохой растворимости в воде оседает в тканях (в головном мозге, почках, роговице и радужке глаза и т.д.). При этом с мочой выделяется большое количество комплекса медьаминокислота (гипераминоацидурия) (рис. 14.31).
Генетический дефект АТР7В |
Выведение Cu |
2+ |
Выведение Cu2+ |
||
(хромосома 13) |
|
||||
из печени |
|
с желчью |
|||
|
|
|
|
||
Cu2+ |
|
Церулоплазмин |
|
Включение Cu2+ |
|
|
|
|
|
||
|
|
|
|
|
в церулоплазмин |
Печень |
Белок |
Поступление Cu2+ |
Свободная Cu |
||
|
|
|
|
||
|
|
|
2-5 мг/сут |
|
|
|
|
|
Всасывание Cu2+: |
|
|
|
|
|
40-60% |
|
|
Плазма |
|
|
|
|
|
|
|
|
Желудок |
|
|
|
|
|
Хронический |
Роговица |
|
|
Транскруптин |
Двенадцатиперстная |
гепатит |
||
|
|
||||
|
|
|
кишка |
|
|
Альбумин |
|
|
|
|
|
|
Ткань |
Выведение Cu2+ |
Цирроз |
|
|
|
около 1,2 мг/сут. |
|
|||
Гемолиз Неврологические расстройства
Рис. 14.31. Болезнь Вильсона-Коновалова /8/.
238

ТИПОВЫЕ НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ 14
К причинам гипокупреоза относятся недостаточное поступление меди с пищей (при искусственном вскармливании младенцев), нарушение его всасывания в кишечнике и др. Недостаточность меди приводит к развитию микроцитарной анемии и лейкопении, нарушениям деятельности нервной системы и соединительной ткани, снижению иммунитета, возникновению сахарного диабета. Нарушение обмена меди оказывает также действие на секрецию гормонов гипофиза, тироксина, адреналина и инсулина. К наследственной форме гипокупреоза относится болезнь Менкеса (болезнь «кудрявых волос»). Болезнь Менкеса наследуется сцепленным с Х хромосомой рецессивным путем, возникает в результате мутации гена, кодирующего белок, который транспортирует медь через портальную систему в печень. При этом в сыворотке крови, печени, головном мозге снижается содержание меди, активность медьсодержащих ферментов. Волосы депигментируются, бывают кудрявыми. Снижение синтеза коллагена и эластина приводит к аневризме миокарда, эмфиземе легких, остеопорозу. Наблюдаются гипотермия, неврологические расстройства (мышечная гипотония, судороги и др.).
Цинк входит в состав ферментов, участвующих в углеводном, белковом, липидном обменах, синтезе и расщеплении нуклеиновых кислот, делении клеток, тканевом дыхании (карбоангидраза, щелочная фосфатаза, цитохромоксидаза, карбоксипептидаза и др.). Он играет важную роль в процессах роста тела, размножении, зрении, остеогенезе, иммунном ответе и др. Цинк принимает участие в образовании активной формы инсулина, также входя в состав фермента супероксиддисмутазы, замедляет образование в клетках свободных радикалов. Рецептор глюкокортикодов, влияющих на все виды обмена веществ и играющих важную роль в адаптации организма при стрессе, также представляет собой цинксодержащий белок. Цинк вместе с ретинолом принимает участие в конформационных изменениях в сетчатке глаза. Недостаток цинка в организме приводит к изменениям в дыхательной и эндокринной системах, гемопоэзе, росте, размножении, процессах окостенения, нарушает синтез инсулина и создает благоприятные условия для развития сахарного диабета. Наследственная форма недостаточности цинка – энтеропатический акродерматит. Развитие болезни связано с нарушением синтеза белка, присоединяющего цинк и обеспечивающего его всасывание в кишечнике. При этом наблюдаются иммунодефицит, дерматит, неврологические расстройства, позднее заживление ран, снижение остроты зрения и другие признаки.
Избыток цинка оказывает эмбриотоксическое действие и замедляет всасывание меди из ЖКТ. Поэтому при лечении болезни Вильсона-Коновалова используют препараты цинка.
Кобальт входит в состав витамина B12, оказывает действие на кроветворение, обмен белков, липидов, углеводов, нуклеиновых кислот, репродуктивную функцию организма. Ионы кобальта активируют ряд ферментов (фосфоглюкомутаза, альдолаза, аргиназа и др.). Недостаточность этого элемента приводит к развитию мегалобластической анемии. Повышение содержания кобальта в организме создает условия для развития полицитемии (повышение содержания эритроцитов).
Молибден входит в состав фермента ксантиноксидазы и превращая ксантин в гипоксантин, затем в мочевую кислоту, участвует в пуриновом обмене. Молибден взаимосвязан в обменных процессах с медью, так что он уменьшает действие меди. Повышение содержания молибдена приводит к недостаточности меди, нарушению белкового обмена в остеобластах костной ткани, задержке развития костей. Если в организме повышается содержание фермента ксантиноксидазы и молочной кислоты, то создаются условия для развития подагры.
Манган участвует в процессе глюконеогенеза, синтезе гемоглобина, стимулирует синтез холестерина и жирных кислот, входит в состав таких ферментов, как гидролаза, трансфераза, лигаза и др. Недостаточность этого элемента задерживает развитие скелета, снижает активность щелочной фосфатазы в костях и крови. Вследствие развития процессов деминера-
239

|
|
|
|
ЧАСТЬ I |
ОБЩАЯ ПАТОФИЗИОЛОГИЯ |
|
|
|
лизации в костях, они становятся хрупкими и часто ломаются. Недостаток мангана нарушает также функцию половых желез, вызывая в них деструктивные изменения. Избыток мангана в организме приводит к возникновению рахитоподобных признаков в костях («мангановый рахит»). Из-за затруднения всасывания из ЖКТ железа и меди развивается анемия.
Йод участвует в регуляции функции щитовидной железы, входит в состав тироксина, трийодтиронина. Йод также встречается в слюнных и желудочных железах, а также в других железистых тканях. Недостаточность йода ведет к эндемический зоб.
Литий – один из важных микроэлементов, его содержание в организме составляет приблизительно 70мг. Этот микроэлемент путем поддержания в клетке баланса ионов натрия, калия обеспечивает мембранный потенциал, а также оказывает влияние на распределение ионов кальция внутри клетки. Вообще, эффекты действия лития меняются в зависимости от его концентрации. Так, литий в низких концентрациях регулирует обмен биогенных аминов, обеспечивает высвобождение норадреналина и серотонина в ЦНС. В больших дозах литий снижает активность фермента аденилатциклазы, в головном мозге снижает концентрацию глутамата и ГАМК. Таким образом, литий и в ЦНС нормализует обмен медиаторов. Использование препаратов лития в лечении психических заболеваний основано на этом свойстве микроэлемента. Антиаллерический эффект препаратов лития объясняется повышением содержания цАМФ в клетках под действием лития. Использование солей лития при бронхиальной астме для профилактики бронхоспазма вызывает мышечную релаксацию, а это связано с регуляцией литием в гладкомышечных клетках обмена одноили двухвалентных ионов. Ионы лития могут, как стимулировать, так и ингибировать иммунные реакции. Известно, во время анафилактического шока в плазме снижается содержание лития. Так, на фоне анафилактического шока литий снижает секрецию серотонина и других медиаторов.
Ионы лития оказывают действие на эндокринную систему, в особенности на корковое вещество надпочечников, а также секрецию коркового вещества надпочечников, а также на секрецию гормона АДГ, блокирует высвобождение ТТГ и тироксина. Ятрогенное токсическое действие препаратов лития проявляется снижением функции щитовидной железы, развитием нефрогенного типа несахарного диабета, повреждением сердечнососудистой системы.
Селен, как железо и молибден, входит в состав ферментов глутатионпероксидаза, трансфераза и др. В составе глутатионпероксидазы селен снижает концентрацию пероксидов, а это составляет основу действий микроэлемента (антидистрофического, радиопротекторного, стимулирующего воздействия на процессы гемопоэза и регенерации). Селен, участвуя в окислительно-редуктивных реакциях, оказывает воздействие на липидный и углеводный обмены. Относительно высокая концентрация селена в сетчатке глаза позволяет предположить его участие в фотохимических реакциях.
Недостаточность селена может развиться при нерациональном питании или белковом голодании. В результате дефицита селена в организме возникает болезнь Кешана (эндемическая кардиомиопатия). Это заболевание чаще встречается у населения географических зон с малым содержанием селена в воде и почве. Недостаточность селена – фактор риска ишемической болезни сердца, инфаркта миокарда. Дефицит этого микроэлемента приводит к ослаблению иммунных реакций, снижению антивирусной и противоопухолевой резистентности организма. В тяжелых случаях может развиться сердечная недостаточность.
К генетическим дефектам обмена селена относятся наследственные селендефицитные ферментопатии (недостаточность глутатионпероксидазы в эритроцитах и тромбоцитах), кистозный фиброз поджелудочной железы (муковисцидоз), наследственные миотонические дистрофии.
При избытке селена в организме (селеноз) наблюдаются дерматит, повреждения зубной эмали, анемия, нервные нарушения, дегенерация печени, увеличение селезенки.
240
