
- •Лабораторная работа № 2
- •Лабораторная работа n 3 «перегонка двух смешивающихся жидкостей»
- •Лабораторная работа n 4
- •Лабораторная работа n 5
- •Список литературы
- •Лабораторная работа № 6 "о п р е д е л е н и е р е ф р а к ц и и"
- •С о д е р ж а н и е
- •Редактор л.А.Матвеева
- •450062, Г.Уфа, ул. Космонавтов, 1. Адрес типографии
- •453118, Г. Стерлитамак, пр. Октября, 2
Лабораторная работа N 1
«ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ КАЛОРИМЕТРИЧЕСКИМ МЕТОДОМ»
1.ОБЩИЕ СВЕДЕНИЯ О КАЛОРИМЕТРИЧЕСКИХ ИЗМЕРЕНИЯХ
При калориметрических опытах величины и знак теплового эффекта Q процесса определяются по изменению температуры калориметра t:
Q =(mici ) t = Wt ,
где mi - массы исследуемого вещества, калориметра и вспомогательных устройств (мешалки, ампулы, термометра);
сi - их удельные теплоемкости;
W - суммарная теплоемкость калориметрической системы.
Константа калориметра К - количество тепла, которое необходимо сообщить той части калориметрической системы, которая участвует в теплообмене, чтобы повысить ее температуру на один градус. Таким образом, константа калориметра - это теплоемкость калориметра и вспомогательных устройств.
Постоянную калориметра можно определить по известной теплоте растворения какой-нибудь соли.
Калориметрическая установка состоит из воздушного термостата (бокс с застекленными стенками) и помещенного в него калориметра. Через отверстия в крышке бокса в калориметре крепятся стеклянная мешалка, термометр Бекмана и ампула с исследуемым веществом.
2. ЦЕЛЬ И ЗАДАЧИ РАБОТЫ
Ознакомиться с калориметрическим методом измерения тепловых эффектов. Определить константу калориметра по теплоте растворения соли. Определить тепловой эффект нейтрализации едкого натра соляной кислотой.
3.УСТАНОВКА ТЕРМОМЕТРА БЕКМАНА
Термометр Бекмана отличается от обычного, во-первых, большой шкалой (точной), позволяющей наблюдать изменения температуры до 0,002°С, и, во-вторых, вторым запаянным ртутным резервуаром, при помощи которого можно менять количество ртути в основном нижнем резервуаре и тем значительно расширить диапазон измеряемых температур. Шкала такого термометра, имеющего длину 25-30 см, поделена всего на 5°С с отметками между ними десятых и сотых долей. Переводя некоторое количество ртути из нижнего резервуара в верхний или добавляя из верхнего в нижний, всегда можно настроить термометр так, чтобы температура данного растворителя попадала бы где-нибудь на середину этой условной шкалы.
Чтобы настроить термометр, необходимо привести в соприкосновение ртуть обоих резервуаров. Для этого - перевернуть термометр головкой вниз и, слегка постукивая по головке, добиваться того, чтобы ртуть из нижнего резервуара слилась со ртутью в запасном резервуаре. После этого термометр осторожно, чтобы не разорвать ртуть, возвращают в прежнее положение, и нижний резервуар погружают в исследуемый раствор. Термометр не должен касаться стенок стакана и не должен опираться на дно. Ртуть нижнего резервуара, охлаждаясь, сжимается и перетягивает недостающее количество ртути из верхнего резервуара в нижний. Через 5-10 минут вынимают термометр из воды и, энергично стукнув руку с зажатым термометром о другую, вызывают отрыв верхней ртути от капилляра. Таким образом заканчивается основная, но еще не полная настройка термометра, так как в рабочей части его (нижнем резервуаре с капилляром) имеется некоторый избыток ртути. Таким избытком является то небольшое количество ртути, находящееся в верхней половине капилляра, между намеченными делениями шкалы и местом, где был осуществлен отрыв ртути. Слегка подогрев рукой нижний резервуар, вызывают расширение ртути, что тотчас замечают по небольшой капельке ртути, которая появится у конца капилляра в верхнем резервуаре. Эту капельку следует стряхнуть в верхний резервуар. Необходимо проверить, достаточно ли этого количества сброшенной ртути или нет повторным погружением термометра в стакан с водой. Если температура попадает на шкалу выше желаемого деления (наиболее удобным для опыта является положение ртути между 3-4 градусами), то стряхивание капельки ртути следует повторить и еще раз проверить показания термометра, опустив его в тот же стакан.
4. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
4.1. Определяют константу калориметра (теплоемкость калориметра) , проведя процесс с известным тепловым эффектом растворения хлористого калия. Для этого наливают в сосуд 600 мл дистиллированной воды и отвешивают на технических весах навеску соли с точностью до 0,1 г. Настраивают термометр Бекмана и укрепляют в калориметре. Затем запускают секундомер и при непрерывном перемешивании мешалкой содержимого сосуда делают 15-20 записей показаний термометра Бекмана с точностью 0,01°С через каждые 30 секунд. После этого быстро всыпают через воронки навеску соли и, не останавливая секундомера и не прекращая перемешивания, делают еще 15-20 записей показаний термометра Бекмана. Вследствие растворения соли температура в калориметре понижается. Для расчета точного изменения температуры растворения соли вычерчивают на миллиметровой бумаге график, где на оси абцисс откладывают время, а на оси ординат изменение температуры. Разность значений температуры до и после растворения соли, равная изменению температуры t1 вследствие растворения соли, будет использована для расчета теплоемкости калориметра.
4.2. Определяют теплоту нейтрализации едкого натра соляной кислотой. Для этого выливают из сосуда раствор соли, сосуд осторожно ополаскивают водой и наливают в него 580 мл дистиллированной воды и 15 мл 1 Н раствора NaOH. Собирают калориметр и при перемешивании сосуда делают 15-20 записей показаний термометра Бекмана (с интервалом 30 секунд). Затем вливают в сосуд 15 мл 2 Н раствора НСl и делают еще 15-20 записей показания термометра. Вследствие протекания реакции нейтрализации температура в калориметре повышается. По графику находят значение t2 для расчета теплового эффекта реакции.
5. РАСЧЕТЫ
5.1. Теплоемкость (константу) калориметра W находят из соотношения
W = Q1/t1,
где Q1 - теплота растворения навески соли в 600 г воды, которую находят, используя таблицу интегральной теплоты растворения солей в воде [4] .
Для этого находят количество молей соли на 1кг Н2О.
5.2. Теплота нейтрализации 15 мл 1 Н NaOH определяется по формуле
Q2= W t2 .
При пересчете на 1 г-эквивалент получится
Qm = Q2 1000/15 , ккал/г-экв.
В полученную величину Qm нужно ввести поправку на разбавление кислоты, которую находят по справочнику [4].
Тогда действительная теплота нейтрализации
Qq = Qm - .
5.3.Полученный результат сравнивают с величиной теоретической теплоты нейтрализации Qt=13,36 ккал/г-экв и определяют процент ошибки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Различные формулировки и математические выражения первого закона термодинамики.
2. Применение первого закона термодинамики к процессам в любых системах.
3. Закон Гесса и способы вычисления тепловых эффектов реакций.
4. Связь теплоемкости с термодинамическими функциями.
5. Зависимость теплового эффекта от температуры. Расчет тепловых эффектов реакций при различной температуре.
6. Устройство простейшего калориметра и методика калориметрического опыта.
7. Устройство термометра Бекмана и обращение с ним.
8. Методика выполнения работы.
СПИСОК ЛИТЕРАТУРЫ
1. Стромберг А. Г., Семченко Д. П. Физическая химия. - М.: Высшая школа, 1973.
2. Краткий курс физической химии. - М.: Высшая школа, 1978.
3. Физическая химия / Под ред. К. С. Краснова. - М. : Высшая школа, 1982.
4. Краткий справочник физико-химических величин / Под ред. К. П. Мищенко и А. А. Равделя. - М. : Химия, 1967, 1984.
5. Практикум по Физической химии /Под ред. С.В.Горбачева. - М. : Высшая школа. 1974.
Лабораторная работа № 2
«ИЗУЧЕНИЕ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ В РАСТВОРЕ»
ОБЩИЕ СВЕДЕНИЯ
Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакций, при котором свободная энергия системы имеет минимальное значение. Молекулярно-статистически химическое равновесие определяется как такое состояние, при котором скорости прямой и обратной реакций равны друг другу. Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и концентрации основных веществ находятся между собой в определенном соотношении, описываемом законом действующих масс: отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакций к произведению концентраций (или парциальных давлений) исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам при постоянной температуре, постоянно.
Для гомогенной газовой реакции типа
аА + вВ lL + еЕ
константу равновесия Кр можно записать
 .
.
Равновесие системы может смещаться при изменении начальных концентраций, константа же равновесия остается неизменной.
Поэтому, зная константу равновесия при каких-либо внешних условиях, начальные концентрации и общее давление можно рассчитать равновесный выход.
2. ЦЕЛЬ И ЗАДАЧИ РАБОТЫ
Ознакомиться с основными свойствами обратимых реакций и с одним из методов исследования химического равновесия на примере реакции
2FеС13 + 2КJ = 2FеС12 +J2 + 2КС1 .
Рассчитать на основании экспериментальных данных среднюю константу
равновесия при двух температурах и средний тепловой эффект Н.
3. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Берут четыре сухие колбы с притертыми пробками емкостью 100 мл. Пронумеровав колбы, наливают в них следующее количество растворов точной концентрации.
Таблица 1
|
Раствор |
Колба 1 |
Колба 2 |
Колба 3 |
Колба 4 |
|
0,03 н FeCl3,мл |
50 |
- |
55 |
- |
|
0,03 н KJ, мл |
- |
50 |
- |
45 |
Затем колбы помещают на 30 минут в водяной термостат при температуре 25 О,2°С. Готовят для титрования конические колбы емкостью 100 мл. В каждую колбу наливают 35-50 мл дистиллированной воды и ставят их для охлаждения на лед. Сливают вместе содержимое колб 1 и 2, а через 10 минут после этого содержимое колб 3 и 4. Момент сливания растворов отвечают по часам. Колбы плотно закрывают пробкой и устанавливают в термостат. Через 5 минут от момента смешения из каждой колбы, не вынимая их из термостата, отбирают пипеткой 10 мл раствора и сливают в охлажденную колбу для титрования. За время отбора пробы считают момент сливания раствора из пипетки в колбу для титрования.
Время отбора пробы отмечают с точностью до 1 мин, сразу после сливания выделившийся йод титруют 0,015 Н раствором гипосульфита с известным титром. Раствор гипосульфита прибавляют до бледно-желтой окраски раствора. Затем добавляют несколько капель раствора крахмала и титруют раствором гипосульфита до исчезновения синего окрашивания раствора, светло-синяя окраска раствора, появляющаяся через некоторое время после титрования, не учитывается. Через 10 минут после отбора пробы из каждой колбы берут снова 10 мл раствора и титруют гипосульфитом. Затем через 10 минут отбирают третью пробу и т.д. Одинаковое число миллилитров гипосульфита, израсходованное на титрование йода в двух последовательно взятых пробах из каждой колбы, указывает на достижение равновесия в реакции.
В такой же последовательности проводят опыт при другой температуре (например, 40°С ). Расчет Кс проводят отдельно для двух взятых растворов при двух температурах.
. 4. РАСЧЕТЫ
Расчет ведут следующим образом.
4.1. Концентрация йода СJ2 в cостоянии равновесия будет
![]() ,
,
где
![]() -молярность
раствора гипосульфита;
-молярность
раствора гипосульфита;
v1 - количество гипосульфита, израсходованное на титрование йода в момент равновесия, мл;
v2 - количество взятой пробы, мл.
4.2. Концентрация ионов Fе2+ будет равна известной концентрации йода, так как по уравнению реакции образуется одна молекула йода и два иона Fе2+, следовательно, СFe2+ = 2CJ2 .
4.3. Концентрация Fе3+ .при равновесии равна разности начальной концентрации ионов Fе3+ и равновесной концентрации, так как из уравнения реакции прирост концентрации Fе2+ равен убыли концентрации Fе3+
CFe3+ = CFeCl3 – CFe2+,
или
CFe3+ = CFeCl3 – 2CJ2.
Содержание FеС1з вычисляется из концентрации исходного раствора и степени растворения его при смешении растворов
![]() ,
,
где
![]() - начальная концентрация раствораFеСlз,
моль/л;
- начальная концентрация раствораFеСlз,
моль/л;
а и в - количества растворов FеС1з и КJ, соответственно взятые для проведения реакции.
4. 4. Концентрация J- вычисляется по уравнению
CJ- = CKJ – 2CJ2.;
![]() ,
,
где C°KJ - концентрация исходного раствора, моль/л.
4. 5. Константу равновесия исследуемой реакции, которая в ионной форме записывается так:
2Fe3+ + 2J- = 2Fe2+ + J2,
определяют из выражения
 .
.
4. 6. Тепловой эффект реакции Н вычисляют, используя интегральную форму уравнения Вант-Гоффа:
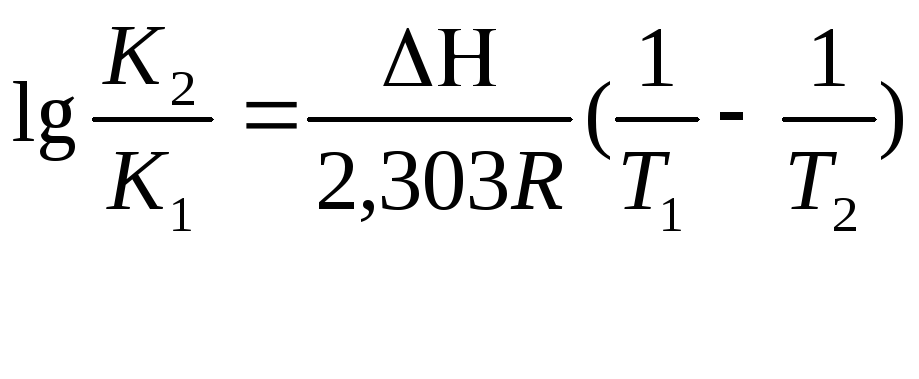 ,
,
где К2 и K1 - константы равновесия реакции, определенные соответственно при температуре опыта Т2 и T1.
Экспериментальные и расчетные данные записывают в таблицу по образцу.
Таблица 2
|
Номер опыта |
Колба 1 при температуре
|
Колба 2 при температуре |
Веще- ство |
Концентрация вещества, г-моль/л | |||||
|
Время отбора пробы |
Пошло на титр., мл |
Время отбора пробы |
Пошло на титр., мл |
В колбе 1 |
В колбе 2 | ||||
|
На чаль ная |
Рав но вес ная |
На чаль ная |
Рав но вес ная | ||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
Второй закон термодинамики.
Энтропия. Изменение энтропии в различных процессах.
Изохорно-изотермический потенциал
Изобарно-изотермический потенциал
Химический потенциал.
Закон действующих масс.
Уравнение изотермы реакции.
Зависимость константы равновесия от температуры и давления.
Тепловая теорема Нернста.
Методика выполнения работы.
СПИСОК ЛИТЕРАТУРЫ
1. Стромберг А. Г., Семченко Д. П. Физическая химия. - М.: Высшая школа, 1973.
2. Краткий курс физической химии. - М.: Высшая школа, 1978.
3. Физическая химия /Под ред. К.С. Краснова. - М.: Высшая школа, 1982.
4. Практикум по физической химии /Под ред. С.В.Горбачева. - М.: Высшая школа, 1974.
