
Общие сведения о катализе и катализаторах
План лекции:
1 Краткая теория катализа
2 Требования, предъявляемые к катализаторам
3 Стадии каталитических реакций
4 Краткая характеристика каталитических реакций
1 Краткая теория катализа
Увеличение объёма производства нефтепродуктов, расширение их ассортимента и улучшение качества – основные задачи, поставленные перед нефтеперерабатывающей промышленностью в настоящее время. Возрастание доли переработки сернистых и высокосернистых нефтей, а также высокопарафинистых нефтей потребовало изменение технологии переработки нефти. Большое значение приобрели вторичные процессы. Производство топлив, отвечающих современным требованиям, невозможно без применения таких процессов как КК, КР, ГО, алкилирование, изомеризация и гидрокрекинг.
Катализ (этот термин впервые был предложен шведским химиком Берцелиусом в 1855г) является исключительно эффективным методом осуществления в промышленности химических превращений. В настоящее время до 90% всей химической продукции мира изготовляется каталитическим путём.
Катализ – многостадийный физико-химический процесс избирательного механизма и скорости термодинамически возможных химических реакций веществом-катализатором, образующим с участниками реакций промежуточные химические соединения.
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора — и отрицательный катализ, приводящий к уменьшению скорости химического превращения (ингибирование).
Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ.
Важной особенностью катализа является:
1) сохранение катализатором своего состава, в результате промежуточных химических взаимодействий с реагирующими веществами.
2) Катализатор не расходуется в процессе катализа. Но под влиянием реагентов, примесей, циркуляция и температура катализатора всегда претерпевает физико-химические изменения. В этой связи в промышленных каталитических процессах предусматривают операции замены, периодической или непрерывной регенерации катализатора.
3) Катализатор не может влиять на термодинамическое равновесие химической реакции.
4) специфичность действия катализатора. Многие катализаторы проявляют каталитическую активность в отношении одной или узкой группы реакции. Для каждой реакции целесообразно использовать свой наиболее активный и селективный катализатор.
Классификация катализа и каталитических реакций
По агрегатному состоянию реагирующих веществ и катализатора различают:
- гомогенный катализ, когда реагенты и катализатор находятся в одной фазе;
- гетерогенный катализ, когда каталитическая система включает несколько фаз. В нефтепереработке гетерогенный катализ, особенно с твердым катализатором, распространен значительно больше, чем гомогенный.
По природе промежуточного взаимодействия реагирующих веществ и катализаторов катализ подразделяется на три класса:
1) гомолитический катализ - когда химическое взаимодействие протекает по гомолитическому механизму.
По гомолитическому, преимущественно так называемому электронному катализу протекают реакции окислительно-восстановительного типа (такой катализ поэтому часто называют окислительно-восстановительным):
- гидрирования,
- дегидрирования,
- гидрогенолиза гетероорганических соединений нефти,
- окисления и восстановления в производстве элементной серы,
- паровой конверсии углеводородов в производстве водорода,
- гидрирования окиси углерода до метана и др.
Каталитической активностью в отношении таких реакций обладают переходные металлы первой подгруппы (Сu, Ag) и восьмой группы (Fe, Ni, Co, Pt, Pd) периодической системы Д. И. Менделеева, их окислы и сульфиды, их смеси (молибдаты никеля, кобальта, ванадаты, вольфраматы, хроматы), а также карбонилы металлов и др.
Пример: С6Н14 → С6Н12 +Н2
2) гетеролитический - в случае гетеролитической природы промежуточного взаимодействия.
Гетеролитический, или так называемый ионный, катализ, имеет место в каталитических реакциях крекинга, изомеризации, циклизации, алкилирования, деалкилирования, полимеризации углеводородов, дегидратации спиртов, гидратации олефинов, гидролиза и многих других химических и нефтехимических процессах.
К катализаторам ионных реакций относят жидкие и твердые кислоты и основания (по этому признаку гетеролитический катализ часто называют кислотно-основным): H2SO4, HF, HCl, Н3РО4, HNO3, СН3СООН, AlCl3, BF3, SbF3, окислы алюминия, циркония, алюмосиликаты, цеолиты, ионообменные смолы, щелочи и др.
Пример: RCH=CH2 + H+A- → RC+HCH3 + A-
a) RC+HCH3 → RCH2 – C+H2 – первичный карбений-ион
б) RC+HCH3 → RC+H – CH3 – вторичный карбений-ион
3) бифункциональный (сложный) катализ, включающий оба типа химического взаимодействия.
В техническом катализе (например, в процессах каталитического риформинга и гидрокрекинга) нашли широкое применение бифункциональные катализаторы, состоящие из носителя кислотного типа (окись алюминия, алюмосиликаты, промотированные галоидами, цеолитом и др.) с нанесенным на него металлом — катализатором гемолитических реакций (Pt, Pd, Co, Ni, Mo и др.)
Ценность этой классификации заключается в том, что именно природа промежуточного химического взаимодействия, а не агрегатное состояние реакционной системы определяет свойства, которыми должен обладать активный катализатор.
Пример:
С6Н14
(-Н2)
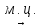 С6Н12
С6Н12
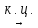 ц-С6Н12
(-3Н2)
ц-С6Н12
(-3Н2)
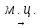 С6Н6
С6Н6
Теплота образования первичных карбений-ионов на 81 кДж/моль больше, чем для вторичных, и на 142 кДж/моль больше, чем для третичных. Вследствие этого, первичные карбений-ионы быстро переходят в третичные.
