
- •Основные положения молекулярно-кинетической теории (мкт)
- •2012 Оглавление
- •1. Статистические и термодинамические методы исследования
- •2.Термодинамическая система
- •3. Опытные законы идеального газа
- •4. Уравнение состояния идеального газа
- •5. Основное уравнение молекулярно-кинетической теории идеальных газов
- •6. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движения
- •7. Барометрическая формула. Распределение Больцмана
- •8. Среднее число столкновений и средняя длина свободного пробега
- •10. Явления переноса
- •Список использованной литературы:
3. Опытные законы идеального газа
Опытным путем, задолго до появления молекулярно-кинетической теории, был открыт целый ряд законов, описывающих равновесные изопроцессы в идеальном газе. Изопроцесс - это равновесный процесс, при котором один из параметров состояния не изменяется (постоянен). Различают изотермический (T = const), изобарический (p = const), изохорический (V = const) изопроцессы. Изотермический процесс описывается законом Бойля-Мариотта: "если в ходе процесса масса и температура идеального газа не изменяются, то произведение давления газа на его объем есть величина постоянная PV = const. Графическое изображение уравнения состояния называют диаграммой состояния. В случае изопроцессов диаграммы состояния изображаются двумерными (плоскими) кривыми и называются соответственно изотермами, изобарами и изохорами.
Изобарический
процесс описывается законом Гей-Люссака:
"если в ходе процесса давление и масса
идеального газа не изменяются, то
отношение объема газа к его абсолютной
температуре есть величина постоянная.
![]()
Уравнение
изобарического процесса можно записать
иначе:
![]() ,
где V0 - объем газа при 0С; Vt - объем газа
при tC; t - температура газа в градусах
Цельсия; a - коэффициент объемного
расширения. Из формулы следует, что
,
где V0 - объем газа при 0С; Vt - объем газа
при tC; t - температура газа в градусах
Цельсия; a - коэффициент объемного
расширения. Из формулы следует, что![]() . Опыты французского физика Гей-Люссака
(1802 г) показали, что коэффициенты объемного
расширения всех видов газов одинаковы
и
. Опыты французского физика Гей-Люссака
(1802 г) показали, что коэффициенты объемного
расширения всех видов газов одинаковы
и![]() , т.е. при нагревании на 1С газ увеличивает
свой объем на часть того объема, который
он занимал при 0С.
, т.е. при нагревании на 1С газ увеличивает
свой объем на часть того объема, который
он занимал при 0С.
Изохорический
процесс описывается законом Шарля:
"если в ходе процесса объем и масса
идеального газа не изменяются, то
отношение давления газа к его абсолютной
температуре есть величина постоянная:
![]()
Уравнение
изохорического процесса можно записать
иначе:![]() ,
где Р0 - давление газа при 0С; - давление
газа при t; t - температура газа в градусах
Цельсия; - температурный коэффициент
давления. Из формулы следует, что
,
где Р0 - давление газа при 0С; - давление
газа при t; t - температура газа в градусах
Цельсия; - температурный коэффициент
давления. Из формулы следует, что![]() . Для всех газов
. Для всех газов![]() и
и![]() . Если газ нагреть на 1С (при V=const), то
давление газа возрастет на часть того
давления, которое он имел при 0С.
. Если газ нагреть на 1С (при V=const), то
давление газа возрастет на часть того
давления, которое он имел при 0С.
Закон Дальтона гласит: Давление смеси равно сумме парциальных давлений газов, образующих смесь. Давления называется парциальными. Парциальное давление - это давление которое создавал бы данный газ, если бы он один занимал тот сосуд, в котором находится смесь (в том же количестве, в котором он содержится в смеси).
4. Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
 — давление,
— давление,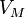 — молярный
объём,
— молярный
объём,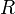 — универсальная
газовая постоянная
— универсальная
газовая постоянная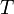 — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как ![]() ,
где
,
где![]() —количество
вещества,
а
—количество
вещества,
а ![]() ,
где
,
где![]() —
масса,
—
масса,![]() —молярная
масса,
уравнение состояния можно записать:
—молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() — закон
Бойля — Мариотта.
— закон
Бойля — Мариотта.
![]() — Закон
Гей-Люссака.
— Закон
Гей-Люссака.
![]() — закон Шарля (второй
закон Гей-Люссака, 1808 г.).А
в форме пропорции
— закон Шарля (второй
закон Гей-Люссака, 1808 г.).А
в форме пропорции ![]() этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
