
- •1. Техника и методика демонстрационных опытов
- •2. Техника и методика демонстрационных опытов по изучению термической нестойкости некоторых сложных и простых веществ.
- •3. Техника и методика демонстрационных опытов по изучению свойств активных металлов.
- •6. Техника и методика демонстрационных опытов по изучению закона сохранения массы веществ.
- •2. Муравьиная (формиатная) кислота.
6. Техника и методика демонстрационных опытов по изучению закона сохранения массы веществ.
Опыт 1. Реакции между растворами.
Оборудование: технохимические весы, разновесы, химические стаканы.
Реактивы: раствор купрум (II) сульфат, натрий гидроксид.
Ход эксперимента.
На весах уравновешивают два стакана с растворами, в один из которых налито 10-15 мл раствора купрум (II) сульфата, а в другой – раствор натрий гидроксида. Далее проводят химическую реакцию, для чего раствор купрум (ΙΙ) сульфата вливают в раствор натрий гидроксида. Химические стаканы возвращают на чашку весов. Равновесие не нарушается, а наличие признаков химической реакции (выпадение осадка) показывает, что она произошла.
Опыт 2. Разложение малахита.
Оборудование: горелка, песок, прибор Ландольта. весы Беранже.
Реактивы: купрум (ΙΙ) гидроксокарбонат, кальций гидроксид (известковая вода).
Ход эксперимента.
В одно колено прибора Ландольта кладут немного основного купрум (ΙΙ) карбоната (малахита), а в другое – наливают раствор известковой воды. Отверстие прибора закрывают пробкой и взвешивают на весах. Затем прибор закрепляют в штативе и осторожно нагревают то колено, где находится малахит. Соль чернеет, на стенках прибора образуются капельки воды, а известковая вода мутнеет. После охлаждения прибора его снова устанавливают на весах – обнаруживают неизменность его массы после прокаливания малахита.
7. Техника и методика занимательных опытов.
Опыт 1. «Волшебная палочка».
Оборудование: фарфоровая чашка, стеклянные палочки, пипетки, лопаточка, свеча или спиртовка
Реактивы: калий перманганат ( сухой ), концентрированная сульфатная кислота.
Ход эксперимента.
0,5 г кристаллического перманганата калия поместить в фарфоровую чашку и прилить к нему немного (несколько капель) концентрированной сульфатной кислоты. Смесь перемешать стеклянной палочкой. Происходит реакция:
2 KMnO4 + H2SO4 → K2SO4 + H2O + Mn2O7
Образующийся Mn2O7 медленно разлагается по следующей схеме:
2 Mn2O7→ 4 MnO2 + О2
В ходе реакции образуется также небольшое количество озона. Стеклянную палочку обмакнуть в манган (VΙΙ) оксид и дотронуться ею до фитиля спиртовки. Спиртовка сразу же загорается.
Опыт 2. «Дым без огня».
Оборудование: тигель, стакан.
Реактивы: концентрированный раствор нашатырного спирта, раствор хлоридной кислоты.
Ход эксперимента.
Тигель с концентрированным раствором нашатырного спирта (1 – 2мл), прикрывают стаканом, смоченным раствором хлоридной кислоты. Наблюдают выделение белого дыма из образовавшегося аммоний хлорида.
Опыт 3. «Вулкан».
Оборудование: асбестовая сетка, стеклянная палочка, горелка, лист бумага, ступка с пестиком.
Реактивы: аммоний дихромат.
Ход эксперимента.
На демонстрационном столе расстилают большой лист бумаги, на которую кладут асбестовую сетку с тонко измельченным в ступке аммоний дихроматом, насыпанном в виде горки. В пламени горелки раскаляют стеклянную палочку и дотрагиваются ею к верхней части горки аммоний дихромата. Сразу же наступает реакция разложения, которая сопровождается “ извержением вулкана “ в виде искр и разбрасывающихся частичек хром (ΙΙΙ) оксида темно-зеленого цвета. Сущность происходящего процесса может быть представлена следующим уравнением реакции:
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Лекция 9 – 10.
Тема: Химический эксперимент по органической химии.
План
1.Техника и методика демонстрационных опытов по получению и изучению свойств углеводородов.
2. Техника и методика демонстрационных опытов по получению и изучению свойств оксигенсодержащих органических веществ.
3. Техника и методика демонстрационных опытов по получению и изучению свойств нитрогенсодержащих органических веществ.
4. Техника и методика биохимических исследований.
1.Техника и методика демонстрационных опытов по получению и изучению свойств углеводородов.
Оборудование: пробирки, цилиндры, кристаллизатор, колба, колокол.
Реактивы: обезвоженный натрий ацетат, натронная известь, известковая вода, бромная вода, раствор калий перманганата, этиловый спирт, сульфатная кислота, речной песок, кальций карбид, бензол, толуол, нитратная кислота.
Предельные углеводороды
Опыт 1. Получение метана.
В сухую пробирку, снабженную пробкой с газоотводной трубкой, поместить смесь из обезвоженного натрий ацетата и натронной извести (примерно 1:2) высотой слоя 2-3см. Затем укрепить пробирку горизонтально и нагреть смесь в пламени горелки. Метан собирать путем вытеснения воды из цилиндра или газометра.
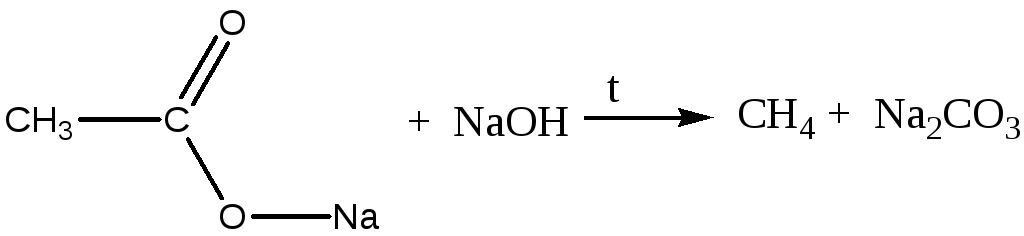
Опыт 2. Определение качественного состава метана по продуктам горения.
Полученный в предыдущем опыте метан поджечь у конца газоотводной трубки. Подвести под колокол газоотводную трубку с небольшим пламенем горящего метана. При горении выделяются водяные пары, от которых внутренние стенки колокола покрываются капельками воды. После прекращения горения колокол быстро перевернуть отверстием вверх и влить в него 40-50 мл известковой воды, которая мутнеет, если колокол несколько раз встряхнуть.
CH4+O2 →CO2+2H2O
CO2 +Ca(OH)2 → CaCO3↓+ H2О
Опыт 3. Отношение насыщенных углеводородов к раствору калий перманганата, щелочам, кислотам.
В пробирки с раствором калий перманганата, щелочи и кислоты поочередно ввести газоотводную трубку с выделяющимся метаном и пропускать через каждый раствор в течение одной минуты. Зафиксировать отсутствие признаков реакций.
В качестве смеси насыщенных углеводородов для аналогичного исследования можно использовать вазелиновое масло.
Непредельные углеводороды
Опыт 4. Получение этилена и его горение.
В пробирку поместить 1 мл этилового спирта, 2 мл концентрированной сульфатной кислоты и несколько крупинок песка. Закрыть пробирку пробкой с газоотводной трубкой и осторожно нагреть смесь на пламени горелки. Выделившийся газ поджечь у конца газоотводной трубки - он горит светящимся пламенем.
Химизм процесса:
H3C- CH2OH+ H2SO4→ H3C- CH2-O- SO3 H+ H2O
Этилсульфатная кислота - моноэфир неорганической двухосновной кислоты - при нагревании разлагается:
to
Н 3С-СН2-О-SO3H
H2C
= CH2
+ H2SO4
3С-СН2-О-SO3H
H2C
= CH2
+ H2SO4
Таким образом, при взаимодействии этилового спирта с сульфатной кислотой происходит дегидратация спирта:
![]()
Выделяющийся этилен горит светящимся пламенем.
Опыт 5. Присоединение к этилену брома.
Не прекращая нагревания пробирки со смесью спирта и сульфатной кислоты, опустить конец газоотводной трубки в пробирку с бромной водой. Бромная вода быстро обесцвечивается вследствие присоединения атомов брома по месту двойной связи.
Химизм процесса:
![]()
Углеводороды ряда этилена являются непредельными (ненасыщенными) соединениями. Для алкенов характерны реакции присоединения по месту двойной связи (качественная реакция на кратную связь).
Опыт 6. Отношение этилена к окислителям.
Не прекращая нагревания пробирки со смесью спирта и сульфатной кислоты, опустить конец газоотводной трубки в пробирку с раствором калий перманганата. Фиолетовая окраска раствора исчезает. При этом алкен окисляется в двухатомный спирт и образуется хлопьевидный осадок марган (IV) оксид бурого цвета.
Химизм процесса:
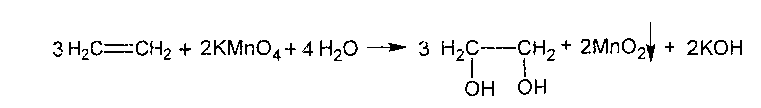
Опыт 7. Получение ацетилена и его горение.
Эту работу проводить в вытяжном шкафу, так как неочищенный ацетилен, полученный из кальций карбида, содержит вредные, неприятно пахнущие примеси.
В пробирку поместить маленький кусочек кальций карбида СаС2, добавить около 1 мл воды и закрыть пробирку пробкой с газоотводной трубкой, имеющей оттянутый конец. В пробирке бурно выделяется газообразный ацетилен. Поджечь ацетилен у конца газоотводной трубки. Он горит светящимся, коптящим пламенем.
Химизм процесса:
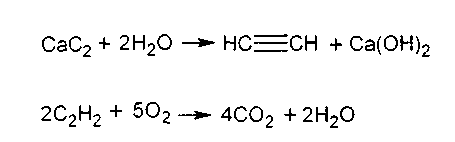
Реакция взаимодействия кальций карбида с водой экзотермична.
Опыт 8. Присоединение к ацетилену брома.
В пробирку с кальций карбидом добавить еще кусочек кальций карбида и воды, закрыть ее пробкой с газоотводной трубкой, конец которой опустить в бромную воду. Бромная вода обесцвечивается вследствие присоединения атомов брома по месту тройной связи.
Химизм процесса:
![]()
Опыт 9. Отношение ацетилена к окислителям.
В пробирку поместить 1 мл раствора калий перманганата и пропустить через раствор ацетилен. Раствор, окрашенный в розовый цвет, быстро обесцвечивается: происходит окисление ацетилена по месту разрыва тройной связи с образованием промежуточного продукта окисления – оксалатной кислоты, которая окисляется дальше до углекислого газа:
Химизм процесса:

Обесцвечивание бромной воды и раствора калий перманганата является доказательством непредельности ацетилена.
Ароматические углеводороды
Опыт 10. Бензен как растворитель.
Бензен как экстрагент.
В пробирку наливают 1,5 мл йодной воды и 1 мл бензена. Содержимое пробирки энергично взбалтывают и дают отстояться. Нижний слой (йодная вода) обесцвечивается, а верхний слой (бензен) окрашивается в желто-коричневый цвет. Йод лучше растворяется в бензене, чем в воде, и поэтому экстрагируется в верхний слой бензена.
Бензен как жирорастворителъ.
В пробирку наливают 1,5 мл бензена и добавляют 2-3 капли растительного масла, перемешивают. Наблюдают образование однородной смеси (растворение масла).
Опыт повторяют с маленьким кусочком сливочного масла или маргарина.
Бензен как растворитель полимеров.
В пробирку наливают 2 мл бензена и бросают несколько кусочков полистирола. Наблюдают набухание полимера и его дальнейшее растворение.
Опыт 11. Отношение бензена к бромной воде.
В пробирку поместить 1,5 мл бромной воды и 1 мл бензена. Содержимое пробирки энергично взболтать и дать отстояться. Нижний слой (бромная вода) обесцвечивается, а верхний слой (бензен) окрашивается в коричневато-желтый цвет. Бром легче растворяется в бензене, чем в воде, и поэтому переходит в верхний слой бензена.
Опыт 12. Отношение бензена к калий перманганату.
В пробирку поместить 1,5 мл калий перманганата (раствор) и 1 мл бензена. Содержимое пробирки энергично взболтать и дать отстояться. Наблюдать разделение смеси: верхний бесцветный бензен, нижний - малиновый раствор калий перманганата.
Опыт 13. Окисление толуена.
В две пробирки поместить по 1 мл 5-процентного раствора калий перманганата и по 1 мл разбавленной (2н) сульфатной кислоты. Затем в одну из них добавить бензен, в другую - толуен. Пробирки закрыть пробками со вставленными вертикально стеклянными трубками и нагреть на водяной бане. В пробирке с толуеном наблюдается побурение и выпадение осадка, а в другой - никаких изменений не происходит. Бензен очень стоек к окислению, более стоек, чем парафин. Но и у них ароматическое ядро более устойчиво к действию окислителей, чем соединенные с ядром углеводородные радикалы. Как бы ни была сложна боковая цепь, при действии сильных окислителей она разрушается, за исключением атома карбона, ближайшего к ядру. Атом карбона, соединенный с ароматическим ядром, окисляется в карбоксильную группу.
Химизм процесса:

толуен бензоатная кислота
В условиях очень энергичного окисления (НСlO3 + Н2SО4 или кислородом воздуха в присутствии катализатора V2O5) кольцо бензена разрушается, окисляется и превращается в малеиновую кислоту:

малеинатная оксалатная
кислота кислота
Опыт 14. Нитрование ароматических углеводородов (тяга).
В большой пробирке смешать 2 мл концентрированной сульфатной кислоты (плотность1,84) с 1,5 мл концентрированной нитратной кислоты. К полученной смеси прилить по каплям 1,5 мл бензена, сильно встряхивая содержимое пробирки (температура не должна принимать значение выше 40 С) и охлаждая в случае необходимости водой. Закрыв пробирку пробкой с воздушным холодильником нагревать ее 15 минут на водяной бане до 60o C часто встряхивая. Затем реакционную смесь охладить и вылить в стаканчик с 10 мл ледяной воды. Наблюдать, как на дно опускаются капли тяжелого нитробензена, мутного от присутствия влаги.
Химизм процесса:
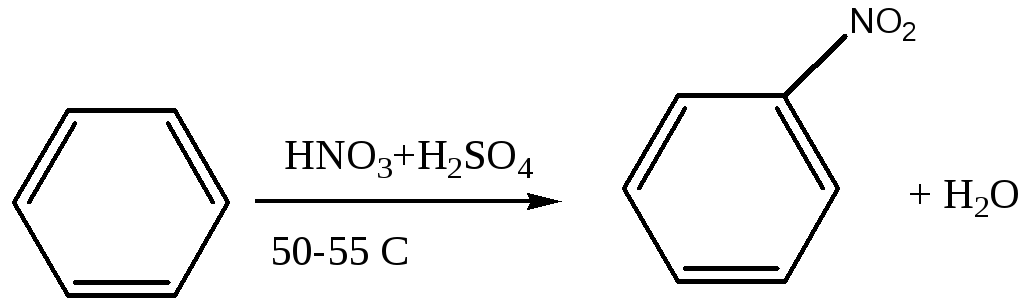
бензен нитробензен
Активной формой нитрующего агента является катион нитрозония NO2+, образующийся при действии сульфатной кислоты на нитратную.

Опыт 15. Горение бензена.
Немного бензена на стеклянной палочке внести в пламя горелки. Он воспламеняется и горит сильно коптящим пламенем.
2 Техника и методика демонстрационных опытов по получению и изучению свойств оксигенсодержащих органических соединений.
Оборудование: пробирки, пробиркодержатели, палочки стеклянные, пипетки, шпатели, газовые горелки, пробки с газоотводными трубками, кристаллизатор с водой, лед, аппарат Киппа, часовое стекло, медная спираль, штатив лабораторный, воронка коническая, вата, фарфоровая чашка, фильтровальная бумага, асбестовая сетка, подсолнечное масло, животный жир, воздушный холодильник, коническая колба, черный хлеб.
Реактивы: этанол, сульфатная кислота, калий бромид, глицерин, натрий, фенол, натрий гидроксид, мрамор и хлоридная кислота для получения СО2, купрум (II) сульфат, бромная вода, фенолфталеин, феррум (III) хлорид, бензальдегид, аргентум (Ι) нитрат, раствор аммиака, калий перманганат, формалин, метанол, ацетатная кислота, метилоранж, лакмус, магний (стружка), купрум (II) оксид, натрий ацетат, натрий карбонат, формиатная кислота, стеаратная кислота, олеатная кислота, диэтиловый эфир, бензоатная кислота, изобутиловый спирт, натрий хлорид, хозяйственное мыло, стиральный порошок, кальций хлорид, глюкоза, сахароза, кальций гидроксид, кобаль (II) сульфат, никель (II) сульфат, крахмал, йодная вода.
Опыт 1. Взаимодействие этанола с гидроген бромидом.
В пробирку наливают 1,5 мл этилового спирта и 1 мл воды, затем добавляют по каплям при встряхивании и охлаждении 1,5 мл концентрированной сульфатной кислоты. После охлаждения реакционной смеси до комнатной температуры в нее добавляют 1,5 г растертого в порошок калий бромида. Пробирку закрывают пробкой с изогнутой газоотводной трубкой и укрепляют в лапке штатива. Конец газоотводной трубки опускают в воду (1 мл), налитую в пробирку-приемник и охлаждаемую снаружи льдом. Содержимое пробирки прогревают и затем очень осторожно нагревают до кипения (образуется пена). Постепенно кристаллы калий бромида исчезают, а в пробирке-приемнике собираются бесцветные тяжелые капли этилбромида. Перегонку этилбромида нужно вести при хорошем охлаждении пробирки-приемника, так как он имеет низкую температуру кипения (+38,4 С). Пипеткой удаляют из пробирки-приемника верхний водный слой. Вносят каплю этилбромида в пламя горелки (стеклянной палочкой). Пламя по краям окрашивается в зеленый цвет.
Химизм процессов:
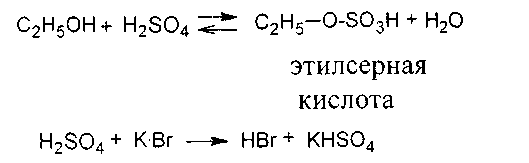
C2H5-SO3H +HBr → C2H5Br + H2SO4
Суммарное уравнение:
C2H5OH + H2SO4 +KBr → C2H5Br+K HSO4 +H2O
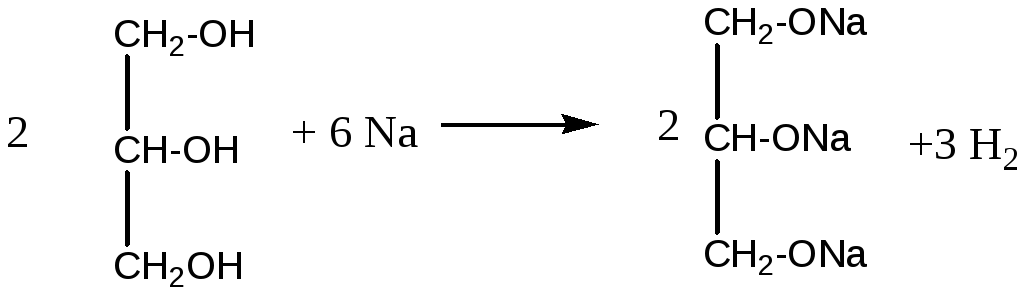
Опыт 2. Взаимодействие глицерина с натрием. В пробирку с 2 - 3 мл абсолютного (безводного) глицерина бросают маленький кусочек натрия. Для начала реакции смесь можно слегка нагреть, после чего реакция идет очень энергично. Глицерин при этом обугливается и иногда загорается.
Опыт 3. Растворение фенола в воде при комнатной температуре и при нагревании.
Фенол - ядовитое вещество, вызывающее ожоги, поэтому соблюдайте необходимую осторожность при работе с фенолом и его раствором.
В пробирку к 1 мл воды прибавляют несколько кристалликов фенола. Содержимое встряхивают, заметного растворения фенола не происходит. Пробирку нагревают, фенол растворяется. При охлаждении пробирки раствор мутнеет, вследствие частичного выделения фенола.
Опыт 4. Вытеснение фенола с натрий фенолята карбонатной кислотой.
К 0,1 - 0,3 г фенола прибавляют 1 - 2 мл 2н раствора гидроксида натрия. Постепенно происходит растворение фенола. Смесь нагревают до получения однородной жидкости. В охлажденный раствор пропускают ток углекислого газа из аппарата Киппа. Наблюдают помутнение раствора:
![]()
Опыт5. Свойства глицерина.
Рассмотрите склянку с глицерином, наклоните ее. Что можно сказать о цвете и вязкости глицерина? Выньте пробку: есть ли запах у глицерина?
К 0,5 мл воды в пробирке добавьте 2 капли глицерина, содержимое взболтайте. Прибавьте еще 2 капли глицерина и снова взболтайте. Что можно сказать о растворимости глицерина в воде?
Взаимодействие глицерина с купрум (II) гидроксидом. Помещают в пробирку 2-3 капли двухпроцентного раствора купрум(II) сульфата, 0,5 мл 10% раствора натрий гидроксида и перемешивают - образуется голубой студенистый осадок купрум (II) гидроксида. В пробирку добавляют несколько капель глицерина и взбалтывают содержимое. Осадок растворяется и получается темно-синее окрашивание вследствие образования купрум (II) глицерата.
Химизм процесса (упрощенно):

купрум (II) глицерат
Опыт 6. Взаимодействие фенола с бромной водой и раствором щелочи.
В пробирку помещают 1 мл водного раствора фенола и при встряхивании по каплям прибавляют бромную воду. Раствор обесцвечивается, и выпадает белый осадок. При добавлении избытка бромной воды осадок превращается в желтый.

К 1-процентному раствору натрий гидроксида, окрашенного фенолфталеином в розовый цвет, прибавляют раствор фенола до обесцвечивания смеси:

Опыт 7. Качественная реакция на фенол.
В пробирку наливают 1 мл раствора фенола и прибавляют каплю 5-процентного раствора феррум (III) хлорид. Появление фиолетового цвета раствора объясняется образованием сильно диссоциированного комплекса фенолята железа (III):
6C6H5 – OH + FeCl3 → [Fe(ОC6H5)6]3 - + 3Cl - +6H +
Опыт 8. Окисление бензальдегида.
а) На часовое стекло помещают 1 - 2 капли бензальдегида и оставляют стоять на воздухе. Через 1 -2ч появляются кристаллы бензоатной кислоты. Бензальдегид на воздухе легко окисляется (аутоокисление):
![]()
надбензоатная
кислота
б) В тщательно вымытую пробирку помещают 1 мл аммиачного раствора аргентум (Ι) оксида и добавляют 2 капли бензальдегида. Содержимое пробирки нагревают на водяной бане до появления зеркального налета или черного осадка металлического серебра:
Пробирку со смесью 2 - 3 мл раствора калий перманганата и 1 - 2 капель бензальдегида нагревают при встряхивании на водяной бане до исчезновения запаха бензальдегида, после этого добавляют несколько капель спирта (фиолетовая окраска исчезает). Затем горячий раствор отфильтровывают от бурого осадка через маленький складчатый фильтр. При подкислении бесцветного фильтрата 2н раствором сульфатной кислоты выделяются кристаллы бензоатной кислоты, хорошо растворимой в щелочах и горячей воде, но малорастворимой в холодной воде.
![]()
Опыт 9. Окисление формальдегида купрум (II) гидроксидом..
В пробирку наливают 2 мл 5-процентного раствора формальдегида, 2 мл 10-процентного раствора натрий гидроксида и при встряхивании добавляют по каплям 2-процентный раствор купрум (II) сульфата до появления неисчезающей взвеси. Верхнюю часть жидкости нагревают до начинающегося кипения.
Голубая окраска меняется на желтую (осадок), а затем на красную (осадок). Эта реакция, как и реакция серебряного зеркала, является качественной реакцией наальдегиды:

голубой синий
![]()
красный
Опыт 10. Окисление спирта до альдегида.
а) Получение формальдегида (муравьиного альдегида) окислением метилового спирта купрум (II) оксидом.
Смачивают метиловым спиртом стенки сухой пробирки. Нагревают спираль из медной проволоки в пламени горелки до образования на ее поверхности черного налета купрум(II) оксида. Раскаленную докрасна спираль опускают в подготовленную пробирку. Эту операцию повторяют несколько раз. Метиловый спирт превращается в формальдегид, имеющий резкий запах. (Нюхать осторожно!)

Для обнаружения формальдегида в пробирку наливают 1 мл раствора фуксинсульфатной кислоты. Через некоторое время появляется фиолетоваяокраска.
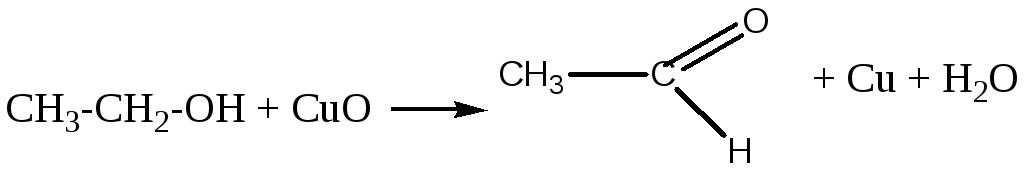
б) Получение уксусного альдегида окислением этилового спирта купрум (II оксидом).
Для получения уксусного альдегида окислением этилового спирта купрум(II) оксидом повторяют опыт а, но вместо метилового спирта сухую пробирку смачивают этиловым спиртом. Ацетальдегид в небольшой концентрации пахнет яблоками. Обнаруживают его цветной реакцией с фуксинсульфатной кислотой.
Опыт 11. Свойства уксусной и муравьиной кислот
1.Уксусная (ацетатная) кислота
а) Кислотные свойства уксусной кислоты.
В три пробирки наливают по 1 мл 10-процентного раствора уксусной кислоты. В первую пробирку добавляют 1 - 2 капли метилового оранжевого, во вторую - 1 - 2 капли раствора синего лакмуса, в третью - 1 - 2 капли 1-процентного спиртового раствора фенолфталеина. Отмечают, в каких пробирках изменилась, окраска.
б) Взаимодействие уксусной кислоты с натрий карбонатом. К 3 - 4 мл 10-процентного раствора карбоната натрия приливают 2 - 3 мл ледяной уксусной кислоты.
Na2CO3+2CH3COOH→2CH3COONa+CO2+ CO2
в) Взаимодействие уксусной кислоты с магнием и с купрум (II) оксидом. В пробирку наливают 2 — 3 мл уксусной кислоты, добавляют немного металлического магния и закрывают пробирку прямой газоотводной трубкой с оттянутым концом. Через некоторое время поджигают выделяющийся газ.
2CH3COOH+Mg → Mg(CH3COO)2+H2
К 0,2 г оксида меди (II), помещенного в пробирку, приливают 2 - 3 мл уксусной кислоты, затем пробирку осторожно нагревают. Обращают внимание на цвет раствора.
2CH3COOH+CuO → Cu(CH3COO)2 +H2O
г) Образование и гидролиз ацетата железа (III). В пробирку наливают 2-3 капли 10-процентного раствора ацетата натрия и прибавляют несколько капель 3-процентного раствора ферум (III) хлорида. Появляется желтовато-красное окрашивание раствора вследствие образования растворимой комплексной соли - хлорида основного ферум (III) гексаацетата [Fe3(ОН)2(СНзСОО)6]+Сl. При кипячении раствора происходит гидролиз комплексной соли (упрощенно ферум (III) ацетата) с образованием основной соли – двузамещенного ферум (III) ацетата, которая выпадает в виде хлопьев красно-бурого цвета.
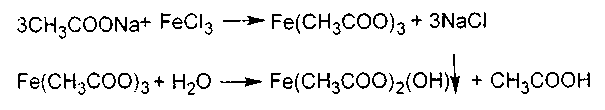
Реакцию можно использовать как качественную на уксусную кислоту и ее соли
