
3) Детерминистские и немишенные эффекты малых доз. Кривые «доза-эффект».
Зависимость «доза-эффект» имеет немонотонный вид (S-образный)
I(D)=αD+βD2
Зависимость доза-эффект выхода многих типов повреждений, носящи нелинейный (линейно-квадратичный) характер.
На этой кривой к малым дозам будут относиться те, которые ниже доз, вызывающих выход большинства повреждений за счет «квадратичного» компонента.
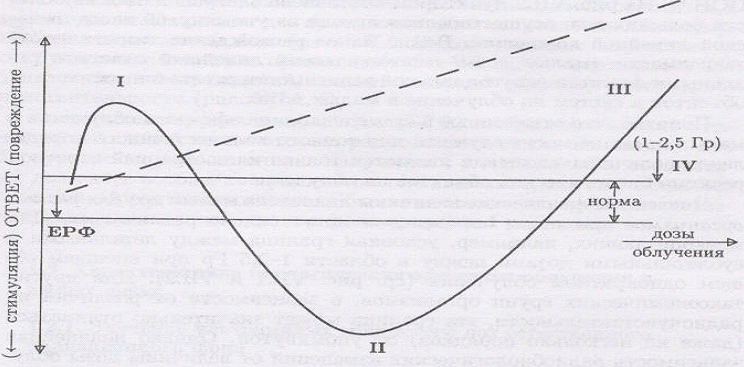
ЕРФ – ультрамалые дозы естественного (природного) радиационного фона.
I – эффекты облучения в сверхмалых дозах (гиперрадиочувствительность);
II – эффекты облучения в малых дозах, вызывающих стимуляцию биологических процессов (гормезис)
III – развитие структурно-функциональных повреждений при облучении в средних сублетальных дозах;
IV – условная граница между большими и средними дозами для млекопитающих составляет 1-2.5 Гр. Пунктир – линейная экстраполяция из области больших доз
Радиобиологические эффекты в области малых доз
Повреждения ДНК
Радиация, в том числе в малых дозах, вызывает повреждения ДНК ряда типов: однонитевые разрывы (ОР), двунитевые разрывы (ДР), модификацию (повреждение или потерю) основания, сшивки ДНК-ДНК и ДНК-белок. Подавляющую часть составляют ОР, большинство которых репарируется живой клеткой в течение нескольких мин после радиационного воздействия, а почти все остальные (за небольшим исключением) — в течение нескольких часов (см. в [61]).
В таблице 4.1 представлен выход основных повреждений ДНК, большинство типов которых можно зафиксировать в том числе при дозах до 100 мГр включительно.
Таблица 4.1 – Выход повреждений ДНК в клетках млекопитающих после воздействия редкоионизирующей радиации (из [61])
|
Тип повреждения |
Выход (число на клетку на Гр–1) |
|
ОР |
500–2000* |
|
ДР |
1–40*; каноническое — 40 |
|
Модификации оснований (окисление, потеря) |
250–700** |
|
Сшивки ДНК-белок |
150 |
* Диапазон значений, полученных разными авторами.
** Диапазон значений для различных типов повреждений.
Несколько выше степень повреждения ДНК для излучений с высокой ЛПЭ. Число ДР возрастает с увеличением ЛПЭ и для a-частиц превышает эффект g-излучения в той же дозе в 1,2–2,7 раза, достигая для фибробластов 50–60 на 1 Гр [61].
До 1990-х гг. разрешимости и чувствительности имеющихся методов не хватало для уверенной регистрации повреждений ДНК различного типа после облучения в малых дозах; даже применительно к наиболее простому и массовому их типу — однонитевым разрывам (см., к примеру, [68]). Однако к концу 1990-х гг. произошло экстраординарное повышение чувствительности методики, обусловленное разработкой нового способа регистрации числа ДР по числу фокусов (сайтов) фосфорилирования гистона γ-H2AX, которые можно выявить по флуоресценции в специальных условиях [69, 70]. Это позволило зарегистрировать ДР при облучении даже в очень малых дозах (до 10 мГр) [44].
Выход исходных радиационных повреждений ДНК линейно зависит от дозы излучения в широком диапазоне, начиная от очень малых и заканчивая большими дозами.
Установлено, что ведущую роль при подавления неправильных воссоединений концов ДНК играет хроматин и модификации гистонов, главной из которых является фосфорилирование С-концевых серинов в гистоне Н2АХ и его аналогов, открытое В. Боннером в 1998 г. (см. в [69]). Фосфорилирование гистона Н2АХ в хроматине может быть ключевым событием, контролирующим точность репарации ДР и стабильность хромосом. Показано, что фосфорилирование Н2АХ после облучения в основном проводит протеинкиназа АТМ, дефектная при наследственном заболевании атаксия-телеангиэктазия, которая быстро активируется при образовании в клетке нескольких ДР [71]. Фокусы γ-Н2АХ можно обнаружить через несколько минут после облучения, их максимальное число выявляется через 30–60 минут и затем медленно уменьшается, что происходит в течение нескольких часов после облучения [72].
Понятно, что, поскольку этим методом ДР выявляются в специальных условиях даже после облучения в очень малых дозах, то диапазон малых доз — зона уверенной регистрации эффектов по выходу ДР (рисунок 4.1).
ДР являются одним из наиболее простых типов самых опасных повреждений ДНК — кластерных или комплексных, для которых характерна затрудненная репарация. Кластерный эффект имеет место тогда, когда участки ионизации (повреждений) распределяются вдоль молекулы ДНК в компактные кластеры сложных, так называемых комплексных повреждений. Такой эффект более присущ для плотноионизирующего излучения, чем для редкоионизирующего, но и для последнего имеются значительные отличия в эффекте по сравнению со спонтанными повреждениями ДНК свободными радикалами. Количество кластеров прямо зависит также от дозы излучения [61].
Комплексные (кластерные) повреждения ДНК отличаются по их способности к репарации клеткой. Так, уровень ДР, индуцированных в клетке сразу после облучения, слабо коррелирует с последующим биологическим эффектом [73]. С этим эффектом коррелируют оставшиеся нерепарированными ДР, хотя количество таковых и может быть очень мало. Таким образом, среди общего пула двунитевых разрывов выделяются различные классы, отличающиеся по способности к репарации [74]. В результате появилась гипотеза, согласно которой именно кластеры повреждений («комплексные повреждения») ответственны за летальные и/или мутагенные (канцерогенные) эффекты ионизирующей радиации [75, 76, 77].
Теоретически какое-то количество кластерных повреждений ДНК должно индуцироваться сколь угодно малыми дозами радиации. Действительно, выход комплексных повреждений в подвергавшихся воздействию рентгеновского излучения клетках человека почти строго линейно зависит от дозы в диапазоне как средних и больших, так и самых малых доз (в последнем случае — при облучении клеток в условиях, исключающих репарацию ДНК). Данные из основополагающих работ [78, 79] представлены на рисунках 4.2 и 4.3.
Индукция кластерных (комплексных) повреждений — главный фактор, обусловливающий специфичность поражающего эффекта радиации. Даже наиболее простые комплексные повреждения — ДР — радиация индуцирует не менее чем в 105 чаще (как долю от суммы всех повреждений ДНК), чем естественный клеточный метаболизм [80]. Таким образом, потенциальный молекулярный механизм канцерогенного эффекта в области малых доз был продемонстрирован на ряде объектов in vitro (см. рисунки 4.2 и 4.3). Несколько позже было показано, что малые дозы редкоионизирующего излучения способны повышать уровень кластерных повреждений и in vivo.
В [81, 82] опубликованы данные исследования фокусов гистона γH2AX в головном мозгу и ткани легких мышей, облученных фотонным микропучком энергией 6 MV в дозах 0,1–1,0 Гр (рисунок 4.4). После облучения мышей в дозе 0,1 Гр было зарегистрировано 0,8 фокуса γ-H2AX на клетку, а после воздействия в дозе 1 Гр — 8 фокусов, т.е., зависимость оказалась линейной, начиная с диапазона малых доз [81, 82].
В 2007 г. параллельно с изучением культур лимфоцитов и фибробластов человека при облучении in vitro проводились исследования индукции фосфорилирования гистона H2AX у индивидуумов после компьютерной томографии (дозы порядка 20–100 мГр) [45]. Клетки подвергали иммуногистохимическому окрашиванию после обработки антителами к гистону γ-H2AX и к другому белку клеточного ответа на повреждения ДНК — 53BP1. Было обнаружено, что .даже такое низкодозовое радиационное воздействие, как CT, в ранние сроки (исследован срок в 5 мин после процедуры) приводит к отчетливому формированию ДР в лимфоцитах, которое по величине сравнимо с эффектом облучения данных клеток in vitro в дозе 20 мГр [45].
Необходимо заметить, однако, что показатель поврежденности ДНК после CT быстро снижается до практически исходного уровня вследствие репарации ДР и только после воздействия в дозе 100 мГр увеличение все еще существенно даже в максимальный исследованный временной срок — 30 мин после облучения [45].
Репарация ДНК, гиперрадиочувствительность и индуцированная радиорезистентность
В области малых доз имеется уверенная индукция репарации ДНК, с чем и связан один из механизмов радиоадаптивного ответа и явления гиперрадиочувствительности [10, 61, 83]. На рисунке 4.5 представлена экспериментальная кривая выживаемости облученных клеток, на которой видны участки гиперрадиочувствительности (связанной с недостаточной индукцией репарации ДНК [84]) и радиоадаптивного ответа (когда репарация индуцируется — индуцированная радиорезистентность [61]). Из рисунка 4.5 видны эффекты в области малых доз.
Радиоадаптивный ответ и гормезис
Радиоадаптивный ответ четко стимулируется малыми дозами радиации (таблица 4.2).
Равным образом, многочисленные гормезисные эффекты на экспериментальных объектах in vitro и in vivo, а также отдельные эпидемиологические данные для человека, продемонстрированы преимущественно именно для области малых доз [53, 61, 85].
Таблица 4.2 – Примеры адаптации к облучению редкоионизирующей радиацией) [53, 61, 85].
|
Объект |
Характеристика и диапазон доз адаптирующего облучения |
|
Семена растений |
Острое, 70 и 250 мГр |
|
Ооциты Drosophila |
Острое, 0,2–20 мГр |
|
Культура клеток рыбы |
Острое, 19–190 мГр |
|
Культура клеток кожи мышей (клетки m5s) |
Острое, 0,1–0,5 Гр |
|
Фибробласты китайского хомячка (клетки CH V79) |
Острое, 0,1–0,4 Гр |
|
Клетки HeLa |
0,05–0,1 Гр, но не 5 мГр |
|
Эмбриональные фибробласты мышей (клетки C3H 10T1/2) |
0,02–1,5 Гр |
|
Фибробласты человека |
Острое, 5–500 мГр |
|
Лимфоциты крыс |
Острое, 5–100 мГр |
|
Лимфоциты мышей |
Хроническое, 50–100 мГр |
|
Лимфоциты человека |
Острое, 5–500 мГр (оптимум 50 мГр) |
|
Пролонгированное и хроническое, 10–100 мГр | |
|
Нормальные, раковые и подвергшиеся трансформации клетки человека |
Острое, 10 мГр |
|
Хроническое, 10–100 мГр | |
|
Органы мышей in vivo (сперматоциты, спленоциты и клетки костного мозга) |
Острое, 0,3–100 мГр |
|
Мыши |
Острое, 50 мГр —2,5 Гр |
|
Пролонгированное, 24 и 120 мГр | |
|
Дробное пролонгированное (4 дозы по 50 мГр) | |
|
Крысы |
Хроническое, 29 мГр —0,78 Гр |
Апоптоз
Апоптоз — это явление программируемой клеточной гибли, сопровождаемое набором характерных цитологических признаков (маркеров апоптоза) и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов. Термин «программированная клеточная смерть» отражает функциональное назначение этого процесса, представляющего естественную часть жизни многоклеточного организма, связанного с метаморфозом и развитием
Один из механизмов радиоадаптивного ответа и гормезиса на уровне организма связывают с апоптотическим устранением популяции исходно радиочувствительных клеток костного мозга (остаются, таким образом, только относительно радиорезистентные клеточные единицы) [10, 45, 61, 84]. Для лимфоцитов человека апоптоз показан начиная с области малых доз [10, 61, 86, 87].
Немишенные эффекты: нестабильность генома и «эффект свидетеля»
Данный документ [AU17]9, в отличие от двух предыдущих, посвящен углубленному рассмотрению именно РИНГ, «эффекта свидетеля» и кластогенного действия излучения. Никаких существенных, кардинальных изменений с 2004 г. по 2006 г. в проектах не обнаружено. Поэтому вполне можно разобрать три проекта документа НКДАР так, как будто это окончательная редакция (конец 2008 г.). Продекларированная цель Сообщения состоит в суммировании свидетельств о немишенных эффектах радиации (когда действие обусловлено не прямым попаданием, а опосредованно) in vitro и in vivo. Приложением же изысканий, в принципе, должны являться новые аспекты в области оценок рисков лучевого канцерогенеза и интерпретации радиоэпидемиологических данных. В данном документе весьма подробно разбираются основные теоретические закономерности в рамках как РИНГ, так и «эффекта свидетеля». Представлен анализ экспериментальных публикаций по РИНГ in vitro, in vivo и при трансгенерационной передаче нестабильности генома. Отдельно рассмотрены опыты на мышах и эпидемиология людей. Документ кажется крайне ценным для мировой радиобиологии. Но преимущественно — для фундаментальной, теоретической радиобиологии. Ибо вновь, как и в соответствующих документах МКРЗ и BEIR, совершенно нет никаких дозовых закономерностей. Не оценена роль анализируемых эффектов для практики радиационной медицины, радиационной безопасности и техногенного облучения. Главные выводы авторов Сообщения НКДАР по немишенным эффектам радиации [AU17] весьма общи и неоднозначны. Сказано, что, теоретически, и РИНГ, и «эффект свидетеля», вследствие повышения числа затронутых клеток, способны «усилить биологическую эффективность конкретной дозы облучения», но это и так ясно, исходя из сути данных феноменов. Отмечается также, что, поскольку немишенные эффекты продемонстрированы и in vivo, «пришло время пересмотреть концепции дозы облучения и размера мишени» («It is time to re-examine the concepts of radiation dose and target size»). И что «эти эффекты могут иметь значение для здоровья облученных людей». Но далее в том же абзаце, без перерыва, говорится о неотъемлемости использования радиации в практике человеческой деятельности, и что «биологические системы продемонстрировали замечательную способность адаптироваться ко всяким неблагоприятным факторам, включая малые дозы радиации». Затем сказано, что высокие дозы радиации, понятно, могут вызывать неоплазию, как путем прямого повреждения, так и посредством немишенных эффектов. И те, и другие должны найти свое место при оценке радиогенных рисков (получается, что для высоких доз облучения). Вот, пожалуй, и все применительно к практическому приложению немишенных эффектов для радиационной безопасности.
Аналитические исследования Котерова А.Н. показали, что радиационно-индуцированная нестабильность генома экспериментально продемонстрированаin vitro и in vivo почти исключительно для доз свыше малых (более 100 мГр). И только если в опыт брались аномальные, радиочувствительные или дефектные биологические объекты (клетки или сверхчувствительные линии мышей), то была показана отсроченная нестабильность генома и для доз до 100 мГр [20, 21, 22, 23, 25, 88]. Таким образом, для относительно нормальных, не модельных объектов, радиационная нестабильность генома малыми дозами не индуцируется, что отражено в том числе в специальной монографии [25]. В 2011–2012 г. НКДАР в документе, посвященном механизмам действия малых доз радиации [89], ссылается на главные обзоры (Котеров А.Н., 2005; 2009 [22, 88]), упоминая, что для нормальных объектов радиационно-индуцированной нестабильности генома по таким-то источникам не обнаруживается. Тем более, что аналитические выводы из более ранних работ Котерова А.Н. подтверждены в последние годы зарубежными исследовательскими группами [90].
Равным образом, работами Котерова А.Н. [91], хотя и менее масштабными, чем в предыдущем случае, было обнаружено, что повреждающий эффект свидетеля (по гибели клеток и нарушениям генома) для области малых доз также отсутствует, если только в опыт брались не клеточные линии с аномальной радиочувствительностью и нестабильностью. Для области малых доз уверенно демонстрируется положительный (т.е., адаптирующий и гормезисный) «эффект свидетеля» [91].
В результате можно сделать вывод, что границей для четкого выявления повреждающих немишенных эффектов радиации может быть назван порог (по крайней мере практический) в 100 мГр. А начиная с 0,3–0,5 Гр (особенно с 0,5 Гр) немишенные эффекты начинают воспроизводиться четко и однозначно, даже для нормальных объектов. Иными словами, немишенные эффекты радиации — прерогатива средних и, особенно, больших доз, но не малых и не очень малых доз.
Тем не менее, другие названные выше радиобиологические эффекты для области малых доз выражены отчетливо (апоптоз, индукция повреждений ДНК и их репарация, увеличение частоты нестабильных аберраций хромосом и пр.) [10, 61]. Однако в стохастические эпидемиологические последствия эти радиобиологические феномены реализуются слабо.
Нестабильность генома
Часть клеток, выживших после облучения, может давать функционально измененное потомство, в котором с высокой частотой на протяжении многих поколений возникают de novo (без доп. облучения!) аберрации хромосом и генные мутации, в ряде случаев приводящие к повышенной клеточной смертности путем апоптоза
В отличие от перманентной геномной нестабильности, приводящей к некоторым наследственным болезням, радиационно-индуцированная нестабильность генома имеет ряд особенностей:
не определяется возникновением стойких нарушений в первичной структуре ДНК;
не определяется копированием в клеточном потомстве радиационных повреждений ДНК родительских клеток,
не имеет клонального характера;
может возникать в клетках, не подвергавшихся облучению (эффект свидетеля);
Нестабильность может проявляться в отдаленные сроки после облучения (иногда через сотни циклов деления).
Сохранение НГ на протяжении десятков поколений клеток животных было впервые показано при облучении в больших дозах;
В 1970-80 е гг. отечественными учеными было показано, что НГ может проявляться и у потомков клеток, облученных в малых дозах;
НГ проявляется как после действия плотноионизирующего, так и редкоионизирующего излучения
У многоклеточных организмов НГ проявляется в увеличении числа (частоты) соматических мутантных клеток
Повышение частоты генетических нарушений у потомков облученной клетки
Отсутствует зависимость НГ от дозы в большом диапазоне доз (возникает после облучения в широком диапазоне доз, включая малые (<20 сГр), особенно при воздействии плотноионизирующих излучений)
НГ регистрируется у лиц, облученных в малых дозах на атомных производствах и проживающих на загрязненных территориях в отдаленные сроки – увеличение генных и хромосомных мутаций в лимфоцитах периферической крови
Спектр мутаций в отдаленные сроки (одиночные и парные фрагменты) отличается от мутаций в непосредственно облученных клетках (дицентрики, кольцевые хромосомы)
