
- •Лекция 5. Начала компьютерной химии. Математические основы теории мо лкао (Простейшая схема одноэлектронной теории).
- •3. Приближение лкао мо.
- •4. Базис и его свойства.
- •5.1. Эффективный гамидьтониан.
- •6. Процедура расчёта мо лкао
- •6.1. Одноэлектронный принцип (одноэлектронное приближение).
- •6.2. Принцип минимума энергии.
- •6.3. Принцип Паули.
- •6.4. Правило Хунда.
6.1. Одноэлектронный принцип (одноэлектронное приближение).
Электроны оболочки неразличимы и независимы, их состояния и уровни одинаковы и могут быть найдены из решения системы связанных одноэлектронных уравнений Шрёдингера.
В простейшем приближении все одноэлектронные уравнения идентичны.
Конкретным следствием и выражением данного принципа применительно к исследуемой молекуле является энергетическая “лесенка” её одноэлектронных уровней и набор собственных векторов МО. Ими-то как раз и являются рассчитанные уровни МО.
Одноэлектронный принцип вовсе не означает отказ от учёта взаимодействий между частицами. Просто он исходит из существования одноэлектронных состояний и одноэлектронных уровней в многоэлектронном коллективе. Одноэлектронные состояния суть орбитали. Поэтому одноэлектронный принцип ещё называют орбитальным приближением.
В атомах его называют принципом водородоподобия.
6.2. Принцип минимума энергии.
В основной электронной конфигурации оболочки молекулы заполнение уровней МО производится в порядке их возрастания.
Этот принцип справедлив применительно к основной электронной конфигурации. Её энергия минимальна. Наряду с основной возможны и возбуждённые конфигурации. Они формально не подчиняются этому принципу.
6.3. Принцип Паули.
Всякая МО не может быть заселена более, чем двумя электронами, у которых спиновые векторы антипараллельны.
Количество электронов на МО называют числом заполнения. Оно может быть равно 0, или 1, или 2, и орбиталь, соответственно, вакантная, полувакантная или занятая.
6.4. Правило Хунда.
В пределах вырожденного орбитального уровня электроны распределяются с максимальным суммарным спином.
Правило Хунда актуально в том случае, если верхний из заполняемых уровней МО вырожден содержит несколько состояний - к нему относятся несколько МО с равной энергией.
Электроны заполняют его с образованием максимально возможного суммарного спина.
В таком случае в ходу слэнг, - говорят о максимально возможном распаривании электронных спинов.
Причина этого в том, что согласно принципу Паули электронам с параллельными векторами спинов запрещено находиться в одной точке пространства (для антипараллельных спинов этого ограничения нет). Поэтому движение электронов с параллельными спинами взаимно скоррелировано. Они не могут находиться на общей орбитали и к тому же автоматически «избегают друг друга», двигаясь на большем удалении друг от друга. За счёт этого параллельные спины обеспечивается выигрыш энергии за счёт дополнительного понижения межэлектронного отталкивания. Этот выигрыш называют обменной энергией.
Вся дальнейшая количественная информация об электронных свойствах молекулы, как-то: о её спектральных свойствах, об электронном распределении, и, следовательно, о реакционной способности молекулы теоретически вычисляется на основе спектра энергетических уровней и матрицы составов МО.
Перейдём к описанию характеристик электронного строения молекулы, называемых индексами электронной структуры.
Индексы электронной структуры.
Локализация и делокализация электронной плотности.
Характеристики атомов и характеристики связей.
Для их вычисления используются следующие уравнения и следующие величины:
а) нормировка
МО ![]() ,
,
б) число электронов на молекулярной орбитали (число заполнения МО) ni ,
в) полное число электронов в оболочке N ,
г) заряд ядра ZM .
![]()
![]()
![]()
![]()
![]()
Уравнение нормировки МО является основой анализа электронного распределения.
Согласно схеме Малликена в нём выделяются несколько способов различного комбинирования слагаемых.
В первом варианте разбиения вся электронная вероятность разбивается на одноцентровые слагаемые, которые привязываются вначале к отдельным АО, а затем, суммируя по всем АО отдельных атомов, приходим к заселённостям атомов.
Во втором варианте вся электронная вероятность в оболочке разбивается на пары АО, и отдельные слагаемые привязываются вначале к областям перекрывания отдельных пар АО, и далее выделяя все АО атомов, образующих связь, получаем порядки связей.
Электронные характеристики молекул по Малликену следующие:
1) Одноцентровые заселённости:
1.1. Заселённости АО qp ,
1.2. Парциальные электронные заселённости АО qip (в составе одной МО),
1.3 .Электронные заселённости атомов qM (в составе всех МО),
Эффективные заряды атомов QM .

2) Двуцентровые заселённости:
Парциальные заселённости областей перекрывания двух АО pipq (в пределах одной МО),
Заселённости перекрывания двух АО (парциальные порядки связей) ppq (в пределах одной МО),
Порядки двуцентровых связей (заселённости связей) pMN (на всех заполненных МО).
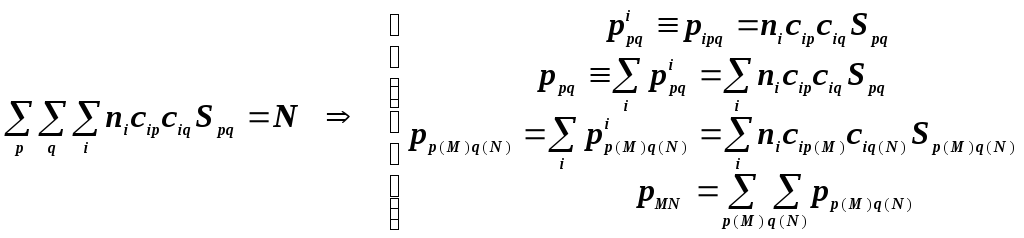
Каждая МО в этой записи представлена в виде вектора-столбца, содержащего набор коэффициентов перед базисными АО. Каждый собственный вектор - массив коэффициентов ещё называют атомно-орбитальным составом МО.
Понятие электронной заселённости не является физически строгим.
Оно продиктовано только лишь схемой подсчёта электронного заряда на основе нормировочного условия для волновых функций. Отдельные слагаемые в соответствующих алгебраических выражениях могут быть ассоциированы с базисными единицами - атомными орбиталями.
Возможны разные схемы суммирования элементов электронного распределения.
В одной схеме весь электронный заряд на каждой МО разбивается на слагаемые, ассоциируемые с АО одиночных центров вначале в составе одной МО. Получаются парциальные заселённости АО в составе МО. Затем производится суммирование парциальных заселённостей каждой АО по всем МО и получаются полные заселённости АО. Они представляют собою условные доли электронного заряда, приписываемые к отдельным базисным АО. Далее суммируя заселённости всех АО атома, получают его электронную заселённость.
Электронная заселённость атома, взятая с обратным знаком, представляет собою электронный заряд атома выраженный в атомных единицах. Суммируя заряд ядра с электронным зарядом атома, получаем эффективный атомный заряд.
В другой схеме весь электронный заряд в составе МО разбивается на слагаемые, ассоциируемые уже с парами АО. Так возникает понятие парциальной заселённости в области перекрывания различных пар АО в составе данной МО. Иначе эту величину называют парциальным порядком связи между двумя АО в составе МО. Суммируя все парциальные порядки связей по всем парам АО этих двух атомов, а также и по всем МО, получаем соответствующий элемент матрицы порядков двуцентровых связей.
Важно отметить, что в молекуле пространственные пределы базисной АО нельзя ограничить лишь одним атомом. Каждая АО пространственно делокализована. Её образ - это непрерывное поле, распределённое в пространстве. Это означает, что доли электронного заряда, связанные с какой-либо АО, лишь условно можно связать с одним или двумя атомами. В каждой точке пространства представлены разные АО, а они-то и содержат части заряда от прочих атомов молекулы. Поэтому при использовании в различных корреляциях данных расчёта корректны лишь достаточно значительные заселённости, тогда как минимальные из них в качестве долей электронного заряда мало достоверны.
Это не единственный недостаток электронных заселённостей. Их количественные значения, естественно, зависят и от вида выбранного базисного набора АО. Поэтому сравнивать их у различных молекул разумно лишь в расчётах, выполненных одним и тем же методом.
Любое сравнение теоретически рассчитанных заселённостей у разных молекул корректно лишь при обязательного условии полного единообразной расчётной процедуры, включая один и тот же базисный набор.
Весь расчёт электронной структуры молекулы реализуется по следующей схеме:
Вначале составляют матрицы S иH. Для этого вычисляют все их элементы.
Далее:
на первой стадии составляется вековой детерминант и решается вековое уравнение относительно энергии. Решения образуют массив уровней энергии (спектр уровней МО).
на второй стадии для каждого уровня определяется собственный вектор. Для этого по очереди каждое из полученных значений энергии (собственное значение) подставляется в систему уравнений МО ЛКАО, и для каждого определяется свой массив коэффициентов при базисных АО (собственный вектор).
Как вычислять матричные элементы?
Матрица перекрывания Sлегко вычисляется по стандартным программам, если геометрия молекулы задана, т.е. определено взаимное расположение ядер в некоторой системе координат.
Если же структура молекулы неизвестна, то современные программы позволяют выполнить оптимизационный расчёт геометрии молекулы.
Матрица гамильтониана H может быть рассчитана приближёнными способами. Каждый способ оценки этих элементов порождает один из полуэмпирических методов МО ЛКАО.
Матрицы S иH могут быть рассчитаны аналитическими способами, в том числе с учётом межэлектронного отталкивания. Так поступают в неэмпирической теории МО ЛКАО.
Во всех случаях расчёт начинается с выбора базиса.
Параметры расширенного метода Хюккеля (РМХ) (Метод Гофмана).
Этот метод простейший из возможных способов расчёта электронной структуры любых молекул с любой геометрией. Он не ограничен какими-либо геометрическими условиями, подобно простому методу Хюккеля.
В методе Гофмана вводится эффективный одноэлектронный гамильтониан.
Вначале рассчитывается матрица перекрывания S.
Затем с помощью матрицы Sрассчитывается матрица эффективного гамильтонианаH.
Базисные АО имеют вид:
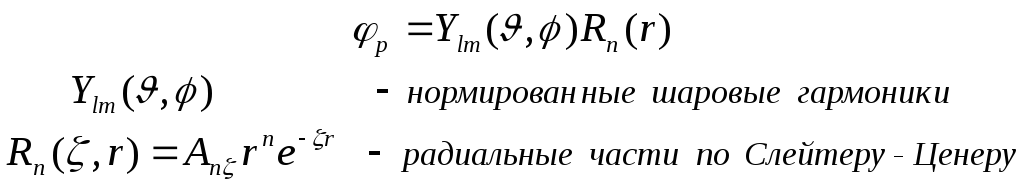 ( )
( )
Нормировочный
множитель АО равен
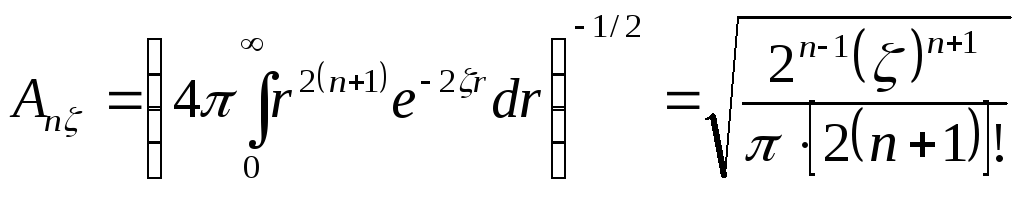
Матричные элементы гамильтониана эмпирически определяются по формулам:
 (
)
(
)
Для расчёта необходимы параметры АО (потенциалы ионизации и показатели экспонент в радиальных частях слейтеровских базисных АО). Они приводятся в справочных таблицах.
Параметры простого метода Хюккеля (Метод МОХ).
Область применимости простого метода Хюккеля очень ограничена.
Это исторически первый вариант метода МО ЛКАО. Метод ограничен лишь плоскими органическими молекулами и может быть использован лишь для расчёта лишь той части МО, в пределах которых обеспечивается возникновение сопряжённых связей.
Такие связи возникают в молекуле, образованной из атомов C, находящихся в состоянии sp2-гибридизации.
Структуры углеродных остовов таких молекул можно рассматривать как вырезки из плоского слоя кристаллической решётки графита. При мысленном выделении всякого такого остова связи СС,«разрезаемые» вдоль его периферии – по контуру, погашаются атомамиH. Возникают концевые связиСH.
Подобные системы сопряжения называют альтернантными.
Метод Хюккеля когда-то распространяли и на иные структуры, подгоняя их характеристики под стандарты примитивного метода МОХ, и это уже менее обосновано.
Для -системы вводится эффективный одноэлектронный-гамильтониан.
От каждого атома в составе базисного набора учитывается только одна p-АО, ориентированная перепендикулярно узловой плоскости -системы, но при этом в простом методе Хюккеля исключается необходимость использовать базисные p-АО в явном виде.
Матрица хюккелевского гамильтониана коммутирует с топологической матрицей (матрицей связности или матрицей смежности), и в силу этого собственные векторы (-МО) гамильтониана идентичны собственным векторам матрицы смежности.
Поэтому метод Хюккеля называют топологическим методом.
Параметризация матричных элементов -гамильтониана выполняется согласно правилам:

![]()
![]()
Все интегралы перекрывания Spq делятся на два типа. Диагональные равны единице, недиагональные равны нулю: Spq=pq (1 для p=q, и 0 для pq).
Выполняя расчёт, нумеруют атомы в системе сопряжения. Эти номера идентичны номерам базисных АО (БАО).
Затем поочерёдно в первую строку выписывают матричные элементы эффективного гамильтониана, порождаемые первой из пронумерованных АО. Во второй строке перечисляют матричные элементы, порождаемые второй АО, затем так же образуют третью строку и т.д..
Из каждого диагонального матричного элемента вычитают энергию – её значения затем подлежат расчёту. Полученный детерминант приравнивают нулю. Затем матричные элементы делят на величину, и в результате полученный вековой детерминант содержит всего три сорта матричных элементов, они равны 0, 1,X= (-E)/.
Неизвестная величина Xсодержит энергию. Число её значений – корней векового уравнения равно числу возможных уровней МО, их столько, сколько АО в базисе системы.
Раскрывают вековой детерминант, получают вековое уравнение. Его решают относительно неизвестной X. Получают массив корней векового уравнения {X1,X2,X3,...Xn}.
Тем самым определены и энергетические уровни { E 1,E 2,E 3,...E n}. Каждый из них равенE i=-XiЕдиницей измерения энергии уровней является резонансный параметр (интеграл)Начало отсчёта – величина. Нижележат уровни связывающих МО, а выше –разрыхляющих МО. Если же в числе корней векового уравнения есть нули, то соответствующие уровни несвязывающие, и они равны
ПРОСТЕЙШИЙ ВЫВОД УРАВНЕНИЙ ТЕОРИИ МО ЛКАО
0) Прежде всего в молекуле вводится нумерация атомов, скажем в виде m,nÎ(1,2,3,…N).
1) Затем у каждого атома можно было бы отдельно нумеровать его АО, и получить массив номеров АО в виде
11, 12, …,1k,…m1, m2,… mL,… n1, n2,… nM,… N1, N2,… NJ.
Вместо такой вполне естественной нумерации принято применять сплошной способ нумерации, заменяя два номера одним массивом .
2) Базисные АО образуют массив:
(f1; f2; f3;… fp;… fq;…fn), "p,qÎ(1,n) или 1<p,q< n.
Номера пробегают значения 1<p,q< n, и нумерация имеет сквозной вид, но номера АО одного атома обычно соседние.
2) Следуя Дираку, любой массив функций должен быть представлен в двух формах (бра- и кет-векторов).
Так массив базисных АО порождает:
(<f1|; <f2|; <f3|;…<fp|;… <fn|) - бра-векторы
(|f1>; |f2>; |f3>;…|fq>;…|fn>) - кет-векторы
3) Представим их максимально кратко, опуская все символы повторяющиеся, но не добавляющие новой информации. К ним относятся даже символы характеристик функций АО. В итоге в роли символов АО вполне достаточны лишь их номера, так что в самом простом виде базисные АО и образуемые из них МО запишем в виде:
Исходные базисные атомные орбитали АО в Бра- и Кет -формах:
<p| |p>, <q| |q>. "p,qÎ(1,n) или 1< p,q < n.
Искомые молекулярные орбитали (МО) в Бра- и Кет -формах:
<i| |i>, <j| |j>. "i,jÎ(1,n) или 1< i,j < n.
Результирующие линейные комбинации ЛКАО это суммы
<i| = <Spcipp|; |i> = |Sqciqq>.
<j| = <Spcjpp|; |j> = |Sqcjqq>.
Уровни МО (ЛКАО)согласно постулату о среднем значении
<i|H|i>/<i|i> = Ei ; или <j|H|j>/<j|j> = Ej .
Цепь простейших преобразований имеет вид
Ei= <Spcipp|H|Sqciqq>/<Spcipp|Sqciqq>;
SpcipSqciq<p|H|q>/SpcipSqciq<p|q>= Ei;
SpcipSqciqHpq=SpcipSqciqEiSpq;
SpcipSqciq(Hpq-EiSpq)=0;
Spcip[Sqciq(Hpq-EiSpq)]=0;
cip¹0 ®
Получилась система уравнений. Совершенно идентичные выражения получаются при замене индекса МО i на индекс j… Вычислению подлежат постоянные коэффициенты смешения базиса в составе МО:
Sqciq(Hpq-EiSpq)=0 ® ciq-?
Здесь каждый индекс меняется в пределах от 1 до n. Перебирая все возможные значения индексов,приходим к система из n линейных однородных уравнений.Обязательное дополнительное условие - нормировка МО:
<Spcipp|Sqciqq>=1 ® SpcipSqciq<p|q>=1 ® SpcipSqciqSpq=1,
т.е. в итоге
SpcipSqciqSpq=1.
СИСТЕМА УРАВНЕНИЙ МО ЛКАО
p=1 ®Sqciq(Hpq-EiSpq)=0
p=2 ®Sqciq(Hpq-EiSpq)=0
p=3 ®Sqciq(Hpq-EiSpq)=0
…………………………………
p=n ®Sqciq(Hpq-EiSpq)=0
SpcipSqciqSpq=1
…………………………………
1 £ p £ n; 1 £ q £ n; 1 £ i £ n
…………………………………
ВЕКОВОЙ ДЕТЕРМИНАНТ
ciq-? ®Det(Hpq-EiSpq)=0 ®Ei-?
ВЕКОВОЕ УРАВНЕНИЕ
…………………………………
an Ein + an-1Ein-1 + an-2Ein-2 +…+ a2 Ei2 + a1 Ei1 + a0 = 0
…………………………………
iÎ(1,2,3,…n) Ei Î (E1 <E2 <E3 …<En) 1-й результат
…………………………………
c
 iq
ciq
ciq
…ciq 2-й
результат
iq
ciq
ciq
…ciq 2-й
результат
ciq ciq ciq …ciq
ciq ciq ciq …ciq = C -матрица
………………..
ciq ciq ciq …ciq
ИНДЕКСЫ ЭЛЕКТРОННОЙ СТРУКТУРЫ:
1) Парциальные заселённости.
2) Полные заселённости.
3) Эффективные -электронные заряды.
4) Порядки -связей.
ЛИТЕРАТУРА
1) F. Hückel, Z. Physik, 70, 204 (1931); Grundzüge der Theorie ungesättiger und aromatisher Verbindungen, Verlag Chemie, Berlin, 1938, pp. 77-85.
2) Дж.Робертс. Расчёты по методу МО. М. МИР. 1963
