
1090
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Московская государственная академия тонкой химической технологии имени М.В. Ломоносова
Кафедра химии и технологии основного органического синтеза
А.К. Фролкова, В.М. Раева, Л.А. Серафимов
КЛАССИФИКАЦИЯ БИНАРНЫХ ЖИДКИХ РАСТВОРОВ В ТЕРМИНАХ ИЗБЫТОЧНЫХ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИЙ
Учебно-методическое пособие
Москва
2010
http://www.mitht.ru/e-library
ББК 24.5
УДК 544.353: 544.355-122
Рецензент:
д.х.н, проф. Флид В.Р. (МИТХТ им. М.В. Ломоносова, кафедра физической химии)
Рекомендовано к изданию кафедрой химии и технологии основного органиче-
ского синтеза МИТХТ (протокол № 12 от 11.05.2010).
План изданий МИТХТ (поз. № ________).
Фролкова А.К., Раева В.М., Серафимов Л.А.
Классификация бинарных жидких растворов в терминах избыточных термодинамических функций. Учебно-методическое пособие. – М.: МИТХТ им.
М.В. Ломоносова, 2010. – 36 с.
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебно-методического пособия.
Рассмотрена термодинамическая классификация бинарных жидких растворов в терминах избыточных термодинамических функций, учитывающая особенности изменения ряда избыточных функций под воздействием температуры, а также в рядах гомологичных систем.
Учебно-методическое пособие предназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология и биотехнология»,
для изучения курса «Теория химико-технологических процессов органического синтеза». Материал издания также может быть полезен для аспирантов и научных сотрудников.
Фролкова А.К., Раева В.М., Серафимов Л.А, 2010
МИТХТ им. М.В. Ломоносова, 2010
2
http://www.mitht.ru/e-library
Содержание
Введение ..…………………………………………………………………….4
1. Термодинамические функции смешения и избыточные
функции………………………………………………………………………...5
2.Основы классификации бинарных растворов……………………..…9
3.Влияние температуры на избыточные термодинамические функции……………………………………………………………………….16
4.Бинарные растворы на плоскости энергетического баланса…….20
5.Прогнозирование поведения бинарных жидких растворов…….. 25
Рекомендуемая литература……………………………………………....32
Условные обозначения…………………………………………………….33
3
http://www.mitht.ru/e-library
Введение
При создании теоретических основ различных массообменных процессов необходимо учитывать многообразие поведения много-
компонентных систем, которое невозможно изучить без базовых знаний о бинарных жидких растворах. Настоящее пособие позволя-
ет с позиций системного подхода освоить основные закономерности изменения избыточных термодинамических функций бинарных жид-
ких смесей, таких как энергия Гиббса, энтальпия, энтропия, тепло-
емкость, и предложить новый подход к классификации бинарных смесей.
Избыточные термодинамические функции растворов являются отражением межмолекулярных взаимодействий любой природы,
сопровождающих процесс образования раствора. Они чувствитель-
ны к комплексообразованию, донорно-акцепторному взаимодейст-
вию, ассоциации и др. По величине избыточной энергии Гиббса можно оценить характер отклонения системы от идеального пове-
дения. Знание закономерностей изменения избыточных функций при варьировании внешних условий (температура, давление) позво-
ляет прогнозировать поведение систем, в том числе и при недостат-
ке экспериментальной информации.
Основу данного пособия составляют результаты многолетних исследований, проводимых на кафедре химии и технологии основ-
ного органического синтеза МИТХТ им. М.В. Ломоносова в области фазовых равновесий и процессов разделения бинарных и много-
компонентных смесей различной природы.
4
http://www.mitht.ru/e-library
1. Термодинамические функции смешения и избыточные функции
Для любого жидкого бинарного раствора справедливо фунда-
ментальное термодинамическое уравнение, связывающее внутрен-
нюю энергию U с другими термодинамическими функциями:
U = T S - Р V + G. |
(1) |
Учитывая, что H = U + Р V, можно записать |
|
H = T S + G. |
(2) |
Функциями смешения фМ в термодинамике называют разно-
сти между значениями термодинамических функций в образованном растворе ( фр) и аддитивными значениями ( ф0), определяемыми из величин для чистых компонентов. Таким образом, для раствора за-
данного состава можно записать: |
|
|
|
|
|
|
|
|
hМ hp (h0x h0x ) |
|
|||||||
1 |
1 |
2 |
2 |
|
|
|
||
T sM T[ sp (s0x |
s0x |
2 |
)] |
(3) |
||||
1 |
1 |
2 |
|
|
|
|
||
gM gp (g0x g0x |
2 |
) |
|
|||||
1 |
1 |
2 |
|
|
|
|
||
или hM T sM gM. |
|
|
|
|
|
(4) |
||
Температура и давление в процессе смешения постоянны. Избы-
точные термодинамические функции отнесены к 1 молю раствора и являются удельными величинами.
Смешение при принятых условиях (Р=const, T=const) является самопроизвольным процессом, поэтому энергия смешения Гиббса является термодинамическим потенциалом и всегда стремится к минимуму. Смешение компонентов с образованием идеальной сме-
си сопровождается только переходом части свободной энергии gид
в связанную энергию T sид, поскольку образование идеального рас-
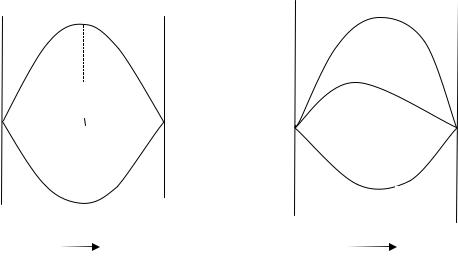
твора происходит при отсутствии теплового эффекта hMид (рис. 1а).
Тогда T sMид+ gMид=0. Поскольку gMид= RT(x1ln х1 + x2lnх2 ) <0,
5
http://www.mitht.ru/e-library
|
|
|
|
(а) |
|
|
|
(б) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
T sМ |
|||||||
|
|
|
|
T sМид |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
фМ |
|
|
|
|
|
|||||||||
М |
ид |
|
|
|
|
|
|
|
|
|||||||||
ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
hМ |
|
||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
1 |
|
0 |
|
|
|
|
|
|
|
|
1 |
||||
|
|
|
|
0.5 |
|
|
|
|
|
|
0.5 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gМид gМ
х1 |
х1 |
Рис. 1. Функции смешения идеального (а) и реального (б) растворов.
то sMид= R (x1lnx1 + x2lnx2)>0.
Экстремальные значения функций gMид и T sMид наблюдают-
ся при эквимолярном составе, т.е. концентрационные зависимости симметричны относительно него. Идеальный раствор – гипотетиче-
ская система, в которой взаимодействия разноименных и одно-
именных молекул одинаковы. Поведение, близкое к идеальному,
обнаруживают растворы, образованные молекулами различного изотопного состава, оптическими изомерами, соседними гомолога-
ми с большой длиной цепи.
При образовании неидеальных растворов энергия смешения Гиббса также отрицательна, а концентрационные зависимости
фM(х)<0 асимметричны (рис. 1б). Однако процесс смешения в этом случае сопровождается изменением энтальпии (теплового эффекта) системы: hМ 0.
Если от функций смешения реального раствора отнять функ-
ции смешения идеального раствора того же состава, то получим из-
быточные функции фЕ:
6
http://www.mitht.ru/e-library
T sE T( sM sидМ )
gE gM gидМ |
, |
(5) |
hE hМ |
|
|
ид |
|
|
для которых справедливо уравнение (2): |
|
|
hE T sE gE . |
|
(6) |
Избыточные термодинамические функции фЕ могут прини-
мать положительные, отрицательные и нулевые значения. В иде-
альном растворе все избыточные термодинамические функции рав-
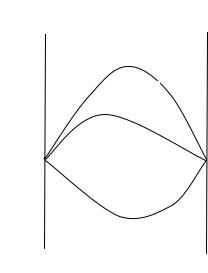
ны нулю. На рис. 2 представлены избыточные термодинамические функции реального раствора конкретного типа.
фЕ
gE
hE
0  1
1
0.5
T sE
х1 
Рис. 2. Избыточные термодинамические функции бинарной смеси.
Энергетический баланс образования бинарного раствора в терминах избыточных термодинамических функций можно записать в общем виде:
– hЕ + T sЕ+ gЕ= 0. |
(7) |
Уравнение (7) является уравнением плоскости в координатах hЕ–
T sЕ– gЕ. Его физический смысл весьма прост. Оно связывает энер-
гию, отданную системой в окружающую среду (– hЕ) или приобре-
7
http://www.mitht.ru/e-library

тенную из окружающей среды (+ hЕ), с энергией Гиббса gЕ (рабо-
тоспособная энергия) и энергией «связанной» T sЕ (неработоспо-
собная энергия). При этом в результате перехода части энергии в окружающую среду сумма T sЕ и gЕ уменьшается; в случае погло-
щения системой энергии сумма T sЕ и gЕ, соответственно, увели-
чивается.
Уравнения (6), (7) энергетического баланса образования би-
нарного раствора используются для вычисления избыточной энтро-
пии, поскольку две другие составляющие определяются экспери-
ментальным путем.
Значения энтальпии смешения бинарных растворов достаточ-
но полно представлены в справочной литературе и оригинальных статьях. Избыточная энергия Гиббса рассчитывается по уравнению:
gЕ = RT (x1 ln 1 + x2 ln 2), (8)
где i - коэффициент активности компонентa i в жидкой фазе:
|
i |
|
yiP i |
(9) |
|
x P0 |
|||||
|
|
|
|||
|
|
|
i i |
|
определяется по экспериментальным данным парожидкостного равновесия (ПЖР) или с помощью различных моделей ПЖР (урав-
нения локальных составов, уравнения состояния, групповые моде-
ли). При идеальном поведении паровой фазы ( i 1) имеем
i yiP . Данное допущение строго справедливо для смесей неас- xiPi0
социированных компонентов в условиях, удаленных от критических.
Величины, входящие в уравнения (6), (7), закономерно меня-
ются при варьировании температуры:
gE (x) |
hE (x) |
E |
|
sE (x) |
|
|
|||
|
|
|
s |
|
T |
|
, |
причем |
(10) |
|
|
|
|
||||||
T |
T |
|
|
T |
|
|
|||
|
( gЕ/ Т)Р,х = |
sE , |
|
(11) |
|||||
8
http://www.mitht.ru/e-library
( gЕ/ (1/Т)Р,х = hE , |
(12) |
hE / T |
cE . |
(13) |
P,x |
P |
|
Выражения (11) – (13) отражают влияние температуры на со-
ответствующие избыточные функции и используются при анализе поведения бинарных растворов.
2. Основы классификации бинарных растворов
Особенности концентрационных и температурных зависимо-
стей термодинамических свойств растворов определяются характе-
ром межмолекулярных взаимодействий (ММВ) между одноименны-
ми и разноименными частицами: природой и интенсивностью сил притяжения, размерами и формой молекул. На протяжении доста-
точно долгого времени предпринимались попытки систематизиро-
вать бинарные жидкие растворы по различным признакам. Это мог-
ли быть: тип молекул (например, полярные или неполярные, с раз-
ветвленной структурой или линейные и т.д.), природа компонентов
(растворы алканов, водные растворы спиртов, растворы спирт – уг-
леводород и т.д.), тип ММВ в растворе (наличие или отсутствие ас-
социации или донорно-акцепторного взаимодействия, гидрофильно-
гидрофобных эффектов) и другие.
Многие исследователи пытались установить взаимосвязь ме-
жду конкретным типом ММВ и видом концентрационных зависимо-
стей избыточных молярных термодинамических функций фЕ(х), ба-
зируясь на переборе сочетаний знаков этих величин. Такой подход в значительной степени способствовал правильной интерпретации экспериментальных данных с точки зрения ММВ, и продвинул идею о целенаправленном накоплении их в соответствующих базах. Дру-
гим направлением в этой области является установление общих за-
кономерностей формирования концентрационных зависимостей из-
9
http://www.mitht.ru/e-library
быточных термодинамических функций с целью прогнозирования поведения бинарных жидких растворов, особенно при недостатке экспериментальной информации, и выявления всего множества би-
нарных растворов на основе классов эквивалентности.
Совокупность полных концентрационных зависимостей избы-
точных термодинамических функций при Р=const, T=const и является признаком отнесения конкретной системы к классу эквивалентности.
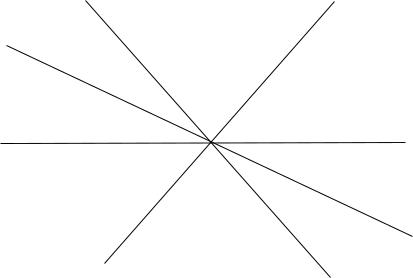
Как уже отмечалось, в трехмерном пространстве уравнение (7) опи-
сывает некоторую плоскость, каждый элемент которой отвечает конкретным растворам (рис. 3). Точка начала координат «0» соот-
ветствует идеальному раствору, в котором все фЕ =0. Эта плос-
кость названа нами плоскостью энергетического баланса (ПЭБ).
|
T sE = 0 |
|
|
|
|
|
|
hE = 0 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
СрЕ =0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ia |
|
|
Iа/II |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
II |
|
|
|
II/III |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Iб |
|
|
Ia/Iб |
|
|
|
|
|
|
|
|
III |
|||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
gE = 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IVб/III |
|
||||
|
Iб/VI |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IVб |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
VI |
|
|
|
|
|
IVa |
|
|||||||
|
|
|
|
|
|
|
|
|
V |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
IVa/IVб |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
VI/V |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
V/IVa |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3. Плоскость энергетического баланса.
Плоскость делится на шесть секторов (обозначаются римскими цифрами), отличающихся набором знаков фЕ(х). В границах секто-
ра каждая функция сохраняет свой знак в диапазоне концентраций от 0 до1 мольн. д. Границы между секторами – пересечение балан-
совой плоскости и плоскостей с нулевым значением одной из функ-
ций: атермические hЕ(х)=0, регулярные T sЕ(х)=0 и компенсирован-
10
http://www.mitht.ru/e-library
