
lection materials Термохимия и Электрохимия
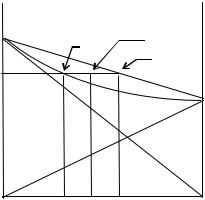
.pdfНа рис.III.3 «К» представлены четыре типичные кривые охлаждения для системы с простой эвтектикой. Каждая кривая строго соответствует принципу непрерывности.
Рассмотрим эти кривые.
Кривая 1. соответствует кристаллизации смеси хb. В точке b1 в системе только расплав ϕ = 1, следовательно, оба параметра могут быть выбраны произвольно. Но поскольку задан состав этой смеси ( хb ), то тем самым определена и температура начала кристаллизации ( t1 ). В интервале температур (от b1 до t1) происходит охлаждение расплава, и на кривой охлаждения наблюдается практически прямолинейный участок. При температуре t1 (точка b2 ) расплав становиться насыщенным по отношению к компоненту В, и он выделяется в виде кристалла. Система становится двухфазной и моновариантной (V=1). Изменение фазового состава системы отражается на кривой охлаждения изломом (точка b2), наклон кривой изменяется. Происходит некоторое замедление охлаждения вследствие выделения теплоты кристаллизации компонента В. По мере увеличения количества твердого В расплав все больше обогащается компонентом А. Изменение состава расплава приводит и к изменению температуры его кристаллизации. Ход этой зависимости описывается кривой ликвидуса от точки b2 до точки Е - на кривой охлаждения это точка b3. Точка Е, называется эвтектической. Она интересна тем, что расплав, отвечающий этой точке (эвтектической), при температуре ее плавления насыщен по отношению к обоим компонентам и из него начинают выделяться, кроме кристаллов B, еще и кристаллы A. В равновесии находятся три фазы - расплав, Aтв и Втв, Система становится нонвариантной, V=2+1-3=0, т.е. ни один из параметров не может изменяться, пока в равновесии находятся три фазы. На кривой охлаждения наблюдается излом (точка b3) и площадка b3-b4.- температура становится постоянной. После исчезновения последней капли жидкости состав твердой массы соответствует составу взятой жидкости ( хb ) и содержит две фазы Aтв и Втв, система становится снова моновариантной, и на кривой наблюдается еще один излом (точка b4) и дальнейшее изменение температуры. На кривой охлаждения это участок ниже точки b4
Кривая 2 отвечает охлаждению смеси состава хa, которая попадает на другую ветвь линии ликвидуса - линии насыщения по отношению к компоненту А. Ход ее аналогичен кривой 1 с той лишь разницей, что в точке a2 начинают выпадать кристаллы компонента А. Студентам предоставляется возможность самостоятельно объяснить ход ее на основе правила фаз и принципа непрерывности.
Кривая 3 соответствует охлаждению смеси эвтектического состава. Участок е1-е2 отвечает бивариантному состоянию системы и отражает охлаждение расплава. При достижении эвтектической температуры
22
http://www.mitht.org/forum/
расплав становится насыщенным по отношению к обоим компонентам, и они начинают одновременно кристаллизоваться. Система становится трехфазной и нонвариантной V=2+1-3=0. На кривой это участок е2-е3, отвечает постоянной температуре. При дальнейшем охлаждении исчезает жидкая фаза, система становится моновариантной и начинается равномерное охлаждение твердой смеси. Особенностью этой кривой охлаждения является то, что состав жидкой фазы постоянно соответствует составу твердой смеси.
Кривая 4 отвечает охлаждению чистого вещества А. Это пример однокомпонентной системы при р=const. Правило фаз в этом случае имеет вид: V=1+1-ϕ. При температуре выше tA компонент А находится в жидком состоянии и V=1+1-1=1, т.е. система моновариантная. Т.к. состав остается постоянным, то может меняться только температура, что и наблюдается на отрезке кривой с- tA. При tA. Начинается кристаллизация компонента А, появляются первые кристаллы, и система становится двухфазной, а V=1+1- 2=0. Нонвариантному состоянию отвечает горизонтальный участок кривой tA-tA1,, что соответствует температурной остановке. Нонвариантное состояние сохраняется до полной кристаллизации компонента. Как только исчезнет последняя капля жидкости, система становится снова моновариантной, и температура начинает понижаться - участок кривой ниже точки tA1
Рассмотренные кривые охлаждения являются основой для построения диаграммы плавкости. Для этого температуры всех фазовых преобразований, отвечающих изломам и площадкам на кривых охлаждения, переносятся на диаграмму «температура-состав» и одноименные точки соединяются линиями. Таким образом все изломы на кривых охлаждения образуют линии ликвидуса, а площадки - линию солидуса, эвтектическую линию. При изучении диаграмм с простой эвтектикой совсем не обязательно иметь смесь эвтектического состава. Определить состав эвтектики можно графическим построением как точку пересечения линии солидуса с двумя ветвями линий ликвидуса.
На рис.III.3 «К» представлены идеальные кривые. Экспериментальные кривые отличаются от идеальных из-за процессов переохлаждения, постоянно меняющейся скорости теплообмена (∆Τ=Твнешн-Тобразца постепенно уменьшается), неравномерности распределения температур по объему образца и других причин. Несоблюдение идеальных условий приводит к тому, что точки излома на кривых охлаждения не столь ярко выражены, а эвтектические площадки имеют наклонный криволинейный ход.
23
http://www.mitht.org/forum/
III.5. МЕТОД ТЕРМИЧЕСКОГО АНАЛИЗА
Метод термического анализа основан на записи кривых охлаждения (нагревания) смесей, содержащих различные соотношения компонентов во всем диапазоне концентраций (0-100%). Обычно кривые охлаждения записываются автоматически. В качестве регистрирующего прибора используется КСП-4 (порядок работы его описан в лабораторной работе «Термохимия»), а в качестве измерительного элемента - термопара.
Термопара состоит из двух проволочек разных металлов, спаянных с двух концов. Если спаи оказываются при разных температурах, то в этой системе возникает ЭДС, пропорциональная разности температур. На этом принципе и строится работа термопар как измерителя температур. Обычно «холодный» спай находится в приборе при постоянной температуре, а «горячий» - помещается в исследуемый образец. При не очень больших интервалах температур (до 5000) зависимость ЭДС от температуры линейная. Для определения температур фазовых переходов в исследуемых образцах требуется градуировочный график, который строится по известным температурам плавления или других фазовых переходов 3-4 или более веществ.
III.6. РАВНОВЕСИЕ ЖИДКИЙ РАСТВОР - ПАР В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ
III.6.1. Общие положения
Раствор - термодинамически устойчивая гомогенная фаза переменного состава - твердая, жидкая или газообразная, состоящая из двух или более компонентов.
Основными параметрами состояния раствора, наряду с давлением и температурой (или другими внешними параметрами), является состав раствора. Состав раствора или его концентрацию чаще всего выражают в молях растворенного вещества в литре раствора (молярная концентрация), в молях растворенного вещества в 1000 г растворителя (моляльная концентрация), в молярных долях или процентах. В термодинамике растворов чаще всего концентрации компонентов выражают через молярные доли.
Молярной долей данного компонента называют отношение количества его вещества к сумме количеств вещества всех компонентов раствора:
xi = |
n i |
. |
(III.12) |
k |
|||
|
∑n i |
|
|
|
i=1 |
|
|
24 |
|
|
|
http://www.mitht.org/forum/
Рассмотрим двухкомпонентные (бинарные) растворы, образованные двумя жидкостями. По своим свойствам они очень разнообразны. Растворимость одного компонента в другом зависит от природы растворителя и растворенного вещества, температуры, давления, присутствия посторонних веществ. Существуют системы с неограниченной растворимостью, ограниченной взаимной растворимостью и с практически полной нерастворимостью жидкостей друг в друге.
Рассмотрим системы, образованные двумя жидкостями с неограниченной растворимостью. Над раствором устанавливается определенное давление насыщенного пара. Паровая фаза также содержит оба компонента. Диаграмма состояния такой системы должна быть построена в трехмерном пространстве, но мы снова воспользуемся сечениями при р=const или Т=const и будем рассматривать плоские диаграммы.
III.6.2. Идеальные растворы.
Первый закон Гиббса-Коновалова
В простейшем случае зависимость парциального давления пара компонента над раствором может быть выражена соотношением
pi = p0i xi , |
(III.13) |
где pi - парциальное давление пара i -го компонента над раствором, pi0-давление пара i-го компонента над чистым компонентом, хi- молярная доля i-го компонента в растворе. Это соотношение, найденное Раулем в 1884 г., носит название закона Рауля. Для бинарного раствора, состоящего из компонентов А и В:
p A = p 0A x A , p B = p0B x B , |
(III.14) |
Растворы, которые подчиняются закону Рауля, называются идеальными или совершенными.
В идеальных растворах силы взаимодействия между молекулами разных компонентов А - В равны силам, действующим между молекулами одного вида А - А и В - В, и данной молекуле совершенно безразлично, какие молекулы находятся в ее ближайшем окружении. Поэтому образование идеальных растворов из компонентов не сопровождается тепловым эффектом, т. е. ∆H=0, и объем раствора равен сумме объемов отдельных компонентов:
Vр-ра=VA+VB и ∆V=0.
Закон Рауля можно записать и в другом виде:
25
http://www.mitht.org/forum/

P0 |
|
−P |
A |
|
|
|
P0 |
−P |
|
|
|
|
A |
|
= x |
B |
, |
B |
B |
= x |
A |
, |
(III.15) |
||
|
|
|
|
|
||||||||
|
P0 |
|
|
|
P0 |
|
|
|||||
|
|
A |
|
|
|
|
|
B |
|
|
|
|
Эти выражения показывают, что относительное понижение
давления насыщенного пара данного компонента над бинарным раствором равно молярной доле второго компонента.
Из закона Рауля (III.13) следует, что давление пара над раствором является линейной функцией концентрации раствора. Эта зависимость может быть изображена графически (рис.III.4).
На оси абсцисс откладывается состав раствора, а на оси ординат - давление насыщенного пара. Точка р0A отвечает давлению пара над чистым компонентом А, точка р0B - давлению пара над чистым компонентом В. Прямая р0A B выражает зависимость парциального
давления пара компонента А от состава раствора. Линия р0B A указывает
парциальное давление пара компонента В в зависимости от состава раствора. Изменение общего давления пара над раствором отображается
прямой p 0A p 0B .
p
p°B
pB=p°B.xжB
B
T = const
p
 pобщ=pA + pB
pобщ=pA + pB
p°А  pA=p°A.xжА
pA=p°A.xжА
A
Рис.III.4. Зависимость давления от состава идеального раствора
Одним из основных свойств растворов является отличие состава раствора от состава равновесного с ним пара. Связь между составом раствора хi и равновесного с ним пара yi выражается уравнением:
26
http://www.mitht.org/forum/
y A = |
|
ax A |
, |
(III.16) |
|
1+(1−a )xA |
|||||
|
|
|
|||
где a=р0А/рB0 . Из (III.15) |
|
следует, что только при |
р0А =рB0 состав |
||
пара одинаков с составом жидкости.
Изучая диаграммы состояния бинарных растворов, Гиббс и Коновалов независимо друг от друга сформулировали два закона, которые справедливы для идеальных и неидеальных систем.
Первый закон Гиббса - Коновалова:
пар по сравнению с жидкостью, находящейся с ним в равновесии, богаче тем компонентом, прибавление которого повышает общее давление пара над системой при данной температуре или понижает температуру кипения смеси при данном давлении.
В соответствии с первым законом Гиббса - Коновалова диаграмма состояния идеальной системы будет иметь вид, представленный на
рис. III.5.
P |
T = const |
|
|
Жидкость |
P |
||
PB0 |
q |
||
m |
|||
|
n |
||
P1 |
|
||
|
|
||
|
|
P0 |
|
|
|
A |
|
|
Пар |
|
B |
y Q x |
A |
Рис.III.5. Диаграмма состояния бинарной системы с идеальными растворами в координатах давление - состав
Линии, характеризующие составы соответствующих фаз, делят диаграмму на три части. Под линией конденсации насыщенного пара рВ0m рА0 находится поле перегретого пара. Над линией кипения рВ0n рА0- поле жидкости. Для этих полей правило фаз имеет вид: V = 2 + 1 - 1 = 2, т.е. однофазные поля отвечают дивариантным равновесиям. Это значит, что в пределах этих полей можно оба параметра - давление и состав - задавать произвольно до границ этих полей. Если повышать давление, двигаясь от
27
http://www.mitht.org/forum/

точки y, то первая капля жидкости появится при давлении p1, что соответствует точке m на линии рВ0m рА0 ,т.е. линия отвечает двухфазному состоянию. На линии рВ0n рА0 тоже сосуществуют две фазы - пар и жидкость. Правило фаз для этих случаев, V = 2 + 1 - 2 = 1, говорит о том, что система становится моновариантной, т.е. только один параметр можно задавать произвольно, а второй однозначно определяется заданным параметром. Если для точки m задано давление, то состав пара определен значением y, и наоборот. Между этими линиями располагается поле гетерогенного равновесия при ϕ = 2, в каждой точке которого пар сосуществует с жидкостью. Для определения составов сосуществующих равновесных фаз через точку, лежащую в этой области, например, точку q, отвечающую смеси состава Q, необходимо провести ноду
В нашем случае на рис.III.5 точка m определяет состав равновесного пара y, n - состав сосуществующей с ним жидкости x. Из приведенного примера видно, что состав равновесного пара обогащен по сравнению с жидкостью компонентом В, добавление которого к смеси повышает общее давление пара над системой, что соответствует первому закону Гиббса - Коновалова.
При исследовании гетерогенных равновесий в качестве переменных чаще принимают температуру и состав, поэтому диаграмма, изображенная на рис.III.5, в координатах температура - состав при р = const, примет вид, показанный на рис.III.6.
t0,C |
P=const |
t0,C |
|
Пар |
|||
|
|
||
|
|
tA |
|
m |
n |
|
tB
Жидкость
B |
y |
x |
A |
Рис.III.6. Диаграмма состояния бинарной системы с идеальными растворами в координатах температура-состав
Точки tA и tB отвечают температурам кипения чистых жидкостей. На этой диаграмме прямая tBntA - линия кипения жидкости, ниже которой находится поле жидкости. Кривая tBmtA отвечает температурам
28
http://www.mitht.org/forum/
образования насыщенного пара, выше этой линии находится поле насыщенного пара. Между этими линиями располагается поле гетерогенного равновесия, где сосуществуют пар и жидкость (ϕ = 2). Составы этих жидкостей и пара можно также определить, проведя ноду через любую точку, лежащую в этой области, до пересечения с линиями кипения жидкости (точка n) и линии конденсации насыщенного пара (точка m). Проекции этих точек на ось состава дадут составы жидкости x и пара y. Рассмотренная диаграмма отвечает идеальному раствору. Однако идеальные растворы встречаются крайне редко. Очень близки к идеальным растворам системы: бензол - толуол, гексан - гептан, H2O-D2O. Большинство реальных растворов не подчиняются закону Рауля.
III.6.3. Неидеальные растворы. Закон Генри
Отклонения от идеальности обусловлены наличием различных типов межмолекулярного взаимодействия, вызванного ван-дер-ваальсовыми силами, силами диполь-дипольного взаимодействия, образованием водородных связей и другими причинами, которые приводят к ассоциации, диссоциации и сольватации. Все эти взаимодействия настолько переплетаются, что предугадать суммарный результат практически невозможно. Однако благодаря преобладанию одной из форм взаимодействия, можно провести классификацию растворов по типу отклонения от закона Рауля.
Если силы взаимодействия между одноименными молекулами меньше сил взаимодействия между разноименными молекулами, FA-A(FB-B)<FA-B, то образование раствора происходит с выделением теплоты (∆H<0) и уменьшением объема (∆V<0). Поэтому теплота парообразования в этом случае оказывается больше, чем при образовании идеального раствора, а давление, следовательно, ниже (рис.III.7). В этом случае говорят об отрицательном отклонении от закона Рауля.
Если силы взаимодействия между одноименными молекулами больше сил взаимодействия между разноименными молекулами: FA-A(FB-B)>FA-B то процесс растворения протекает с поглощением теплоты (∆H>0) и увеличением объема (∆V>0). Это приводит к уменьшению теплоты парообразования, т.е. облегчает испарение, что приводит к увеличению давления пара над реальным раствором по сравнению с идеальным. В этом случае говорят о положительном отклонении от закона Рауля (рис.III.8).
29
http://www.mitht.org/forum/
p |
T=const |
p |
T=const |
|
|
||
|
poA |
|
poA |
poB |
poB |
B |
А |
B |
А |
Рис.III.7. Зависимость давления пара неидеального раствора с отрицательным отклонение от закона Рауля (- - - линии идеального раствора )
РисIII.8. Зависимость давления пара неидеального раствора с положительным отклонением от закона Рауля (- - - линии идеального раствора)
Когда мы говорим о растворах, то подразумеваем, что он образован растворителем - веществом, которое присутствует в большем количестве, и растворенным веществом, присутствующем в меньшем количестве. В системах, образованных двумя смешивающимися в любых соотношениях жидкостями, понятие растворителя и растворенного вещества при соизмеримых концентрациях становится относительным. Определенно о растворителе и растворенном веществе можно говорить в областях, прилегающих к чистым компонентам. В этом случае для растворенного вещества справедлив закон Генри, согласно которому:
pi = ki xi . |
(III.17) |
Давление пара данного компонента |
над раствором |
пропорционально количеству растворенного вещества.
Неидеальные растворы в широкой области концентраций компонентов не подчиняются законам Рауля и Генри. Однако в узких
областях, прилегающих к чистым компонентам, закон Рауля выполняется для растворителя, а для растворенного вещества выполняется закон Генри.
30
http://www.mitht.org/forum/
III.6.4. Азеотропные смеси.
Второй закон Гиббса - Коновалова
Иногда при отклонениях от закона Рауля на кривых давление - состав и температура - состав может появиться максимум или минимум в зависимости от того, положительные или отрицательные отклонения имеют растворы. В экстремальных точках кривая кипения жидкости обязательно соприкасается с кривой конденсации пара. Эта точка отвечает одинаковому составу равновесных жидкости и пара. Смеси, отвечающие экстремальным точкам, называются азеотропными, или нераздельно кипящими, или постоянно кипящими, так как при кипячении таких смесей образуется пар того же состава, что и исходная жидкость.
Второй закон Гиббса - Коновалова относится к системам, образующим максимумы или минимумы на кривых общего давления (для диаграмм в координатах давление - состав) или температур кипения смесей (для диаграмм в координатах температура - состав):
Экстремумы на кривых полного давления пара (или температур кипения) отвечают равновесию между раствором и насыщенным паром, при котором составы обеих фаз одинаковы, при этом максимум на кривой давления отвечает минимуму на кривой температуры и наоборот.
Образование азеотропной смеси (рис.III.9) в системе определяется двумя факторами: 1 - соотношением давлений пара (или соответственно температур кипения) компонентов в чистом состоянии и 2 - степенью отклонения системы от идеальности.
Если давление пара чистых компонентов системы мало отличаются друг от друга, то даже небольшое отклонение от идеальности может привести к образованию азеотропной точки, при этом азеотропная точка лежит обычно в области средних концентраций. При больших различиях в давлении пара компонентов требуется уже большее отклонение от идеальности для появления азеотропной точки, и положение ее смещено в область высоких концентраций одного из компонентов.
Азеотропная смесь для данных компонентов (при р или Т = const) однозначно определяется параметрами системы, что может быть подтверждено правилом фаз. В азеотропной точке имеются в равновесии две фазы - жидкость и пар, составы которых одинаковы Cж=Сп, следовательно, появляется дополнительное уравнение, связывающее концентрации компонентов, которое должно быть учтено при подсчете числа степеней свободы системы, т.е. его следует вычесть. Тогда получим:
V = ( 2 - 1 ) + 1 - 2 = 0. Таким образом, система в азеотропной точке нонвариантна, а это значит, что ни давление, ни состав не могут быть выбраны произвольно.
31
http://www.mitht.org/forum/
