
otvety_OHT
.pdf13. Как повлияет наличие инертных примесей в сырье для обратимых процессов при реализации принципа наилучшего использования сырья, если: процесс протекает с
уменьшением числа молей в системе ум процесс протекает с увеличением числа молей в системе? ув
Ответ: Если процесс идет с уменьшением числа молей, то разбавление инертным компонентом смещает равновесие в сторону реагентов.
1) Если процесс идет с увеличением числа молей, то разбавление инертным компонентом смещает равновесие в сторону продуктов. Применяется ↓ Р в системе (парциальное давление в компонентов смеси) (по принципу Ле-Шателье) для смещения равновесия вправо, при ↓ Р уменьшается скорость химической реакции(по стехиометрии) r ~ P n-1 Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Рэффективное = Р общее(1- Сi)2
Рi = Nj P – закон Дальтона. Эффект разбавления (Nj ↓ ) подобен
снижению давления в системе. Инертный компонент: дешевый, легко отделяется, подавляет побочные реакции, препятствует отложению углерода в органических системах. Для экзотермической реакции является теплоносителем для поддержания температуры.
Наиболее часто применяемый инертный агент – вод. пар.
14. С чем связаны ограничения в выборе объёмной скорости в производстве этанола методом прямой гидратации? Обосновать ответ. Какими соображениями определяется выбор объёмной скорости в циркуляционных процессах. С2 Н4 + Н2О ↔С2Н5ОН, ∆Н<0
Ответ: автотермичность
Процесс сложный, обратимый, экзотермический. При температуре максимальной активности катализатора выход составляет x ≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.и нал.поб.р-ций
Объёмную скорость процесса выбирают так, чтобы обеспечить высокую интенсивность и производительность процесса, но уменьшение степени превращения. В то же время не следует выбирать слишком большие скорости, т. к. в этом случае возможен «проскок» реагента
11
15. С чем связана необходимость рециркуляции продуктов реакции в ХТС? Какие потоки ещё циркулируют в ХТС и для каких целей?
Ответ: В ХТС могут рециркулировать исходные, промежуточные и продукты.
1)рецикл исходных веществ связан с неполнотой их превращения. Причинами могут быть:
Термодинамические ограничения
Малая скорость процесса
Ограниченное время контактирования
Избыток одного из реагентов
2)рецикл продуктов нужен для
снижения интенсивности процесса
увеличения скорости автокаталитических процессов
для регенирирования физ. Св-в (напр., температуры)
3)рецикл промеж. В-в
катализатор
растворители
водооборот
12
16. Зачем нужен избыток кислорода в процессе обжига колчедана? Обосновать способы интенсификации гетерогенных процессов в системах газ твердое в зависимости от природы лимитирующей стадии.
Ответ: увеличение скорости процесса Избыток кислорода нужен для интенсификации процесса, он
протекает во внутренней диффузионной области, лимитирующей стадией является диффузия кислорода из объема потока к поверхности твердой частицы FeS2 через слой образовавшегося оксида. Избыток кислорода увеличивает движущую силу процесса (равновесие смещается вправо). – Снижает внутридифуз. торможение
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
1)лимитирующая стадия внешняя. диффузия (из объема к поверхности частицы)
r = в(сv-cf) , Сv концентрация реагента в потоке для интенсификации процесса:
- повышать Cv
- увеличить коэффициент массоотдачи b;
- увеличить линейную скорость потока, обтекающего твердую частицу (пленку срывает)
- турбулизация потока (аппараты с кипящим слоем ТМ) - увеличить поверхность контакта
2)процесс лимитирует внутренняя диффузия (через слой золы к поверхности ядра)
r = b”(cf-cs) , СF концентрация реагента на поверхности частицы - Увеличить CF
-нужно уменьшить толщину слоя твердых продуктов реакции (R r) измельчить частицы 2) процесс лимитируется химической реакцией.
r = k Cs , k константа скорости реакции, Сs концентрация газообразного реагента на поверхности ядра
Cs = Cv = Cf
Для интенсификации следует:
-повысить концентрацию газообразного реагента Сs
-увеличить константу скорости k. Она зависит от температуры, в соответствии с уравнением Аррениуса с ростом температуры увеличивается по экспоненте.
13
17. Как повлияет повышение температуры процесса на равновесный выход продуктов реакции Rи S при условиях 1) и 2)?
aA + bB =; rR + sS
1) |
H < 0, |
S > 0 |
2) |
H > 0, |
S > 0 |
Ответ: ув в2. ум.в 1 G = H -T S
G = - RTlnKp - связь свободной энергии Гиббса и константы равновесия. Порядок и знак величины ;G позволяют качественно предвидеть положение равновесия реакции. Если ;G << 0, равновесие сдвинуто вправо, выход продукта велик, Кр имеет большое числовое значение. Если ;G>> 0, то равновесие сдвинуто влево, выход продукта мал, Кр
<<1.
- RTlnKp = -H - T S lnKp = S/R - H/RT
продифференцируем уравнение, получим уравнение изобары ВантГоффа:
dlnKp/dT = H/T2
1)экзотермическая реакция, Кр большая положительная величина, реакция термодинамически разрешена при любых температурах. Так как ;H < 0, то dlnKp/dT < 0 и константа равновесия уменьшается с увеличением температуры:
X* - равновесный выход продуктов реакции
То же самое согласно принципу Ле Шателье повышение температуры смещает равновесие в сторону уменьшения воздействия, то есть в сторону обратной эндотермической реакции, константа уменьшается, выход тоже.
2)эндотермическая реакция, протекает с увеличением энтропии, термодинамически разрешена только в области высоких температур. H
>0 , dlnKp/dT > 0, с повышением температуры константа равновесия увеличивается, равновесие смещается в сторону прямой реакции, выход продуктов увеличивается.
Влияние энтропийного фактора: при изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры.
в обоих случаях S > 0, с повышением температуры энтропийный фактор смещает равновесие вправо, увеличивая выход продуктов.
Равновесный выход-это отношение кол-ва полученного продукта в момент равновесия к кол-ву продукта. Полученного по стех.уравнению.
14

18. Энергия активации реакции окисления 2 NO + O2 ↔ 2NO2 (∆H <O) cоставляет -7,5 кДж/моль. Как изменится скорость реакции с увеличением температуры? Какие еще параметры влияют на скорость гомогенной реакции?
Ответ: уменьшится Скорость гомогенной реакции – изменение числа молей в
единицу времени в единице реакционного объема.
r V1 dNd . Скорость данной реакции описывается выражением
dNNO2 |
k CO CNO2 . |
|
d |
||
2 |
||
|
С термодинамической точки зрения в случае обратимой экзотермической реакции повышение температуры будет смещать равновесие в сторону исходных веществ. С увеличением температуры скорость прямой реакции будет уменьшаться.
Зависимость константы скорости k от температуры описывается
уравнением Аррениуса. k A e Ea RT . Величина энергии активации показывает степень влияния температуры на скорость химической реакции. Чем больше величина энергии активации Еа, тем большее влияние на скорость оказывает температура. Для большинства реакций энергия активации положительна и константы скорости таких реакций возрастают по экспоненте с увеличением температуры. Данная реакция относится к числу немногих реакций с отрицательной Еа.
Т.о. с кинетической точки зрения скорость реакции уменьшается с увеличением температуры. Влияние температуры с кинетической и термодинамической точек зрения одинаково. Требуется невысокая температура. Данная реакция является самой медленной стадией в производстве азотной кислоты и проводится при t=10 – 50 ºC.
Параметры, влияющие на скорость гомогенной реакции.
Скорость зависит от константы скорости (изменяется при изменении температуры в соответствии с уравнением Аррениуса) и от движущей силы процесса (степенью удаленности от состояния равновесия). В случае необратимых реакций движущая сила определяется только степенью превращения, т.е. концентрацией реагирующих веществ. В случае обратимых реакций движущая сила реакции может меняться при изменении состояния равновесия. Помимо кинетического фактора в этом случае на скорость реакции влияют факторы, смещающие равновесие. Экзотерм-с увТ,Кс ум,Кув-лот Эндотерм-К и Кс ув Необр.-ув.ск.с ув.Т
15
19. Какой зависимостью описывается изменение скорости процесса с ростом температуры для обратимой экзотермической реакции: А↔В (∆Н<0)? Каким способом реализуют в промышленности подобного типа процессы?
Ответ: Кривая с максимумом Для данной реакции влияние температуры с т. зр. кинетики и
термодинамики различно.
Ea
1.Кинетика. В соотв. с ур. Аррениуса с↑ Т ↑ r. k A e RT
2.Термодинамика. Т.к. реакция – экзотермическая, ↑ Т приводит к смещению равновесия в сторону исходных в-в.
A -степень превращ. комп. А, *A -равновесная степень превр.,
0< A <1,CA CAo 1 A ,CB CAo A
|
|
|
|
|
|
E1 |
|
|
E2 |
|
|
|
|
|
A |
|
|
r k C |
A |
k |
2 |
C |
B |
A e RT |
C |
A |
A e RT |
C |
B |
k C |
Ao |
(1 |
) |
||
|
|||||||||||||||||
1 |
|
|
1 |
|
2 |
|
|
|
* |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
||
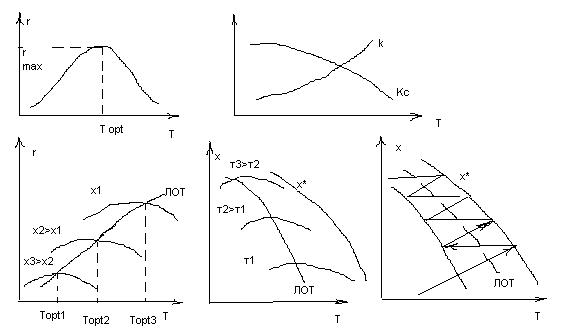
С ↑ Т ↑ k, но равновесие смещается в сторону исх. в-в., т.е. ↓ A *. При
невысоких температурах рост температуры значительно влияет на константу скорости и ↑ k сказывается сильнее, чем уменьшение движущей силы, с ↑ Т r↑. При достаточно высоких темп. – наоборот. Очевидно, что зависимость скорости реакции от темп. описывается кривой с максимумом и существует оптимальная температура, при которой скор. процесса максимальна при определенной степени превращения A . При этом увеличение степени превр. приводит к
уменьшению максимальной скорости (т. к. уменьшается макс. движущая сила ) и кривая зависимости r от Т смещается в сторону более низких температур. Линия, соединяющая максимумы на кривых зависимости r от Т при различных степенях превращения – линия оптимальных температур (ЛОТ). В промышленности обратимые экзотермические процессы ведутся по ЛОТ, что позволяет добиться максимальной скорости процесса в каждый момент времени. Для этого процесс ведут с уменьшением температуры при увеличении времени контактирования. В действительности вести процесс точно по ЛОТ невозможно. Процесс ведут по кривой, максимально приближенной к ЛОТ, поочередно пропуская реакционную смесь через зоны реакционного объема, где происходит некоторый саморазогрев смеси и увеличение конверсии, и охлаждая реакционную смесь (конверсия при этом не меняется), например, путем ввода реагентов с байпасной линии. Примеры обратимых экзотермических процессов в промышленности, проводимых по ЛОТ – синтез аммиака из азота и водорода, окисление диоксида серы до триоксида серы при получении серной кислоты.
16
20. Производство стирола каталитическим дегидрированием этилбензола
C6H5CH2-СН3↔C6H5CH=СН2 + Н2 ( ∆ Н >0 )
осложнено побочными реакциями гидрогенолиза :
C6H5CH2CH3 + Н2↔ C6H6 + C2H6
С6Н5СН2СН3 + Н2 ↔ С6Н5СН3 + СН4 и т.п.
Процесс проводят при температуре 600-6300С и пониженном давлении. Из каких соображений применяют пониженное давление?
Обосновать ответ.
Ответ: для смешения Ле Шателье: Если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
Введение инертного компонента, проведение процесса под вакуумом. В качестве инерта используется водяной пар (дешевый, подавляет побочные реакции, легко отделяется). Реакция эндотермическая, протекает с увеличением числа молей, следовательно, надо уменьшить давление. Эндотермическая реакция является теплоносителем, для поддержания температуры применяется отдувка инертных примесей (С остается постоянной).
17
21. Как повлияет повышение температуры процесса на равновесный выход продуктов реакции в первом и втором случае: аА + вВ ↔ rR + sS
1) Н <0, S < 0;ум 2) Н > 0, S < 0?ув
Обосновать ответ.
Ответ: Ле Шателье: Если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении. Равновесный выход – отношение количества продукта, полученного в состоянии равновесия в условиях процесса, к стехиометрическому количеству этого продукта. Это функция от Т, Р, С реагента.
=NR*/NR стех
1) Реакция экзотермическая, поэтому при увеличении температуры уменьшиться равновесный выход продуктов реакции.
2) Реакция эндотермическая, поэтому при увеличении температуры увеличиться равновесный выход продуктов реакции.
G= H-T S G=-RTlnkP
18
22. Для чего используют катализатор в просессе конверсии метана водяным паром: СН4 + Н2О ↔ СО + 3 Н2 ( Н>0) , сопровождающейся разложением
метана на углерод и водород? Обосновать ответ.
Ответ: повышение селективности и умТ процесса Получение водорода конверсией метана водяным паром
описывается уравнениями:
СН4 + Н2О ↔ СО + 3Н2 сложная, обратимая, эндотермическая, протекающая с увеличением числа
молей. надо сместить равновесие, увеличить скорость реакции, подавить побочные реакции. Данная реакция характеризуется высокой энергией активации. Для ускорения реакции требуется температура ~ 1300ºС, а в этих условиях происходит разложение метана, так как энергия активации реакции разложения метана больше энергии активации прямой реакции. Для понижения энергии активации вводим катализатор, с введением катализатора появляется возможность ввести процесс при более низкой температуре. В данном процессе применяется никелевый катализатор (катализирует окисление) на носителе из оксида алюминия в альфа форме (высокопористый),интервал рабочих температур катализатора 800-900ºС. Р=3атм. Избыток водяного пара.Смешает равновесие и уменьшает образование С на кат.Отношение=2…2,5
23. Как изменится равновесный выход продукта с увеличением концентрации инертных примесей в исходной смеси для реакции:
аА + вВ ↔ rR + sS в случае : 1) a + b > r + s-ум; 2) a + b < r + s?-ув Обосновать ответ.
Ответ: Введение инертного компонента равноценно понижению давления в системе. В первом случае реакция идет с уменьшением числа молей, поэтому снижение давления в системе, согласно принципу Ле Шателье, вызовет смещение равновесия препятствуя этому изменению, то есть равновесие сместится в сторону исходных веществ. Случай два обратный первому случаю, следовательно, равновесие во втором варианте сместится в сторону конечных продуктов.
Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Рэффективное = Р общее(1- Сi)2
Рi = Nj P – закон Дальтона. Эффект разбавления (Nj ↓ ) подобен
снижению давления в системе.
19
24. Получение ацетальдегида на палладиевом катализаторе: C2H4 + 0,5O2 → CH3CHO ( H < 0) сопровождается последовательными побочными реакциями. Что делают для их подавления? Обосновать ответ. Какие еще приемы используют для подавления побочных реакций?
Ответ: Вывести продукт Скорость отдельных реакций и, соответственно, скорость
образования побочных продуктов зависит от условий проведения процесса. На скорость суммарной реакции, селективность процесса и выход ацетальдегида существенно влияет состав катализаторного раствора (содержание PdCl2, CuCl2 и FeCl2), кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
1.Превращение этилена в ацетальдегид при 200С протекает с низкой скоростью. Реакция проходит сравнительно интенсивно при 100-1300С.
2.Для поддержания реакционной массы в жидком состоянии при такой температуре требуется повышенное давление (0,3-1,1 МПа).
Основная реакция протекает с уменьшением числа молей,
следовательно, для смещения равновесия нужно Р, Сисх. реаг.; реакция экзотермическая ( Н<0), значит, t ; выводим продукты из сферы реакции – смещение равновесия и селективности процесса, так как подавится скорость побочной реакции; избыток реагента.
Принцип Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
уравнение изобары Вант-Гоффа: dlnKp/dT = H/T2
20
