
otvety_OHT
.pdf25. При протекании параллельных реакций в газовой фазе А→В (основная) и А→R(побочная) энергия активации основной реакции больше, чем побочной (Е1 > Е2), а порядок реакции по компоненту А n1< n2. Каким образом повысить селективность процесса?Обосновать ответ.
Ответ: увеличить температуру Селектвность – отношение количества исходного
реагента, превратившегося в целевой продукт, к общему количеству прореагировавшего реагента.
Если h1>h2 , при повышении СА селективность будет расти Если h1<h2 , при повышении СА селективность будет падать
Порядок реакции показывает степень влияния конценрации на скорость химю реакции.
Следовательно, для увеличения селективности при h1<h2 необходимо уменьшать СА
При E1>E2 увеличение температуры приводит к увеличению селективности
26. Основные потери в синтезе аммиака N2 + 3H2 ↔ 2NH3 ( H < 0) связаны с отдувкой части рециркулирующей газовой смеси. С какой целью проводится отдувка? От чего зависит объем продувки?
Ответ: вывода инертных примесей Эффективное давление в системе рассчитывается по формуле
Pэф = Pобщ(1-i) , где i-доля инертов в системе. Для поддержания в циркуляционном газе постоянного содержания
инертных газов, не превышающего 10%, проводят продувку газа после первичной конденсации аммиака (после сепаратора). Продувочные газы содержат 8-9% NH3, который выделяется при температуре -25-30 0С в конденсационной колонне и испарителе продувочных газов. Смесь танковых и продувочных газов после выделения аммиака используют как топливный газ. Объем отдувки зависит от объема накопившихся инертов.Кол-во ин.примесей=кол-ву примесей со свежим потоком.
Надо повышать давление по принципу Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
21
27.В исследуемой системе основная (1) и побочная(2) реакции идут в газовой фазе.
A + 2B ↔ R ( ∆ H < 0 ) (1) A + B → S (2)
Константа равновесия основной реакции (1) в широком диапазоне температур изменяется в пределах 102 –10-2. Энергия активации реакции 1 меньше энергии активации реакции 2. Какими приёмами можно сместить равновесие реакции 1 в нужную сторону и повысить селективность процесса?
Ответ: Понизить температуру и повысить давление Основная задача: подавление побочной р-ции, смещение
равновесия основной р-ции в сторону образования продукта. Поскольку основная реакция экзотермична, то снижение температуры приведет к смещению равновесия в сторону образования целевого продукта, но при этом произойдет уменьшение скоростей реакций, интенсивности процесса, что повлечет за собой снижение производительности (кол-во продукта в ед. времени). Если Еа1<Еа2 , то более быстрое уменьшение скорости побочной по сравнению с уменьшением скорости основной р-ции. Энергия активации показывает степень влияния Т на скорость рекции.
Изменение давления влиляет на смещение равновесия нашей основной реакции, и влияет на вторую, надо увеличить давление. Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Введение избытка исходного в-ва В сместит равновесие вправо. Введение избытка А приведет помимо этого к увеличению выхода продукта побочной р-ции.
28.Синтез аммиака проводят с большими объёмными скоростями для:
Ответ: увеличения интенсивности процесса
Объёмную скорость процесса выбирают так, чтобы обеспечить высокую интенсивность и производительность процесса, но уменьшение степени превращения. В то же время не следует выбирать слишком большие скорости, т. к. в этом случае возможен «проскок» реагента и чтобы не нарушить автотермичность. Нужно малое время пребывания, для
предотвращения переразложения N2 и Н2. (синтез NH3). 12 N2 32 H 2 NH3 ,(
H 0 ). В процесс синтеза NH3 – обратимый, несмещенный. Для смещения равновесия уменьшают Т и увеличивают Р. Но даже при таких условиях, т.к. процесс несмещенный, то конверсия NH3 составляет 20%.
Отсюда, раз не можем сместить равновесие, снижаем преб ( для
22
предотвращения обратной реакции), что ведет к малой конверсии => многократной рециркуляции.
29. Почему гетерогенный каталитический процесс, осложненный последовательными превращениями целевого продукта: А→ В→ D ( В – целевой продукт) проводят во внешнедиффузионной области на непористом катализаторе?
Ответ: Потому что, если взять пористый катализатор, то процесс последующего превращения целевого продукта также будет катализироваться, потому что не будет успевать выходить из пор, до следующего превращения. А на беспористом катализаторе у нас будет идти первая реакция и в результате «текучки» не будет успевать идти следующая реакция.Раз во внешнедиф. Обл., значит затруднены процессы массопередачи.
1) лимитирующая стадия внешняя. диффузия (из объема к поверхности частицы)
r = в(сv-cf) , Сv концентрация реагента в потоке для интенсификации процесса:
-повышать Cv
-увеличить коэффициент массоотдачи b;
-увеличить линейную скорость потока, обтекающего твердую частицу (пленку срывает)
-турбулизация потока (аппараты с кипящим слоем ТМ)
-увеличить поверхность контакта
30. Современные производства серной кислоты работают по методу ДК-ДА – двойного контактирования - двойной адсорбции. Что это дает? Обосновать ответ.
Ответ: Большой выход и интенсивность или экол.проблема Процесс состоит в том, что реакционную смесь охлаждают и направляют в промежуточный адсорбер для выделения SO3, в оставшемся реакционном газе соотношение О2 к SO2 существенно повышается, что приводит к смещению равновесия вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат на четвертый слой катализатора,
благодаря чему достигается степень превращения SО2 99-99,9 %,увеличивается интенсивность процесса.
-смещение равновесия
-увеличение выхода процесса
-увеличение скорости процесса
превращение SO2 в SO3 и снижение выбросов SO2 в атмосферу.
23
31.Скорость гетерогенной каталитической реакции лимитирует стадия внутренней диффузии. Какое изменение приведет к наиболее эффективному увеличению интенсивности процесса? Обосновать ответ.
Какие еще способы интенсификации процессов, протекающих во внутридиффузионной области, вы можете предложить?
Ответ: увеличение пористости
r = β(cf-cs) , где β = Dэфф./(R-r) r- скорость внутренней диффузии
β- коэффициент интенсивности внутренней диффузии cf – концентрация на поверхности твердой частицы cs- концентрация на поверхности ядра
Dэфф.- эффективный коэффициент диффузии (зависит от пористости и извилистости) Dэфф.= Dε/τ , где D- молекулярный коэффициент диффузии, ε – пористость, τ – извилистость. Для увеличения β нужно выбирать катализаторы с большой пористостью и малой извилистостью. R- это радиус частицы
Для интенсификации процесса нужно измельчать частицы катализатора(нужно уменьшить толщину слоя твердых продуктов реакции)
(R уменьшается, а β увеличивается, следовательно, скорость увеличивается).
Также можно увеличить концентрацию в потоке, следовательно, увеличится cf .
24
32. Синтез этанола прямой гидратацией этилена C2H4 + H20 = C2H5OH ( H‹0 ) проводится при давлении 8 мПа. Чем вызвана необходимость использовать давление?
Ответ: Для смещения равновесия необходимо повышать давление.
Pобщ.=РC2H4+РH2O+Рин.пр.
РС2Н4 определяется выбранным соотношением между Н2О и С2Н4 = 0,6 (чтобы этанол получался менее разбавленным, а также не было разбавления катализатора Н3РО4) РС2Н4≈4,7 МПа Робщ ≈4,7+2,8+давление на инертные примеси ≈ 8 МПа
Если Робщ>8МПа, то произойдёт конденсация водяного пара, разбавление Н3РО4 – потеря активности катализатора.
Основная реакция протекает с уменьшением числа молей, следовательно, для смещения равновесия нужно Р, Сисх. реаг.; реакция экзотермическая ( Н<0), значит, t ;
Принцип Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
№32(2) В газовой фазе протекает основная (1) и побочная (2) реакции:
А+ В ↔ С + D ( ∆H ‹ 0)
А+ 2В→ S
Порядок реакции по компоненту А для основной реакции больше, чем для побочной (n1 >n2). Каким приемами можно сместить равновесие основной реакции и увеличить селективность процесса?
Ответ: Для смещения основной реакции в сторону целевого продукта, необходимо понижать температуру, понижать давление системы, также при увеличении концентрации реагента А, скорость основной реакции увеличится в большей степени, чем побочной.
Селективность – отношение количества исходного реагента, превратившегося в целевой продукт, к общему количеству прореагировавшего реагента.
Если h1>h2 , при повышении СА селективность будет расти Если h1<h2 , при повышении СА селективность будет падать
Порядок реакции показывает степень влияния конценрации на скорость химю реакции.
25
33. Проведение процесса пиролиза нефтепродуктов сопровождается образованием кокса и требует понижения давления в системе. Каким образом реализуется понижение давления реагентов? Обосновать преимущества использования данного приема.
Ответ. Введение водяного пара Понижение давления реализуется введением в реакционную смесь
инертного компонента, в нашем случае - водяного пара. Pэф. = Pобщ.(1-Ci), где Ci – содержание инерта.
Это технологическое решение имеет несколько преимуществ:
Водяной пар препятствует коксообразованию, а именно газифицирует образующийся на стенках труб кокс.
С+Н2О → СО+Н2 Кроме того, из-за пониженного давления уменьшается доля дальнейших
реакций полимеризации. Водяной пар относительно дешев и легко отделяется конденсацией от продуктов пиролиза.
Введение инерта= понижению давления в системе Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Рi = Nj P – закон Дальтона. Эффект разбавления (Nj ↓ ) подобен снижению давления в системе.
34. Процесс экзотермичен. Реагенты и продукты находятся в газовой фазе. Число молей продуктов больше, чем число молей реагентов. Процесс протекает с возрастанием энтропии. Как сместить равновесие реакции в сторону образования продуктов?
Ответ.
1)Оценка влияния на равновесие температуры. Процесс экзотермичен => ∆H < 0.
Процесс протекает с возрастанием энтропии => ∆S > 0. Исходя из ∆G = ∆H - T∆S,
∆G = - RTLn(Кр);
получим Ln(Кр) = ∆S/R - ∆H/RT. Окончательно, с учетом знаков: Ln(Кр) = ∆S/R + │∆H│/RT, откуда очевидно что с ростом температуры константа скорости прямой реакции уменьшается. Т.е. для смещения равновесия в сторону образования продуктов необходимо понижать температуру.
2)Оценка влияния на равновесие давления.
Т. к. число молей продуктов больше, чем число молей реагентов, то понижение давления, в соответствии с принципом Ле Шателье, сместит равновесия в сторону образования продуктов.
26
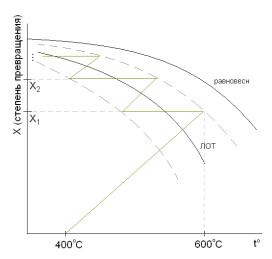
35. Окисление SO2 в SO3: SO2 + 0,5О2 ↔SO3 ( ∆ H < 0 ) – обратимая экзотермическая реакция, которая проводится на ванадиевом катализаторе в интервале температур 400-6000 С. Какой приём применяют для получения большого выхода продукта? Объяснить суть приёма.
Ответ:ЛОТ
У данной реакции большая величина энергии активации , поэтому применяют катализаторы. У применяемых катализаторов рабочая температура 400-600 0С. Так как реакция экзотермическая, то для смещения равновесия вправо следует понижать температуру. Нижний предел ограничен температурой зажигания катализатора: 400 0С. Но при такой температуре очень мала скорость. При
повышении температуры возрастает скорость реакции, но равновесие смещается влево, т.е. равновесная концентрация продукта (SO3) уменьшается (см. линию равновесия). Верхний предел ограничен 600 0С, т.к. при более высоких температурах катализатор теряет активность. Для получения высокой конверсии с требуемой скоростью процесс ведут по линии оптимальных температур (ЛОТ). Суть приёма состоит в следующем. Процесс ведут с уменьшением температуры : сначала реакционная смесь нагревается до температуры зажигания катализатора 400 0С и поступает в первый слой контактного аппарата. В этих условиях велика скорость процесса и быстро достигается конверсия, близкая к равновесной. При этом реакционная смесь разогревается приблизительно до 600 0С. После разогрева до этой температуры реакционная смесь охлаждается. Затем охлаждённая смесь снова поступает уже во второй слой контактного аппарата. После разогрева реакционной смеси до определённой температуры (уже < 600 0С), она поступает в следующий теплообменник. И так далее. В каждом последующем слое контактного аппарата температура понижается по сравнению с предыдущей, при этом уменьшается скорость процесса и увеличивается степень превращения. Таким образом, благодаря высокой температуре вначале процесса мы получаем большую скорость реакции. А постепенно охлаждая реакционную смесь в каждом слое повышаем выход продукта. (в данном случае все слова «конверсия» и «степень превращения» можно заменить на «выход», т.к. процесс простой и селективность = 1).
27
36. В эндотермическом газофазном процессе число молей продуктов меньше, чем число молей реагентов. Реакция характеризуется убылью энтропии. Как сместить равновесие реакции в сторону образования продуктов?
Ответ: Использовать избыто реагентов
Энергия Гиббса равна G H T S. Из условий задачи
получаем: H 0 (эндотермический |
процесс), |
S 0 (энтропия |
уменьшается). Получаем, что G 0 . |
При G 0 |
равновесие реакции |
сдвинуто влево, выход продукта мал. (это почти не реализуемые процессы).
В соответствии с принципом Ле Шателье («Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведённого воздействия, и положение равновесия сместится в том же направлении». Т.е. равновесие смещается в сторону тех условий, которые ослабляют внешнее воздействие.) сместить равновесие в сторону образования продуктов можно следующим образом:
-повысить давление, т.к. число молей продуктов меньше, чем число молей реагентов.
-если есть инертные примеси, понизить их содержание (равносильно повышению давления).
-несмотря на то, что реакция эндотермическая, повышением температуры мы не сместим равновесие в сторону продуктов, т.к. энтропия уменьшается, и повышая температуру, мы лишь увеличим положительное значение энергии Гиббса.
28
37. Какие приемы используют для сокращения потерь энергии в химико-
технологических системах?
Ответ:. подача исходных реагентов в пространство между катализаторной коробкой и стенкой аппарата.
В структуре себестоимости стоимость энергии достигает 60%, а степень использования энергии в ХТС не превышает 30%. Следовательно есть тепловые выбросы. Задача: надо уменьшить расход энергии на единицу выпускаемой продукции и сократить потери в окружающую среду. Для этой цели используются следующие приемы:
1.регенерация теплоты, т.е. подогрев входящих потоков нагретыми продуктами реакции.
Это осуществляется:
1)непосредственный теплообмен,
2)через теплообменную поверхность.
3)При помощи тепловых агентов
2.сокращение тепловых потерь
1)изоляция аппаратов
2)подача исходных реагентов в пространство между катализаторной коробкой и стенкой аппарата
3.принцип противотока
4.организация автотермических процессов, когда количество теплоты, необходимое для нагрева газа до заданной температуры перед входом в реактор, поставляется газом покидающим реакционное пространство
1)регулирование нагрузки на реактор
2)совмещение реакций с разными тепловыми эффектами( получение формальдегида окислительным дегидрированием метанола)
5.энерготехнологические системы: наряду с химическим продуктом производится энергия.
38. В исследуемой системе реакция аА + вВ ↔ сС ( ∆Н > 0 ) идёт в газовой фазе.
∆G0298 = 60 кДж/моль. Что нужно сделать, чтобы сместить равновесие в сторону продукта реакции?
Ответ: реакция не разрешена Возможность протекания реакции позволяет оценить величина
свободной энергии Гиббса ∆G0т. Если ∆G0т>>0, то равновесие смещено в сторону обратной реакции, если ∆G0т=0,то система находится в
равновесии, а если ∆G0т<<0, то смещено в сторону прямой реакции.
∆Gт =-RTlnKp ∆G0т=∆H0т-T∆S0
29
39. Какие приемы применяют для реализации принципа экологической безопасности при производстве азотной кислоты? Какие требования предъявляются к отходам, образующимся в химико-технологических системах?
Ответ: производства азотной кислоты тесно связано с выбрасываемых в атмосферу оксидов азота. Оксиды азота очень опасны. Хвостовые газы производства азотной кислоты содержат после абсорбционных колонн от 0,05 до 0,2% оксидов азота, которые по санитарным требованиям без дополнительной очистки запрещено выбрасывать в атмосферу.
Радикальное решение проблем очистки отходящих газов — каталитическое восстановление оксидов азота горючими газами — водородом, природным газом, оксидом углерода, аммиаком. Условия проведения процесса и тип используемого катализатора определяются видом применяемого газа.
в качестве катализатора используется палладий на носителе На катализаторе протекают следующие реакции:
СН4 + 2N02→ N2 + СО2+H2O
СН4 + 4N0 → 2N2 + Н2O + СО2
применяют также аммиак на алюмованадиевом катализаторе
NН3 + бN0 =5N2 + 6Н2O
Основные требования, применяемые к отходам: 1) должны легко утилизироваться или регенерироваться, 2) должны легко
аккумулироваться природными системами.
30
