
- •Модуль 1 "Модульная единица 3 Белковые вещества" Цели изучения модульной единицы 3
- •Аннотация к лекциям 3, 4
- •Ключевые слова:
- •Лекция 3 Рассматриваемые вопросы
- •Важнейшие функции белков
- •Роль белков в питании. Нормы потребления белков.
- •Проблема белкового дефицита на Земле и пути её преодоления
- •Физиологические функции аминокислот в организме. Специфические пути обмена некоторых аминокислот
- •3, 5, 3', 5' – Тетрайодтиронин (т4) (тироксин)
- •Строение и биологическая роль пептидов
- •Строение и биологическая ценность белков
Физиологические функции аминокислот в организме. Специфические пути обмена некоторых аминокислот
Аминокислоты - органические соединения, содержащие одновременно и аминогруппу, и карбоксильную группу. Этим объясняется и своеобразие физико-химических свойств АК и разнообразие реакций, в которых они участвуют.
В природных соединениях и в живых организмах встречаются, в основном, α-аминокислоты из них только 20входят в состав белков и называются протеиногенными. Другое важнейшее свойство белковых АК связано с оптической активностью – все они являются L-изомерами.
Аминокислоты кроме карбонильной и аминной группировок содержат боковые радикалы, причем именно эти химические группировки определяют большинство свойств той или иной аминокислоты. В общем виде формула аминокислоты может быть представлена следующим образом:

Для одной из протеиногенных аминокислот, а именно для глицина, R представлен атомом водорода, для других аминокислот их боковая цепь имеет более сложное строение.
Кроме 20 наиболее часто встречающихся, имеется ряд минорных аминокислот, являющихся компонентами лишь некоторых белков. Каждая из этих минорных аминокислот представляет собой химическую модификацию основных протеиногенныхаминокислот, например гидроксипролин или гидроксилизин. Вжной биологической ролью аминокислот является способность поддерживать определенные буферные свойства клеточного содержимого, поскольку аминокислоты содержат функциональные группы, ионизирующиеся при различных значениях pH. Важнейшая функциональная роль аминокислот состоит в том, что они являются предшественниками очень многих биомолекул – не только белков и пептидов, но и углеводов, некоторых липидов, гетероциклов, многих молекул биорегуляторов (рис.3.3). Это объясняется тем, что аминокислоты вступают в самые разнообразные реакции.
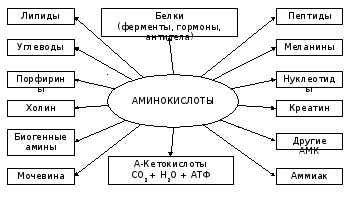
Рис. 3.3 Основные функции аминокислот в организме
В тканях организма легко осуществляется ферментативная окислительно-восстановительная реакция, обусловленная наличием в цистеине реакционноспособной SH-группы:
цистеинредуктаза

Свойство данной аминокислоты окисляться придает ей защитные и радиопротекторные свойства. В присутствии цистеина снижается интенсивность окислительных процессов в липидах и белках, повышается устойчивость организма к ионизирующим излучениям и стабилизируется качество принимаемых лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дусильфидные связи, которые обуславливают биологическую активность или функциональные свойства белков в составе пищи. Особо важную роль дусильфидные связи играют в белках пшеницы, так как они придают клейковине упругие свойства (см. Белки злаков).
Основная физиологическая роль другой серосодержащей аминокислоты – метионина – связана с наличием лабильной метильной группы. Отдавая группу – CH3 через образование S-аденозилметионина, метионин принимает участие в синтезе глицерофосфолипидов.
Серин синтезируется их глицина под действием фермента, содержащего тетрагидрофиолевую кислоту (ТГФК).
Глицин является предшественником пуринового кольца гемв крови и образует так называемые парные соединения. С желудочными кислотами, например холевой кислотой, он образует гликохолевую кислоту, с бензойной кислотой – гиппуровую кислоту:
Бензойная
кислота глицин
Гиппуровая кислота
Гликохолевая кислота принимает участие в процессе усвоения липидов, а в форме гиппуровой кислоты из организма выводится токсичная бензойная кислота.
Три аминокислоты – аргинин, глицин и метионин – участвуют в синтезе креатина – соединения, с помощью которого в мышечной ткани происходит непрерывный ресинтез макроэрга АТФ.
При участии креатина в организме человека и животных образуется креатинофосфат, который по мере необходимости отдает свою фосфатную группу молекулам АДФ, превращаясь в креатинин:
К реатин
+ATP
Креатинфосфат + ADP
реатин
+ATP
Креатинфосфат + ADP
креатинфосфат
креатинин
Креатин и циклический креатинин входят в состав мясного экстракта, их соотношение зависит от pH среды и температуры. Так, при нагревании мяса в кислой среде в экстракте преобладает креатинин.
Реакции декарбоксилирования аминокислот приводят к образованию биогенных аминов. Это биологически активные соединения, которые выполняют различные регуляторные функции. Примером могут быть биогенные амины, образующиеся из тирозина, триптофана, глутаминовой кислоты или гистидина. Так, гистамин известен своим участием в различных аллергических реакциях, а производные тирамина гидроксилируются и превращаются в ряд соединений, называемых катехоламинами (ДОФА, норадреналин, адреналин), которые известны как медиаторы возбуждающего действия в нервной системе.
Ниже приведены реакции образования катехоламинов из тирозина.

тирозин
ДОФА
дофамин норадреналин
адреналин
Катехоламины обладают разносторонним физиологическим действием, например адреналин усиливает работу сердечной мышцы, снижает кровяное давление, регулирует углеводный обмен.
Другой пример образования биогенных аминов и их производных приведен на схеме, показывающей реакции метаболизма триптофана (рис. 3.4). Биогенные амины, образующиеся из триптофана, называют индоламинами, они оказывают тормозное влияние на многие физиологические процессы (например, у животных, впадающих в спячку, повышено содержание серотонина в крови), они влияют на поведение при психических заболеваниях или являются галлюциногенами (например, N, N-диметилсеротонин).
Производное триптофана – N-ацетил-5-метокситриптамин – это гормон щитовидной железы (эпифиза), влияющий на поведение.
5-гидрокситриптофан
гидроксилирование
триптофан
5-гидрокситриптамин
(серотонин)
триптамин
Из тирозина и триптофана, содержащихся в пище, при участии микробных ферментов в кишечнике образуются ядовитые продукты – крезол, фенол, скатол, индол, обезвреживание которых происходит в печени путем связывания с серной или глюкуроновой кислотой с образованием нетоксичных (парных) кислот, например фенолсерной кислоты.
Н
норадреналин
Фундаментальную роль в обмене веществ живых организмов играют глутаминовая и аспарагиновая кислоты. Они участвуют в процессах расщепления, синтеза и переноса, часто в форме амидов.
Глутамин, например, является основной формой переноса аммиака в крови человека и вместе с аспарагиновой кислотой служит предшественником пиримидинового кольца нуклеотидов. Азот 1 происходит из аспарагиновой кислоты, азот 3 – из глутамина, углерод 4, 5, 6 кольцу отдает аспарагиновая кислота, а углерод 2 происходит от CO2. Предварительно молекула CO2 и амидная группа глутамина образуют карбамоилфосфат:


Реакции декарбоксилирования глутаминовой кислоты с образованием γ-аминомасляной кислоты(ГАМК), относящейся к группе медиаторов, отводится важная роль в обмене веществ мозга и нервной ткани.
ГАМК – тормозной нейромедиатор, влияющий на передачу импульсов в нервной системе, при этом глутаминовая кислота и ГАМК действуют как антагонисты: первая активирует, а ГАМК ингибирует передачу нервных импульсов.
Цекарбоксилирование аспаргиновой кислоты обеспечивает синтез β-аланина, являющегося составной частью биологически активных соединений – КоА и АПБ, а декарбоксилирование лизина и орнитина под влиянием ферментов кишечной микрофлоры приводит к образованию ядовитых диаминов – кадаверина и путресцина. В здоровом организме оба амина полностью обезвреживаются в слизистой оболочке кишечника.
Декарбоксилирование гистидина приводит к гистамину, который образуется в организме в ответ на действие аллергенов и вызывает аллергическую реакцию, вследствие чего лекарственные средства против аллергии получили название антигистаминных препаратов. Вследствие того, что антигистаминные препараты тормозят декарбоксилирование гистидина, аллергические реакции ослабевают. Кроме того, гистамин образуется также при болевых реакциях.
Реакция гидроксилирования тирозина является ключевой при образовании гормонов щитовидной железы (трииодотиронина, тироксина) (рис. 3.5).
3,
3',
5' – трийодтиронин (Т3)
