
Modul_No2_ZanjatieNo2_Aldegidy_i_ketony
.pdf
Модуль II
Тема занятия №2: “Биологически важные альдегиды и кетоны”
Цель занятия: изучение электронного, пространственного строения и химических свойств биологически важных альдегидов и кетонов.
Студент должен знать:
-строение, классификацию альдегидов и кетонов, их номенклатуру;
-химические свойства альдегидов и кетонов.
Студент должен уметь:
-различать альдегиды и кетоны по их химическим свойствам;
-делать качественные реакции на эти соединения.
Многие биологически активные соединения (белки, углеводы, гормоны и пр.) содержат в своем составе >С=О – карбонильную группу.
Органические соединения, в молекулах которых имеется карбонильная группа, наз-ся карбонильными, или оксосоединениями. Такие соединения
R |
|
C |
O |
R |
|
C |
|
R' |
||
|
H и кетоны |
|
|
|||||||
|
|
|
|
|
|
|
|
|||
делятся, на альдегиды |
|
|
|
|
|
C . |
||||
Общая формула алифатических альдегидов и кетонов СnH2nO. Альдегиды и кетоны с одинаковым числом атомов С можно рассматривать как метамеры (изомеры) – соединения, содержащие одну и ту же функциональную группу, но имеющие различное строение. Например, С3Н6О
|
|
|
|
|
O |
CH |
|
|
C |
|
CH3 |
||
|
|
|
|
|
|
3 |
|
|
|||||
CH3 |
CH2 |
C |
H |
||||||||||
|
|
||||||||||||
|
|
|
C |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
Р-ции альдегидов и кетонов весьма схожи, что позволяет рассматривать их вместе.

Номенклатура
Альдегиды
1)Тривальная номенклатура использует название кислот, образующихся при окислении альдегидов, + слово «альдегид»;
2)МН использует окончание – АЛЬ
O |
|
H C |
Муравьиный альдегид, метанАЛЬ, формальдегид |
H |
|
O |
|
CH3 |
C |
Уксусный альдегид, этанАЛЬ, ацетальдегид |
|
H |
Кетоны
1)Рациональная номенклатура – название радикалов + слово «кетон»;
2)МН использует окончание –ОН с цифрой, указывающей местонахождение кетогруппы
СН3–СН2 |
− C−СН3 |
Метилэтилкетон, бутанон-2 |
|
|| |
|
|
O |
|
Тривиальная номенклатура используется редко.
Изомерия
Для альдегидов характерна изомерия цепи, для кетонов – цепи и положения карбонильной группы.
Физические свойства
Низшие альдегиды имеют резкий запах, растворимы в воде, высшие альдегиды имеют приятный запах (парфюмерия), не растворимы в воде, но растворимы в органических растворителях.
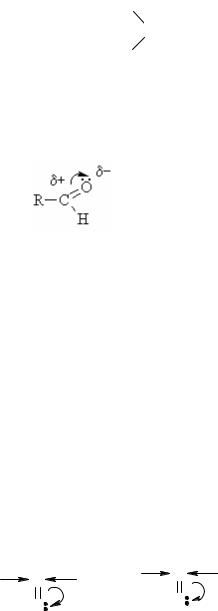
Строение
δ+ |
|
δ− |
|
|
|
|
|
O |
|
C |
|
|
\ C = O поляризована вследствии |
|
|
|
|||
|
|
|||
|
|
|
Двойная связь |
|
|
|
|
|
/ |
различной ЭО атомов С и О и смещена к О. Поэтому атом С карбонильной группы всегда имеет избыточный δ+ заряд, а О – δ-:
Характерными р-циями для карбонильных соединений являются р-ции нуклеофильного присоединения АN. При этом, чем больше величина δ+ на атоме С группы /\ C = O , тем выше реакционная способность соединения в
реакциях АN. В кетонах δ+ заряд меньше (за счет +I), чем в альдегидах, следовательно, альдегиды более реакционноспособны.
|
δ+ |
|
R |
δ'+ |
H |
R |
C |
R |
C |
||
|
δ− O |
|
|
δ'− O |
δ'+>>δ+ |
(Для увеличения δ+ заряда р-ции часто проводят в слабокислой среде).
Смещение π-электронной плотности в группе /\ C = O вызывает, в свою
очередь, смещение электронной плотности у соседних С – С связей, что

увеличивает подвижность и реакционную способность атомов Н в α- положении атома С.
Химические свойства
Типы химических р-ций для альдегидов и кетонов:
V |
|
IV |
O } I |
|
|
II AN, S |
|||
R |
|
CH |
|
|
|
2 |
H } III, окисление |
||
S |
|
SE |
||
|
I. Р-ции АN (присоединения): Н2, СН3OH, НСN, NaHSO3. |
|||
|
II. Р-ции S(AN+E) (присоединения и отщепления) H2N-NH2, NH2OH, |
|||
NH2NH-C6H5 PC15. |
||||
|
III. Р-ции окисления [Ag2O, Cu(OH)2] (Правило Попова – для кетонов). |
|||
|
|
I. |
Р-ции по радикалу (р-ции с участием атома Н в α-положении, р- |
|
|
|
|
|
ции дисмутации и полимеризации). |
I. Р-ции АN
Общим для этих р-ций является наличие атома Н в реагенте. Если обозначить строение этих реагентов как Н – Х, тогда общую схему р-ции нуклеофильного присоединения можно записать так:
C |
|
O + H+ |
X |
|
|
|
C |
|
O |
|
+ H+ |
|
C |
|
OH |
||
|
|
|
|
|
|||||||||||||
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
H |
|
|
||
Реакционная способность карбонильных соединений в р-циях АN зависит: 1) от величины «+» заряда на атоме С оксогруппы; 2) пространственной доступности; 3) кислотности среды.

1. |
Взаимодействие со спиртами. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полуацетальный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидроксил |
|
|
O |
+ |
|
|
|
|
+ |
OH |
R |
|
|
O+ |
H |
R |
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R |
|
C |
+ H |
R |
|
C |
|
+ ROH |
R |
|
C |
OH |
|
R |
|
C OH |
||||||
|
|
|
|
+ |
|
|||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
- H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полуацеталь |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Полуацетали – это соединения, содержащие при одном атоме С гидроксильную (–ОН) и алкоксильную (–ОR) группы.
При избытке спирта образуется ацетали. Ацетали – это соединения, содержащие при одном атоме С две алкоксильных (–ОR) группы.
|
|
OH |
|
|
H |
|
|
O+ |
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R |
|
|
OR |
+ |
H+ |
|
R |
|
|
|
OR |
R |
|
C+ |
OR |
|||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
H |
|||||||||
|
|
C+ |
OR |
|
HOR |
|
H |
|
|
O |
|
|
R |
|
|
|
OR |
|||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R |
|
+ |
|
R |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
C |
|
|
|
OR |
|
R |
|
CH |
|||||||||
|
|
|
|
|
|
+ |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
H |
|
|
|
|
H |
|
|
|
- H |
|
|
OR |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ацеталь |
||
2.Р-ция с НСN протекает обычно в щелочной среде, т.к. НСN – слабая к-та и атом С не имеет неподеленной электронной пары. При действии щелочи образуется сильный нуклеофил – анион СN–.
|
δ+ |
|
δ− |
|
|
|
CN |
|
|
|
CN |
|
|
|
|
CN |
|||||||||||
R |
|
O + CN - |
|
R |
|
|
|
|
|
|
+ Na+ |
|
R |
|
|
|
|
|
+HOH |
|
|
|
|
|
|
||
|
|
|
|
C |
|
O |
|
R |
C |
OH |
|||||||||||||||||
|
|
|
|
|
|
|
|
C |
|
ONa |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
-NaOH |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|||
II. Р-ции замещения кислорода в группе /\ C = O (АN+Е)
Реагентами в этом случае могут быть соединения аминного типа, содержащие группу –NН2. В этих р-циях аналогично рассмотренному выше идет р-ция АN, а затем происходит отщепление молекулы воды с
образованием двойной связи \ C = N - : |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
/ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ− |
+ |
|
|
|
|
|
NHOH |
|
|
|
|
|
|
|
||||
|
|
δ+ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
O + |
H N |
|
OH |
|
R |
|
|
|
|
|
R |
|
C |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
C |
|
OH |
-H2O |
|
|
NOH |
|||||||||
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Оксим
К аминным реагентам относятся: Н2N–ОН гидроксиламин образует оксим, Н2N–NН2 гидразин образует гидразон, Н2N–NН–С6Н5 фенилгидразин образует фенилгидразон, Н2N–R амин образует имин (основание Шиффа).
В общем виде:
R |
|
C O+ H2N |
|
X |
|
R |
|
C N |
|
X |
|
|
|
|
|
||||||
|
|
|||||||||
|
|
-H2O |
|
|||||||
|
|
H |
|
|
H |
|||||
По такому же принципу протекает р-ция с РС15 и р-ция с двумя молекулами спирта.
III.Р-ции окисления

Альдегиды легко окисляются даже слабыми окислителями такими, как Аg2О и Сu(ОН)2. Эти р-ции используются как качественные р-ции. Кроме этого качественной р-цией на альдегиды является р-ция с фуксинсернистой к-той:
|
|
C O |
|
фуксинсернистая кислота |
|
|
|
|
|
|
Сине-фиолетовое окрашивание |
|||||
R |
|
+ |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кетоны |
окисляются только сильными |
|
окислителями. При этом |
|||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|||||||
|
|
|
1 |
|
|
O |
1) HCOOH |
|||||||||
|
|
|
|
H3C |
|
CH2 |
|
|
C |
|
|
|
CH3 |
|||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
CH3CH2COOH, |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
образуются 2 – 4 карбоновые к-ты: |
|
O |
|
|
|
2) 2CH3COOH |
||||||||||
|
|
|
|
|
|
|
|
|
||||||||
IV. Наличие в молекуле альдегидов и кетонов ЭА группы /\ C =O
приводит к повышению реакционной способности атомов Н в α-положении
по отношению к группе /\ C = O . Они довольно легко замещаются при действии некоторых реагентов.
1) Замещение на галоген:
α |
O |
hν |
|
|
|
O |
|||
CH |
|
C |
+ Cl2 |
|
CH |
|
C |
||
3 |
-HCl |
|
2 |
||||||
|
|||||||||
|
|
|
H |
|
|
|
H |
||
|
|
|
Cl |
||||||
|
|
|
|
||||||
2) Галоформная р-ция
В щелочной среде при действии галогенов (I2, Cl2) альдегиды и кетоны, содержащие R = СН3, образуют йодоформ или хлороформ. Р-ция образования йодоформа используется в клинике для обнаружения ацетона в моче:
CH3 |
C |
|
|
CH3 + 3 J2 |
|
|
|
|
|
CJ3 |
C |
|
CH3 |
|
||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
-3HJ |
|
|
|
|
|
|
|
||||||
|
O |
O |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Ацетон |
|
|
|
Трийодацетон |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
CJ3 +HONa |
|
t |
|
|
|
+ CH |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
CH3 |
C |
|
|
|
|
|
|
|
CHJ |
3 |
|
|
|
C |
||||||||
|
|
|
|
|
|
|
|
|
3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
O |
|
|
|
|
Йодоформ |
ONa |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(желтый) Ацетат натрия |
|||||||||
|
|
|
|
|
|
|
|
|
характерный запах |
|
||||||||||||
3) Высокой подвижностью атомов Н в α-положении объясняется также способность альдегиов вступать в р-цию альдольной конденсации:
|
|
|
δ− |
|
|
|
OH- |
OH |
O |
|
|
|
|
|
|
|
|||
R |
|
C O + |
CH2 |
CHO |
|||||
|
|
CH3 C CH2 |
C |
||||||
|
|
||||||||
|
|
H |
δ+ |
H |
H |
||||
|
|
|
|
|
H |
Альдоль (3-гидроксибутаналь) |
|||
Впервые наблюдали эту р-цию А. Бородин (композитор, врач по образованию, 1872) и Ш. Вюрц.
Этим путем образуется в организме лимонная к-та, углеводы.
Механизм р-ции:
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH- |
|
|
CH2-CHO |
|
|
|
|
|
|
|
|
|||||||||
CH2 |
C |
+ |
- H2O |
|
|
|
|
|
|
|
|
|||||||||||||
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
δ− |
|
|
|
|
|
CH2CHO |
+ |
|
|
|
CH2CHO |
||||||||||
|
δ+ |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
O + CH2-CHO |
|
|
+ H O H |
||||||||||||||||||||
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
C |
|
OH + OH- |
|||||||||
|
C |
|
C |
|
O |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
4) Если альдегид не имеет атома Н у α-углеродного атома, то он в такую р-цию не вступает, но легко вступает в р-цию дисмутации (окисления
– восстановления). Эта р-ция наз-ся еще р-цией диспропорционирования, или р-цией Канницарро-Тищенко:

|
|
|
C O |
|
|
HOH + H |
|
C O |
CH3OH + H-COOH |
||
H |
|
|
+ |
|
|||||||
|
|
||||||||||
|
|
|
|||||||||
|
|
|
|
H |
|
|
|
|
|
H |
Метанол Метановая к-та |
|
|
|
|
|
|
||||||
Формальдегид |
|
|
|||||||||
|
|
|
|
O |
|
C6H5-CH2OH + C6H5-COOH |
|||||
|
|
|
|
|
2 |
|
|
||||
C6H5 |
|
C |
HOH |
|
|||||||
|
+ |
|
|||||||||
|
|
|
|
H |
|
|
|
Бензиловый спирт Бензойная к-та |
|||
|
|
|
|
|
|
||||||
Бензальдегид |
|
||||||||||
5) В связи с увеличением подвижности атомов Н в α-положении по отношению к карбонильной группе для кетонов характерно также явление кето-енольной таутомерии. Таутомерия – это вид изомерии, происходящей путем перемещения атома Н в молекуле. Образующиеся изомеры находятся в динамическом равновесии и переходят друг в друга за счет внутримолекулярного перемещения атома Н. Этот вид изомерии наз-ся также
прототропной:
|
|
R' |
δ+ |
|
|
|
|
|
R' |
|||||||||||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
C |
|
|
C |
|
R'' |
|
|
|
R |
|
C |
|
C |
|
R'' |
||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
O δ− |
OH |
||||||||||||||||||||||
|
H |
|
|
δ+ |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|||||||||||||||||||||||
оксо-(кето)-форма |
|
|
|
окси-(енол)-форма |
||||||||||||||||||||
Обычно процент енольной формы невелик и соответсвует 10-5 – 10-6%. Увеличение цепи сопряжения, введение ЭА заместителей способствует увеличению содержания енольной формы. Так, в ацетилацетоне енольной формы больше, чем в самом ацетоне:
H3C C |
CH2 C |
CH3 |
H3C C CH C |
CH3 |
|
O |
O |
|
OH |
O |
|
Сопряжения нет! |
Сопряжение есть! |
||||
Замещение Н в енольном гидроксиле на алкилрадикал или ацил- – исключает превращение енола в кето-форму, т.к. не остается подвижного атома
водорода. На содержание енола оказывает влияние также температура, природа растворителя и др. факторы.
6) Р-ции, характерные для углеводородных радикалов R, – SR, для непредельных R – АЕ, для ароматических R – SЕ.
CHO |
CHO |
hν
+ Br2 -HBr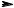
Br
Бензалбдегид 3-Бромбензальдегид
δ'+ |
|
|
O δ− |
+ - |
|
|
|
|
|
|
|
C δ+ + |
|
|
CH2 |
CH2 |
CHO |
||
CH2 |
CH |
|
HBr |
|
|
||||
|
|
||||||||
|
|
||||||||
|
δ'− |
|
H |
|
|
Br |
|||
Акролеин |
|
|
|||||||
|
|
3-Бромпропаналь |
|||||||
Присоединение НВr происходит против правила Марковникова.
Механизм:
1) образование π-комплекса
CH2 CH CHO
BrH+
2) образование σ-комплекса |
+ |
|
|
|
|
|
|
|
CH |
|
|
CH |
|
CHO |
|
|
2 |
|
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
H |
|||
