
1. Химические связи в органических соединениях
В состав большинства органических соединений входит всего лишь несколько основных элементов: углерод, водород, азот, кислород, сера и значительно реже другие элементы. Таким образом, все многообразие органических соединений определяется, с одной стороны, их качественным и количественным составом, а с другой – порядком и характером связей между атомами.
1.1 Электроотрицательность элементов
Электроотрицательность атома – это его способность притягивать элементы. Значения электроотрицательности не имею значимости констант, а показывают лишь относительную способность атомов притягивать электроны сильнее или слабее при образовании с другими атомами.
Атомы, расположенные в ряду электроотрицательности перед углеродом и имеющие значение электроотрицательности меньше чем 2,5, повышают электронную плотность на атоме углерода при образовании связи с ним. Наоборот, атомы, значение электроотрицательности которых превышает 2,5, понижают электронную плотность на атоме углерода при образовании связи.
1.2 Ионная связь
Электронная конфигурация для любого атома может образовываться двумя различными способами. Один из них – перенос электронов: атомы одного элемента отдают электроны, которые переходят к атомам другого элемента. В данном случае между этими атомами образуется так называемая ионная (электровалентная, гетерополярная) связь:
![]()
Атом, отдавший электроны, превращается в положительный ион (катион); атом, принявший электрон, - в отрицательный ион (анион).
Отличительными чертами ионных соединений являются мгновенность протекания реакций, диссоциация и сольватация ионов в водных растворах, высокие температуры плавления и кипения, растворимость в полярныхе растворителях, электрическая проводимость растворов и расплавов.
Гетерополярная связь возникает между атомами, сильно отличающимися по электроотрицательности.
1.3 Ковалентная связь
При взаимодействии атомов, равных или близких по электроотрицательности, переноса электронов не происходит. Образование электронной конфигурации для таких атомов происходит вследствие обобщения двух, четырех или шести электронов взаимодействующими атомами. Каждая из обобщенных пар электронов образует одну ковалентную (гомеополярную) связь:
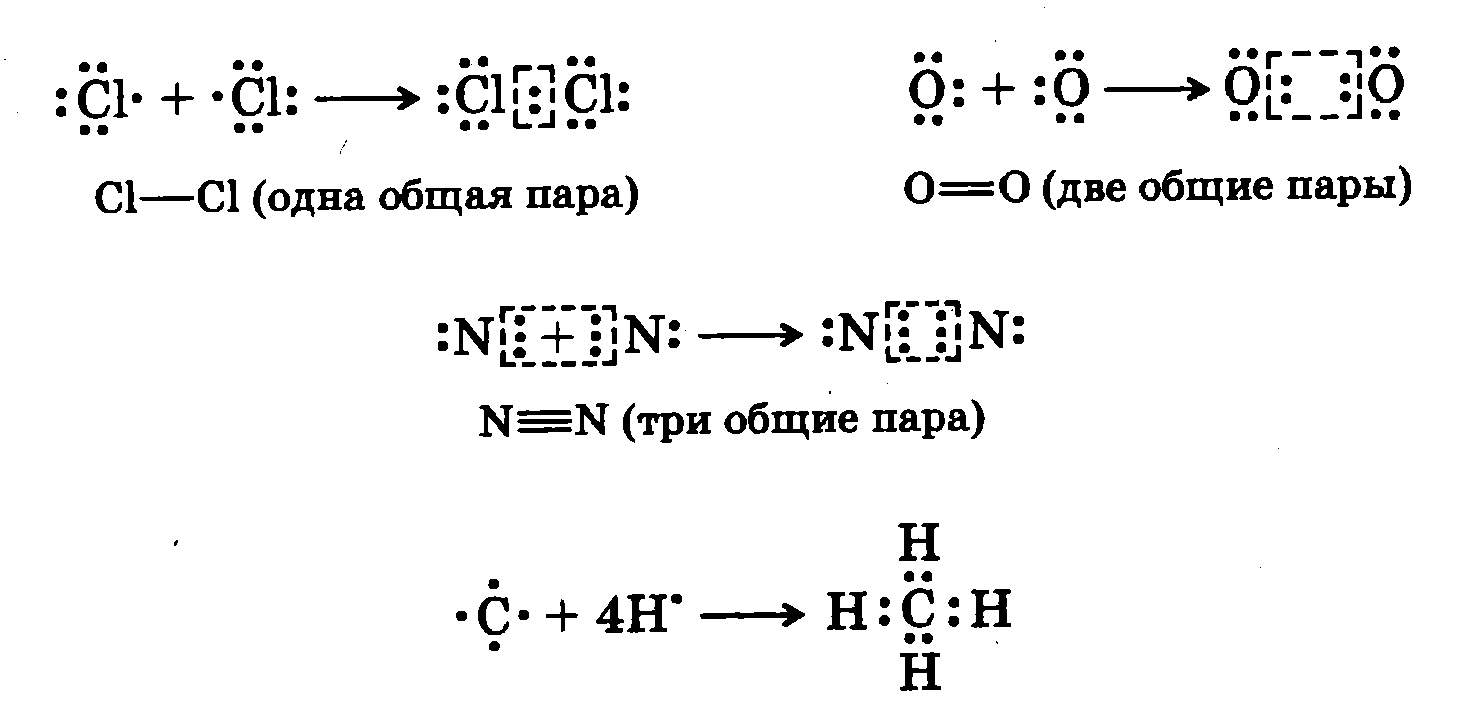
Важнейшими физическими параметрами ковалентной связи являются те, которые характеризуют их симметрию, размеры, электрические и термохимические свойства.
Длина связи – это равновесное расстояние между центрами ядер и оно зависит от того, с какими другими атомами они связаны. Так, длина связи С-С в зависимости от окружения изменяется в пределах 0,154 – 0,14 нм.
Валентные углы – углы между линиями, соединяющими связываемые атомы. Знание длины связей и валентных углов необходимо для построения правильной пространственной модели, представления о распределении электронной плотности и используется при квантово-химических расчетах.
Энергия разрыва химической связи – это энергия, затрачиваемая на разрыв этой связи или выделяющаяся при ее образовании в расчете на моль частиц. В случае молекул, содержащих две или более одинаковых связи, различают энергию разрыва одной из этих связей или среднюю энергию разрыва этих связей. Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль, слабой – если ее энергия меньше 100 кДж/моль. Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считается, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие. Прочность связи обычно уменьшается с увеличением ее длины.
Полярность химических связей – характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Знание полярности связи необходимо для суждения о распределении электронной плотности в молекуле, следовательно, о характере ее реакционной способности.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
1.4 Разрыв связей
Разрыв ковалентной связи между двумя атомами может происходить по-разному:
![]()
![]()
В случае а каждый атом отделяется с одним электроном, что приводит к образованию частиц, называемых радикалами и обладающих высокой реакционной способностью вследствие наличия неспаренного электрона; такой разрыв называют гомолитическим расщеплением связи. В случаях б и в один атом может удерживать оба электрона, оставляя другой атом без электронов, в результате чего возникают отрицательный и положительный ионы соответственно. Если атомы R и Х неидентичны, расщепление может идти по одному из таких путей в зависимости от того, какой атом – R или Х – удерживает пару электронов. Такого рода разрывы носят название гетеролитического расщепления и приводят к образованию ионной пары.
