
Процессы окисления
1 Прямое окисление этилена
Оксиды олефинов используются при промышленном производстве поверхностно-активных веществ, пластификаторов, антифризов и полиуретанов. В промышленном масштабе освоено производство оксидов этилена и пропилена.
Структура современного потребления оксида этилена и этиленгликоля, производимого на его основе, представлена в таблице 1.
Таблица 1 Структура потребления оксида этилена и этиленгликоля
|
Оксид этилена |
Этиленгликоль |
|
Моноэтилегликоль ~50-60% Этоксилаты Ди- и триэтиленгликоли Этаноланины Гликолиевые эфиры Полиолы Полиэтиленгликоли |
Полиэфирные волокна Антифиризы Упаковочный материал на основе полиэтилентерефталата Полиэфирная пленка |
1.1 Теоретические основы процесса окисления этилена кислородом
Первоначально этиленоксид получали хлорным методом через этиленхлоргидрин:
C
 H2=CH2+CI2+H2O
CICH2-CH2OH
CH2-CH2+HCI
H2=CH2+CI2+H2O
CICH2-CH2OH
CH2-CH2+HCI

 -HCI
+Ca(OH)2
O
-HCI
+Ca(OH)2
O
Этот метод связан с большим расходом хлора и щелочи, а также с образованием отходов солей и большим количеством сточных вод и поэтому полностью вытеснен другим способом, состоящим в прямом окислении (эпоксидировании) этилена.
Реакция
![]()
![]()
![]()
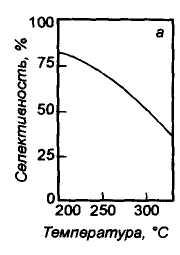 Реакция
полного окисления этилена имеет более
высокую энергию активации,
поэтому при постоянной степени конверсии
этилена селективность падает с повышением
температуры (рис. 1)
Реакция
полного окисления этилена имеет более
высокую энергию активации,
поэтому при постоянной степени конверсии
этилена селективность падает с повышением
температуры (рис. 1)
.
Рис. 1.1. Зависимость селективности образования оксида этилена от температуры
Оптимальным считается интервал 220-280 °С, однако выгодное для селективности снижение температуры приводит к уменьшению производительности катализатора. Этот эффект компенсируют проведением процесса под давлением 1-3 МПа, которое не влияет на селективность и одновременно облегчает абсорбцию летучего этиленоксида из реакционных газов.
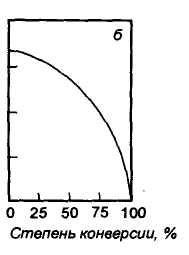 Ввиду
последовательности окисления целевого
вещества в продукты полного окисления
селективность процесса падает с
увеличением степени конверсии этилена
(рис. 1.2).
Ввиду
последовательности окисления целевого
вещества в продукты полного окисления
селективность процесса падает с
увеличением степени конверсии этилена
(рис. 1.2).
Рис. 1.2. Зависимость селективности образования оксида этилена от степени конверсии
Наконец, важнейшую роль играет и сам катализатор, способ его приготовления и т. д. Добавление различных модификаторов или применение смесей оксидов и солей способно сильно изменять активность и селективность контакта. Так, некоторые каталитические яды (галогены, селен), дезактивируя серебряный катализатор окисления этилена, существенно повышают его селективность. Оксиды молибдена и висмута, в индивидуальном виде вызывающие полное окисление олефинов, в форме молибдата висмута (Bi2O3: M0O3 =1:2) являются селективными катализаторами гетерогенного окисления пропилена. Большое влияние оказывают носитель, размер зерен катализатора, его пористость и т. д. Ввиду возможности последовательного окисления целевого вещества и высокой скорости самой химической реакции на поверхности катализатора переход процесса во внутридиффузионную область весьма нежелателен, поэтому используют катализаторы с небольшими зернами и сравнительно крупными порами
Для поддержания оптимальной селективности катализатора в исходную газовую смесь перед реакторами вводятся пары дихлорэтана в токе азота. Добавление дихлорэтана улучшает селективность, но уменьшает активность катализатора при данной температуре.
При окислении дихлорэтана образуется атомарный хлор, хемосорбирующийся на поверхности катализатора, что приводит к увеличению числа активных центров, ответственных за хемосорбцию атомарного и молекулярного кислорода и повышению селективности процесса.
Большое влияние на режим работы реактора оказывает реакция полного сгорания этилена, тепловой эффект которой более чем в 10 раз больше теплового эффекта основной реакции. Для замедления реакции полного окисления к сырью добавляют такие ингибиторы, как тетраэтилсвинец, дибромэтан, бензол, этанол, хлорбифенил, хлорполифенил. Особенно подходящим оказался этиленхлоргидрин. Можно применять хлортрифторэтиленовый полимер, а при работе в кипящем слое катализатора использовать твердые галоиды.
Температура в зоне реакции имеет решающее значение для активности, селективности и продолжительности срока службы катализатора. При понижении температуры селективность катализатора повышается, а активность снижается. При повышении температуры увеличивается активность, селективность снижается. Селективность катализатора по окиси этилена определяется отношением числа молей образовавшейся окиси этилена к числу прореагировавших молей этилена.
