Лекции по ФХМА / МАСА 1023
.docМолекулярно-абсорбционный спектральный анализ
Включает спектрофотометрические и фотоколориметрические методы анализа. Спектрофотометрический метод анализа основан на поглощении монохроматического излучения, а фотоколориметрический на поглощении немонохроматического излучения. В веществе молекулы, атомы и ионы находятся в определенном энергетическом состоянии, при прохождении потока излучения они способны переходить в более высокие энергетические состояния, чаще всего это бывает переход с основного уровня на первый возбужденный уровень. Таким образом происходит поглощение потока излучения. Поглощение тем больше, чем больше концентрация светоглощающего вещества.
При поглощении квантов света происходит увеличение внутренней энергии частицы, которая складывается из энергии вращения частицы, энергии колебания атомов и движения электронов.
В зависимости от длины волны в электромагнитном спектре обычно выделяют следующие участки:
|
Интервал длин волн, нм |
Участок спектра |
|
10 - 400 |
Ультрафиолетовое излучение |
|
400 - 760 |
Видимый свет |
|
760 - 106 |
Инфракрасное излучение |
Основной закон светопоглощения
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Вследствие поглощения излучения, при прохождении его через слой вещества, интенсивность излучения уменьшается, и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера-Ламберта-Бера (основной закон светопоглощения) связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя.
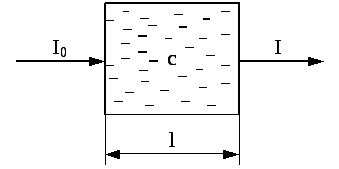
Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель. При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков, и уменьшение интенсивности света будет зависеть от концентрации вещества.
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) Т:
![]()
где I0 и I - соответственно интенсивность падающего светового потока и интенсивность светового потока, прошедшего через раствор.
Взятый
с обратным знаком логарифм Т называется
оптической плотностью А:
![]()
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера.
![]() или
или
![]() или
или
![]()
общепринятая логарифмическая форма записи,
где ε – молярный коэффициент светопоглощения;
l – толщина светопоглощающего слоя, см;
с – концентрация раствора, моль/дм3.
Ограничения и условия применимости закона Бугера-Ламберта –Бера
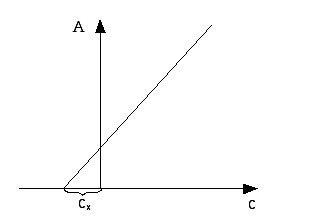
В соответствии с уравнением А = εcl зависимость оптической плотности от концентрации графически выражается прямой линией, выходящей из начала координат. Опыт показывает, однако, что линейная зависимость наблюдается не всегда. При практическом применении закона Бугера-Ламберта-Бера необходимо учитывать следующие ограничения:
1 Закон справедлив для монохроматического света.
2 Коэффициент ε зависит от показателя преломления среды (высокое значение показателя преломления характерно для растворов с высокими концентрациями).
3 Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
4 Пучок света должен быть параллельным.
5 При измерении концентрации не должна меняться природа частиц.
Спектры поглощения
Спектры поглощения строят в координатах А=f(λ). Длина волны, при которой наблюдается максимальное поглощение света, обозначается через λопт, и называется оптимальной длиной волны. Область максимального поглощения лучей характеризуется также размытостью максимума поглощения – интервалом длин волн, отвечающим половинным значениям А.
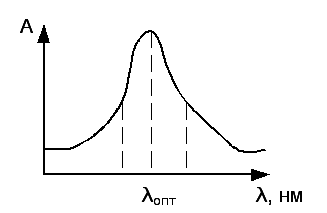
λопт является важной оптической характеристикой вещества. В количественном анализе оптическую плотность растворов измеряют при оптимальной длине волны, при которой обеспечивается максимальная чувствительность и точность.

Если измерения оптической плотности проводить при длине волны не соответствующей оптимальной, то погрешность в определении концентрации определяемого вещества ΔС2 выше, по сравнению с ΔС1.
Качественный фотометрический анализ
Основой качественного фотометрического анализа является оптимальная длина волны, величина зависящая от природы вещества и не зависящая от его концентрации в растворе. Качественный анализ проводится путем сравнения экспериментально найденной оптимальной длины волны с табличными значениями или с известными растворами.
Количественный фотометрический анализ
1 Метод одного стандарта
Готовят 3 стандартных раствора, содержащих определяемое вещество, одинаковой концентрации (сст). Опрелеляют оптические плотности стандартных растворо и раствора с неизвестной концентрацией. После чего, определив среднее значение оптической плотности стандартных растворов, рассчитывают концентрацию определяемого вещества по пропорции:
![]()
![]()
2 Метод двух стандартов
Готовят 2 стандартных раствора, так чтобы выполнялось условие:
![]()
Затем измеряют оптические плотности всех 3-х растворов по отношению к раствору сравнения и рассчитывают концентрацию определяемого вещества по формуле:
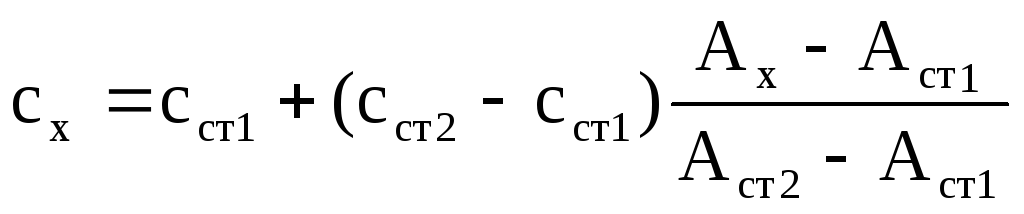
3 По среднему значению молярного коэффициента светопоглощения
Готовят 3 стандартных раствора, можно с различными концентрациями. Определив их оптические плотности рассчитывают коэффициенты светопоглощения:
![]()
![]()
![]()
Определяют среднее значение молярного коэффициента светопоглощения. После чего, измерив оптическую плотность раствора с неизвестной концентрацией, рассчитывают его концентрацию по формуле:
![]()
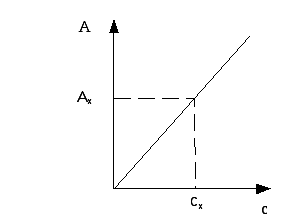
4 Метод калибровочного графика
Готовят серию стандартных растворов (обычно 5). Определяют их оптические плотности не менее трех раз при оптимальной длине волны. После статистической обработки строят график зависимости А от с. Затем измеряют Ах и по калибровочному графику определяют концентрацию раствора.
5 Метод добавок
а) расчетный метод
Измеряют оптическую плотность раствора с неизвестной концентрацией (Ах). К такому же количеству раствора добавляют определенный обьем раствора этого же вещества с известной концентрацией (сдоб). Затем измеряют оптическую плотность полученного раствора (Ах+доб). Концентрацию неизвестного раствора рассчитывают по формуле:
![]()
б) графический метод
Готовят 5 стандартных растворов. В каждую колбу добавляют одинаковый объем раствора с неизвестной концентрацией и измеряют оптическую плотность каждого раствора, после чего строят график зависимости А от с, по которому определяют искомую концентрацию.