
Лабораторная работа № 15.
(молекулярная физика и термодинамика)
Определение
отношения теплоемкостей
![]() воздуха
воздуха
методом Клемана-Дезорма.
Цель работы:экспериментальное определение отношения теплоемкостей воздуха при постоянном давлении и при постоянном объеме (показатель адиабаты).
Оборудование: прибор Клемана-Дезорма.
Краткая теория.
Термодинамической системойназывается некоторая совокупность тел, обменивающихся энергией, как между собой, так и с другими телами, внешними по отношению, к этой системе. Состояние системы определяется значениями всех величин, характеризующих физические свойства системы и называемых ее термодинамическими параметрами.
Важнейшими
параметрами состояния химически
однородной системы являются объем V,
давлениери температураТ.
Между этими тремя основными параметрами
состояния существует связь, называемая
уравнением состояния:![]() .
.
Зная, уравнение состояния вещества и используя законы термодинамики, можно изучать свойства веществ в различных агрегатных состояниях. Простейшей системой газообразного состояния является идеальный газ.Идеальнымназываетсягаз –модель реального газа, между молекулами которого отсутствуют силы межмолекулярного притяжения, взаимодействие между ними сводится к случайным упругим столкновениям силы отталкивания действуют только в момент соударения; молекулы такого газа ведут себя как абсолютно упругие шарики; их размерами можно пренебречь, а к движению применить законы Ньютона.
Уравнение состояния идеального газа – уравнение Клапейрона - Менделеева
![]() ,
(1)
,
(1)
где р – давление газа,
V – объем газа, предоставленный массе m газа с молекулярной массой μ,
R – универсальная газовая постоянная,
Т – абсолютная температура газа.
Основное уравнение молекулярно - кинетической теории газа
![]() (2)
(2)
где n - концентрация молекул,
ε - средняя кинетическая энергия поступательного движения одной молекулы газа, вычисляется с помощью уравнения Больцмана:
![]() ,
,
где
![]() - постоянная Больцмана (
- постоянная Больцмана (![]() – число Авогадро).
– число Авогадро).
Многочисленные опыты показали, что реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальным газам. Так, например, водород и гелий уже при атмосферном давлении и комнатной температуре ведут себя практически как идеальные газы.
Процессы, которые происходят в газах, подчиняются одному из основных законов природы – закону сохранения и превращения энергии. Выражением этого закона является первое начало термодинамики. В достаточно общей форме оно может быть сформулировано так:изменение полной энергии ΔW системы при переходе ее из одного состояния в другое равно сумме совершенной над системой работы А' и сообщенного ей количества теплоты:
![]()
Если вместо
совершенной над системой работы А'ввести равную ей по величине, но
противоположную по знаку работуА,
совершаемую системой над внешними
телами (![]() ),
и положить, что
),
и положить, что![]() ,
то получим:
,
то получим:
![]() ,
,
где
![]() - изменение
внутренней
энергии
системы.
Отсюда
вытекает
следующая
формулировка
первого
начала
термодинамики:
количество энергии сообщенной
системе в процессе теплообмена, идет
на изменение внутренней энергии и на
совершение системой работы против
внешних сил.
- изменение
внутренней
энергии
системы.
Отсюда
вытекает
следующая
формулировка
первого
начала
термодинамики:
количество энергии сообщенной
системе в процессе теплообмена, идет
на изменение внутренней энергии и на
совершение системой работы против
внешних сил.
Первое начало термодинамики в дифференциальной форме имеет вид
![]() ,
(3)
,
(3)
где dU– бесконечно малое изменение внутренней энергии системы,
δА– элементарная работа,
δQ – бесконечно малое количество теплоты.
Количеством теплоты называется энергия, передаваемая от одного тела к другому в процессе теплообмена.
Числом степеней свободы тела i называется число независимых координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве. Так, например, материальная точка, произвольно движущаяся в пространстве, обладает тремя степенями свободы (ее положение в пространстве описывается координатам X, Y, Z).
Молекулы одноатомного идеального газа можно рассматривать как материальные точки на том основании, что масса такой частицы (атома) сосредоточена в ядре, размеры которого очень малы (порядка 10-13 см). Поэтому молекула одноатомного газа может иметь лишь три степени свободы поступательного движения.
Молекулы, состоящие из двух, трех и большего числа атомов, не могут быть уподоблены материальным точкам. Молекула двухатомного газа в первом приближении представляет собой два жестко связанных атома, находящихся на некотором расстоянии друг от друга (рис. 1).
Т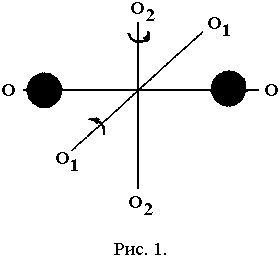 акая
молекула, помимо трех степеней свободы
поступательного движения, имеет еще
две степени свободы вращательного
движения вокруг осей О1-О1
и О2-О2.
Вращение вокруг третьей оси О-О
рассматривать не следует, так как момент
инерции атомов относительно этой оси
ничтожно мал, а следовательно, ничтожно
мала и кинетическая энергия молекулы,
связанная с этим вращением.
акая
молекула, помимо трех степеней свободы
поступательного движения, имеет еще
две степени свободы вращательного
движения вокруг осей О1-О1
и О2-О2.
Вращение вокруг третьей оси О-О
рассматривать не следует, так как момент
инерции атомов относительно этой оси
ничтожно мал, а следовательно, ничтожно
мала и кинетическая энергия молекулы,
связанная с этим вращением.
М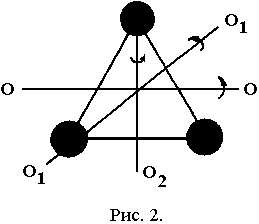 олекулы
трех- и многоатомных газов (рис. 2) подобно
абсолютно твердому телу обладают тремя
степенями свободы поступательного
движения и тремя степенями свободы
вращательного движения.
олекулы
трех- и многоатомных газов (рис. 2) подобно
абсолютно твердому телу обладают тремя
степенями свободы поступательного
движения и тремя степенями свободы
вращательного движения.
От числа степеней свободы, которыми могут обладать молекулы газа, зависят тепловые свойства газа, например, его теплоемкость.
Опыт
показывает, что на каждую степень свободы
поступательного движения молекулы газа
приходится одинаковая кинетическая
энергия, равная
![]() .
.
В идеальном газе нет сил взаимодействия между молекулами, а, следовательно, равна нулю их взаимная потенциальная энергия. Поэтому внутренняя энергия идеального газа будет равна сумме кинетических энергий Nего молекул:
![]()
А для одного моля идеального газа:
![]() .
(4)
.
(4)
Теплоемкостью называется величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы изменить его температуру на 1 К:
![]() .
.
Удельная теплоемкость вещества– величина, численно равная количеству теплоты, которое необходимо сообщить веществу массой 1 кг для изменения температуры на 1К:
![]() .
.
Единица измерения
удельной теплоемкости вещества – джоуль
деленный на килограмм-кельвин
![]() .
.
Кроме того, часто пользуются молярной (мольной) теплоемкостью вещества, которая, в отличие от удельной теплоемкости, отнесена не к одному килограмму, а к одному молю вещества.
Молярная теплоемкость вещества – величина, численно равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
![]() .
.
Среди процессов, которые могут происходить в газах, наиболее часто приходится иметь дело с изопроцессами. Так называют процессы в газах, при которых один из трех параметров состояния сохраняется постоянным. Такими процессами могут быть:изобарический, изохорический, изотермический.Рассмотрим каждый процесс и применим к ним первое начало термодинамики.
