
Posob_2012_Ok
.pdf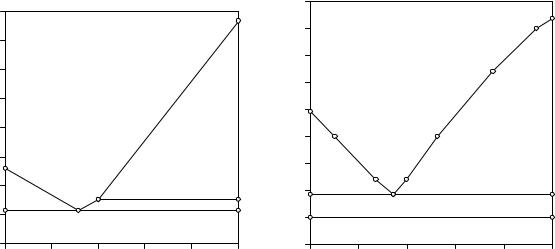
α-K2CrO4. Температура полиморфного превращения находится выше температуры эвтектики данной системы и ниже температуры плавления хромата калия. Во время фазового превращения в равновесии находятся три фазы, причем две твердые фазы имеют одинаковый состав, и оно является нонвариантным. На кривых охлаждения, следовательно, наблюдается температурная задержка. Данное нонвариантное равновесие на диаграмме состояния системы также отображается предельной нодой.
t, °C
1000 |
|
|
|
|
|
950 |
|
|
|
|
|
900 |
|
|
|
|
|
850 |
|
L |
|
|
|
|
|
|
|
|
|
800 |
|
|
|
|
|
750 |
|
|
L+β−K2CrO4 |
|
|
700 |
L+KCl |
|
|
|
|
|
|
L+α−K2CrO4 |
|
|
|
650 |
|
|
|
|
|
|
KCl+α−K2CrO4 |
|
|
||
|
|
|
|
||
600 |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
KCl |
|
% мол. |
K2CrO4 |
||
|
Рис. 9.2. Двойная система |
|
|||
|
|
KCl - K2CrO4 |
|
|
|
t, °C
850 |
|
|
|
|
|
800 |
|
|
|
|
|
750 |
|
|
|
|
|
700 |
|
|
|
|
|
650 |
|
|
|
|
|
600 |
|
|
|
|
|
550 |
|
|
|
L+NaCl |
|
|
|
|
|
|
|
L+β-CsCl |
|
|
|
|
|
500 |
|
|
|
|
|
450 |
|
β-CsCl+NaCl |
|
|
|
|
α-CsCl+NaCl |
|
|
||
|
|
|
|
||
400 |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
CsCl |
|
% мол. |
|
NaCl |
|
|
Рис. 9.3. Двойная система |
|
|||
|
|
CsCl - NaCl |
|
|
|
Диаграмма плавкости двойной системы CsCl - NaCl приведена на рис. 9.3. Эта система интересна тем, что полиморфное превращение хлорида цезия лежит ниже температуры эвтектики. При этом в равновесии находятся три твердые фазы, и оно является нонвариантным, что отображается на диаграмме состояния коннодой. На кривых охлаждения при температуре полиморфного превращения также наблюдаются температурные задержки.
9.3. Диаграммы плавкости двойных систем с образованием химических соединений
Плавление фаз, в частности, химического соединения называется конгруэнтным, если состав образующейся жидкой фазы тождественен с составом твердой фазы, и инконгруэнтным, если это условие не выполняется.
Примером двойной конденсированной системы с образованием конгруэнтно плавящегося химического соединения является двойная система Zn - Mg, приведенная на рис. 9.4. В этой системе образуется химическое соединение состава MgZn2. При плавлении этого вещества образуется
91
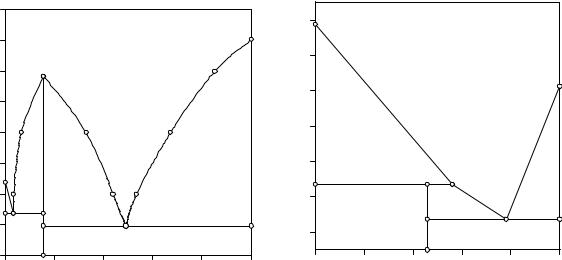
жидкая фаза того же состава, что и химическое соединение, а на кривой охлаждения сечения, проходящего через его состав, наблюдается температурная задержка. Данное сечение делит исходную систему на две самостоятельные двойные системы: Zn - MgZn2 и MgZn2 - Mg. Разделение системы на самостоятельные подсистемы называется триангуляцией.
Изобарная диаграмма плавкости с образованием инконгруэнтно плавящегося химического соединения в двойной системе Na - K приведена на рис. 9.5.
t, °C |
|
|
|
|
t, °C |
|
|
|
|
|
700 |
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
650 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80 |
|
|
|
|
600 |
|
|
L |
|
|
|
|
L |
|
|
|
|
|
|
|
60 |
|
|
|
||
550 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
500 |
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
L+Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
450 |
L + MgZn2 |
|
|
Mg+L |
|
20 |
|
P |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
L+K |
|
400 |
|
|
|
|
|
0 |
|
L+KNa2 |
E |
|
|
|
|
|
|
|
|
Na+KNa2 |
|
||
350 |
MgZn2+ |
|
|
|
|
-20 |
|
KNa2+K |
|
|
|
|
MgZn2+Mg |
|
|
|
|
|
|||
300 |
Zn |
|
|
|
|
|
40KNa2 60 |
|
|
|
MgZn220 |
|
|
|
|
0 |
20 |
80 |
100 |
||
0 |
40 |
60 |
80 |
100 |
||||||
Zn |
|
% мас. |
|
Mg |
Na |
|
% мас. |
|
K |
|
|
|
|
|
|
|
|||||
Рис. 9.4. Двойная система Mg - Zn |
Рис. 9.5. Двойная система Na - K |
|||||||||
Если нагревать химическое соединение состава KNa2, то при температуре 7°С начинается процесс плавления этого вещества, сопровождающийся разложением его на твердый Na и жидкую фазу состава Р. В этом случае состав жидкой фазы отличается от состава химического соединения. Кроме того, исчезает одна твердая фаза (KNa2) и образуется другая (Na), протекает перитектическая реакция: KNa2(S) = LP + Na(S). Такое плавление является инконгруэнтным.
В момент плавления в равновесии находятся три фазы, и оно является нонвариантным, на кривых охлаждения или нагревания наблюдается температурная задержка. При подводе тепла исчезает химическое соединение, система становится моновариантной, вновь начинает увеличиваться температура, однако твердая фаза при этом не исчезает. Данный факт также позволяет отличить инконгруэнтное плавление от конгруэнтного.
92
10. Двойные конденсированные системы с двумя фазами переменного состава
Внекоторых системах при охлаждении расплавов кристаллизуются фазы в виде твердых растворов. Твердые растворы являются фазами переменного состава. Изоморфные смеси, смешанные кристаллы являются также твердыми растворами или фазами переменного состава. Твердые растворы могут быть трех типов: замещения, внедрения и вычитания.
Вещества, имеющие близкие кристаллические структуры и близкие размеры их атомов, молекул или ионов, при совместной кристаллизации образуют обычно непрерывный ряд твердых растворов типа замещения. При этом атомы, ионы или молекулы одного типа статистически замещают
вузлах кристаллической решетки атомы, ионы или молекулы другого типа. Непрерывные твердые растворы образуются, если различие в размерах ионных радиусов не превышает 10-15%, межатомных расстояний - 4-5%.
Вторым необходимым фактором образования твердых растворов замещения является химическое подобие компонентов, близость типов химической связи и величин физических констант. Например, температуры плавления веществ не должны отличаться более чем на 27 отн. %, а энергии образования кристаллических решеток - более чем 10 отн. %.
Твердые растворы внедрения могут получаться при значительной разнице размеров атомов, ионов или молекул компонентов, при этом атомы, ионы или молекулы растворенного вещества располагаются в междоузлиях кристаллической решетки, образованной веществом-основой. При образовании твердых растворов внедрения не требуется близкого типа химической связи, размерный фактор может играть роль, противоположную твердым растворам замещения, а именно: максимальной взаимной растворимости компонентов благоприятствует наибольшая разница их атомных радиусов.
Втвердых растворах вычитания число атомов в элементарной ячейке кристалла уменьшается по сравнению с чистым компонентом (основой). Такие твердые растворы часто образуются на основе нестехиометрических
соединений. Так, в сульфиде железа Fe1-xS, который можно рассматривать как твердый раствор S в FeS, в действительности имеются свободные октаэдрические пустоты - катионные вакансии - вследствие того, что часть атомов железа имеет степень окисления III.
Впределах области гомогенности одной и той же фазы могут наблюдаться как твердые растворы внедрения, так и твердые растворы вычитания, поэтому иногда эти типы твердых растворов объединяют под названием "твердые растворы с переменным числом атомов в элементарной ячейке".
Возможное взаимное расположение кривых ликвидуса и солидуса
93
при кристаллизации твердых растворов было выведено Розебомом (1899 г.) на основании изотерм изобарно-изотермического потенциала. По классификации Розебома существует пять типов двойных систем плавкости с образованием твердых растворов.
Тип I отвечает случаю, когда при увеличении концентрации компонента В температура начала кристаллизации непрерывно повышается. Линия ликвидуса имеет вид непрерывной кривой, все точки которой лежат между температурами кристаллизации компонентов А и В.
Тип II отвечает случаю, когда температура начала кристаллизации повышается при прибавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через максимум.
Тип III отвечает случаю, когда температура начала кристаллизации понижается при прибавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через минимум.
Тип IV отвечает случаю, когда компоненты в твердом состоянии ограничено растворимы друг в друге, причем на линии ликвидуса имеется перитектическая точка.
Тип V также отвечает случаю, когда компоненты в твердом состоянии ограничено растворимы друг в друге, но на линии ликвидуса имеется эвтектическая точка.
10.1. Диаграммы плавкости двойных систем с твердыми растворами типа I по классификации Розебома
На рис. 10.1 приведена изобарная диаграмма состояния системы W - Mo. В этой системе образуется непрерывный ряд твердых растворов I-го типа классификации Розебома.
Рассмотрим, как будет протекать процесс изобарного охлаждения расплава I. На участке охлаждения I-1 система представляет собой гомогенный расплав, состав жидкой фазы остается постоянным, равным составу выбранного сечения, твердая фаза отсутствует. Кривая охлаждения отображает монотонное уменьшение температуры, изломы на ней отсутствуют.
При температуре точки 1 начинают появляться первые кристаллы твердой фазы, представляющие собой твердый раствор состава 1'. Вариантность системы при этом уменьшается на 1, и на кривой охлаждения появляется излом. На участке охлаждения 1-2 кристаллизуется твердый раствор, состав которого меняется по кривой солидуса от точки 1' до точки 2. Состав жидкой фазы при этом меняется по линии ликвидуса от точки 1 до точки 2'.
При температуре точки 2 суммарный состав твердой фазы становится равным составу выбранного сечения, исчезает последняя капля расплава, система вновь становится дивариантной, на кривой охлаждения возникает излом.
94

t, °C |
|
|
|
|
|
t, °C |
|
|
|
|
|
I |
|
|
|
3400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3200 |
|
L |
|
|
|
|
L |
3000 |
|
α+L |
|
|
1 |
|
|
|
|
α 1' |
|
|
|
1 L+α |
|
2800 |
|
|
2 |
2' |
|
2 |
|
|
|
|
|
|
|
α |
|
2600 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2400 |
|
|
|
I |
|
|
Время |
0 |
20 |
40 |
60 |
80 |
100 |
||
W |
|
% мас. |
|
|
Mo |
|
|
Рис. 10.1. Система W - Mo с образованием твердых растворов типа Iпо классификации Розебома
При температурах меньших точки 2 система представляет собой гомогенный твердый раствор, состав которого равен составу выбранного сечения, происходит охлаждение твердой фазы.
10.2. Диаграммы плавкости двойных систем с твердыми растворами типа II по классификации Розебома
Среди систем с неограниченной растворимостью в твердом состоянии твердые растворы типа II весьма редки и до настоящего времени были обнаружены только в системах из органических компонентов. В качестве примера на рис. 10.2 приводим систему, образованную двумя оптическими изомерами - правым и левым карвоксимами (C10H14NOH).
Оба компонента имеют одну и ту же точку плавления (72°С). Температурный максимум лежит при мольном отношении компонентов 1 : 1 и 91.4°С. Диаграмма совершенно симметрична по отношению к ординате, проведенной через максимум.
Кривые охлаждения политермических сечений, проходящих через максимумы подобных систем, имеют температурную задержку, что служило источником ошибочных представлений о природе этих максимумов как чистых химических соединений. Ошибочность этих представлений доказана исследованиями микроструктуры и физических свойств подобных систем.
Кривые охлаждения других политермических сечений подобны таковым в системах с образованием твердых растворов типа I.
95

95 |
t, °C |
|
|
I |
|
|
II |
t, °C |
|
|
|
|
L |
|
1 |
|
1 |
L |
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
α |
||
90 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
85 |
|
α |
|
|
|
α |
|
|
|
L |
|
|
|
|
+L |
|
|
|
|
||
|
|
+L |
|
|
|
|
|
|
|
|
80 |
|
|
|
α |
|
2' |
2 |
|
|
2 |
|
|
|
|
|
|
|
|
α |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
+L |
75 |
|
|
|
|
|
|
3 |
3' |
|
3 |
|
|
|
|
|
|
|
|
|
|
α |
70 |
|
|
|
I |
|
|
II |
|
|
Время |
|
0 |
20 |
40 |
60 |
80 |
100 |
|
|||
d-C10H14NOH |
% мол. |
l-C10H14NOH |
|
|||||||
Рис. 10.2. Система d-C10H14NOH - l-C10H14NOH с образованием твердых растворов типа II по классификации Розебома
10.3. Диаграммы плавкости двойных систем с твердыми растворами типа III по классификации Розебома
В системах с неограниченной растворимостью компонентов наиболее часто встречаются твердые растворы типа III, которые нередко при охлаждении претерпевают превращения в твердом состоянии. К системам типа III относятся следующие системы: Cu - Au; KCl - NaCl; KBr - NaBr; KJ
- NaJ; Ag2S - Cu2S и др.
На рис. 10.3 приведена система Mn - Ni, также относящаяся к типу III. Марганец плавится при 1245°С, никель - при 1455°; температурный минимум лежит при содержании 45 % мас. Ni и температуре 1005 °С.
Рассмотрим, как протекает изобарное охлаждение расплава I в политермическом сечении I-I, проходящем через состав минимума системы. На участке охлаждения I-1 твердая фаза отсутствует, состав расплава остается постоянным, происходит его охлаждение.
При температуре точки 1 начинается кристаллизация твердого раствора, состав которого тождественен расплаву. На кривой охлаждения при этом наблюдается температурная задержка, подобная эвтектической. При отводе тепла количество жидкой фазы уменьшается, а твердой - увеличивается. После исчезновения жидкой фазы температура смеси вновь начинает уменьшаться, происходит охлаждение твердого раствора постоянного состава.
Политермическое сечение II-II на участке охлаждения 2-3 пересекает поле моновариантных равновесий жидкой фазы и твердого раствора, поэтому на кривой охлаждения имеется два излома (точки 2 и 3). Состав жидкой фазы при этом меняется по кривой ликвидуса от точки 2 до точки
96
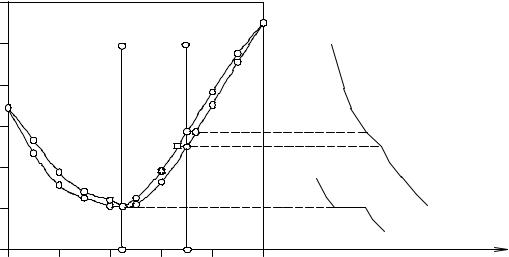
3', а состав твердой фазы, представляющей собой твердый раствор, изменяется по линии солидуса от точки 2' до точки 3.
t, °C |
|
|
|
|
|
|
t, °C |
|
|
|
1500 |
|
|
|
|
|
|
|
|
|
|
1400 |
|
|
I |
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1300 |
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
1200 |
|
L |
|
|
2 |
2' |
|
2 |
L+α |
|
|
|
|
|
3' |
|
|
|
|
||
1100 |
|
|
|
3 |
|
|
|
3 |
α |
|
|
|
|
|
|
L |
|
||||
1000 |
|
|
|
|
|
|
|
|
|
|
|
α |
1 |
|
|
|
1 |
|
α |
|
|
|
|
|
|
|
|
|
||||
900 |
|
|
40I |
|
II |
|
|
|
|
Время |
0 |
20 |
|
60 |
80 |
100 |
|
|
|||
Mn |
|
|
% мас. |
|
|
Ni |
|
|
|
|
Рис. 10. 3. Система Mn - Ni с образованием твердых растворов типа III по классификации Розебома
При температуре точки 3 исчезает жидкая фаза, и в дальнейшем происходит охлаждение твердого раствора постоянного состава.
10.4. Диаграммы плавкости двойных систем с твердыми растворами типа IV по классификации Розебома
Внастоящем разделе мы рассмотрим весьма распространенный случай, когда компоненты двойной системы в жидком состоянии обладают неограниченной растворимостью, а в твердом состоянии ограниченно рас-
творимы друг в друге. Причем кривые ликвидуса (см. рис. 10.4) TPtP и TAgP пересекаются в перитектической или переходной точке, лежащей между температурами плавления чистых компонентов.
Всистеме Ag - Pt, приведенной на рис. 10.4, и на всех подобных ей диаграммах имеется нонвариантное трехфазное перитектическое равновесие, которое при подводе тепла можно описать следующим уравнением:
P(L) + αп(S) = βп(S).
При отводе тепла перитектическая фазовая реакция протекает в обратную сторону.
Три равновесные фазы (жидкая - P; предельно насыщенный твердый раствор на основе серебра - αп; предельно насыщенный твердый раствор на основе платины - βп) на диаграмме плавкости соединены коннодой, отображающей данное равновесие.
Перейдем к рассмотрению хода кристаллизации и кривых охлажде-
97
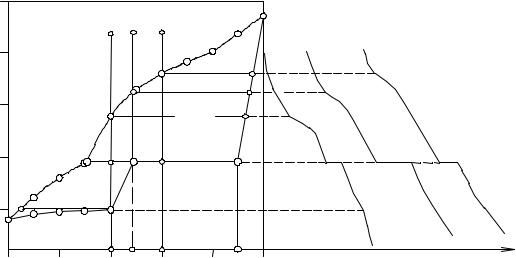
ния в политермических сечениях системы, изображенной на рис. 10.4. Отметим прежде всего, что последовательность затвердевания и вид кривых охлаждения сплавов, состав которых лежит между точками Ag и Р, а также Pt и βп, не имеют никаких особенностей по сравнению с тем, что уже описано выше. Из сплавов этих концентраций кристаллизуются твердые растворы α и β, на чьих кривых охлаждения наблюдаются два излома, отвечающие температурам начала и конца затвердевания.
1800 |
t,°C |
|
|
|
|
|
|
|
t,°C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
I |
|
|
|
|
|
TPt |
|
|
|
|
|
|
|
|
|
II |
III |
|
|
|
|
|
|
||
1600 |
|
|
|
|
|
5 |
|
5' |
L |
L |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
||||
1400 |
|
|
|
|
4 |
|
|
4' |
L |
4 |
|
|
|
|
L |
1 |
|
|
|
L+β |
1' |
1 |
|
β |
L+β |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
β |
L+ |
|
|
|
|
P |
|
|
αп |
|
βп |
|
L+ |
|
|
|
|
1200 |
|
|
|
|
|
2 |
|
6 |
|
||||
|
|
|
2 |
|
|
6 |
|
|
|
|
α |
α+β |
α+β |
|
3' |
L+α |
|
|
|
|
α+β |
β |
|
L+ |
|
||
1000 |
|
|
|
|
|
3 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
TAg |
α |
3 |
|
|
|
|
|
|
|
α |
|
|
|
|
0 |
20 |
I |
|
II |
III |
|
100 |
|
|
|
Время |
|
|
40 |
|
60 |
80 |
|
|
|
|
|
||||
|
Ag |
|
|
% мас. |
|
|
Pt |
|
|
|
|
||
Рис. 10. 4. Система Ag - Pt с образованием твердых растворов типа IV по классификации Розебома
Необходимо, впрочем, указать, что процессы перехода твердых растворов α или β при охлаждении из однофазной области α или β в двухфазную α + β сопровождаются столь незначительными тепловыми эффектами, что их не удается подметить на кривых охлаждения. Границы этих фазовых областей уточняются другими методами (например, микрокристаллоскопическим).
При охлаждении из жидкого состояния сплавов, состав которых лежит между точками Р и αп, первично кристаллизуется твердый раствор β. При дальнейшем понижении температуры он претерпевает превращения, с которыми мы еще не встречались.
Пусть жидкий сплав II имеет состав, отвечающий абсциссе точки αп.. Когда при охлаждении фигуративная точка этого сплава попадет на линию ликвидуса ТРt-Р в точке 4, из него выделится первый кристалл твердого раствора β, состав которого найдем, проведя конноду 4 - 4' до пересечения ее с линией солидуса ТРt−βп в точке 4'. При дальнейшем понижении температуры состав жидкой фазы будет меняться по кривой ликвидуса от 4
98
до точки Р, а состав равновесной с ней твердой фазы - по кривой солидуса от точки 4' до βп.
При перитектической температуре жидкая фаза имеет состав точки Р, а твердая фаза - состав точки βп. Но при этой температуре мы должны иметь нонвариантное равновесие, что для двухкомпонентной системы при постоянном давлении возможно лишь для трех фаз. Поэтому между жидкой фазой состава Р и твердым раствором βп должна протекать следующая фазовая реакция: P(L) + βп(S) = αп(S). Таким образом, жидкая фаза состава Р и твердый раствор βп дадут третью фазу - твердый раствор αп.
Применяя правило рычага, легко убедиться, что твердый раствор βп перейдет нацело в αп и жидкая фаза состава Р израсходуется на это полностью. Кривая охлаждения этого сплава имеет излом, отвечающий началу кристаллизации твердого раствора β (точка 4), и горизонтальный участок при температуре нонвариантного равновесия.
Если состав исходного жидкого сплава I лежит между точка Р и αп , то при перитектической реакции расплав состава Р находится в избытке по отношению к твердой фазе βп, поэтому по превращении всего твердого раствора βп в αп некоторая часть жидкой фазы Р останется неизрасходованной. При дальнейшем охлаждении ее состав будет меняться по участку ликвидуса ниже точки Р, а состав равновесного с ним твердого раствора α - по участку солидуса αп - 3. На кривой охлаждения, кроме точки ликвидуса (точка 1) и горизонтального участка (точка 2), появится излом, отвечающий точке 3 солидуса.
Если состав исходного жидкого сплава III лежит между точками βп и αп, то твердая фаза βп находится в избытке по отношению к жидкой фазе Р, и в результате протекания перитектической реакции жидкая фаза Р закончится первой и после затвердевания будем иметь смесь двух твердых растворов βп и αп. На кривых охлаждения сплавов, лежащих между точками βп и αп, наблюдается излом, отвечающий началу кристаллизации твердого раствора β (точка 5), и горизонтальный участок при температуре перитектического превращения (точка 5).
10.5. Диаграммы плавкости двойных систем с твердыми растворами типа V по классификации Розебома
Вслучае твердых растворов с эвтектикой моновариантные кривые ликвидуса пересекаются в нонвариантной эвтектической точке Е, лежащей ниже температур плавления обоих компонентов. Состав твердых растворов, сосуществующих с жидкостью, определяется моновариантными кривыми солидуса (см. рис. 10.5).
Вточках αп и βп кривые солидуса пересекаются с коннодой αп-Е-βп ,
иточки αп и βп являются, следовательно, фигуративными точками предельно насыщенных твердых растворов, находящихся в равновесии с эв-
99

тектическим расплавом Е. При охлаждении ниже эвтектической температуры предельная концентрация обоих твердых растворов падает. Ее уменьшение для твердого раствора α выражается кривой αп-3-7', а для твердого раствора β - βп-3′-4′. Сопряженные точки кривых αп-3-7' и βп-3′-4′ суть фигуративные точки твердых растворов α и β, находящихся в равновесии при данной температуре.
350 |
t,°C |
I |
|
II |
III |
|
t,°C |
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
TPb |
|
|
|
|
|
|
|
|
|
|||
300 |
|
|
|
|
L |
|
|
L |
|
|
|
|
250 |
|
1' |
1 |
|
|
|
|
TBi |
1 |
|
L |
|
|
|
α |
|
|
|
|
|
|
|
|
|
|
200 |
|
L+ |
|
|
|
|
L+β |
|
L+α |
L |
5 |
|
|
|
|
|
|
|
|
|
|||||
150 |
|
|
2 |
|
2' |
5 |
5' |
|
2 |
L+β |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
α |
|
αп |
E |
6 |
βп β |
|
α 3 |
6 |
|
|
100 |
|
|
|
|
|
|||||||
|
|
3 |
|
|
|
3' |
|
|
α+β |
α+β |
||
|
|
|
|
α + β |
α+β |
|||||||
|
|
|
|
|
|
|
|
|||||
50 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
7' |
4 |
|
|
7 |
|
4' |
|
|
|
|
|
|
I |
|
II |
III |
|
|
|
|
|
Время |
|
|
0 |
20 |
40 |
80 |
100 |
|
|
|
||||
|
60 |
|
|
|
|
|||||||
|
Pb |
|
% мас. |
|
|
Bi |
|
|
|
|
||
Рис. 10. 5. Система Pb - Bi с образованием твердых растворов типа V по классификации Розебома
Указанные линии делят плоскость диаграммы на шесть фазовых полей. В однофазном поле L, ограниченном снизу кривыми ликвидуса TPb - 1 - 2' - E - 5 - TBi, находится жидкая фаза. В двухфазном поле L+α жидкая фаза сосуществует с твердым раствором α, а в двухфазном поле L+β − с твердым раствором β. В однофазном поле α (TPb - 1'- 2 - αп - 3 - 7') находятся твердые растворы α, а в однофазном поле β (TBi - 5'- βп- 3'- 4') - твердые растворы β. В двухфазном поле α+β находятся конгломераты твердых растворов α и β.
Рассмотрим кривые охлаждения и ход кристаллизации твердых растворов с эвтектикой. Пусть состав исходного сплава I лежит между составами точек Pb и αп. При охлаждении его до температуры точки 1 начнется кристаллизация твердого раствора αсостава 1'.
На участке охлаждения от точки 1 до точки 2 будет происходить кристаллизация твердого раствора α, состав жидкой фазы при этом меняется по кривой ликвидуса от точки 1 до точки 2', а состав твердой фазы - по кривой солидуса от точки 1' до точки 2. При этом на кривой охлаждения наблюдается излом в точке 1, когда появляется твердая фаза, и в точке 2,
100
