
Введение
Учебное пособие по теплофизике специально разработано для студентов заочной формы обучения инженерно-технических специальностей университета, поэтому оно включает материалы как теоретического, так и практического характера.
Прежде чем приступить к выполнению контрольных заданий, ознакомьтесь предлагаемыми рекомендациями, которые помогут Вам выбрать необходимый вариант контрольной работы и правильно ее оформить.
Теоретико-практическая часть является необходимым элементом при выполнении контрольной работы. Теоретическая составляющая включает основные физические понятия, законы и формулы, без знания которых невозможно решить самую простую задачу. Эта часть пособия должна быть тщательно проработана. Далее внимательно прочтите предлагаемые примеры решения задач. Воспользовавшись текстами этих задач, попробуйте решить их самостоятельно. Правильное решение позволит утвердиться во мнении, что методика решения задач Вам понятна. Рассмотренные в пособии примеры позволят Вам выбрать схемы решения контрольных задач. Отметим, что многие примеры сопровождаются пояснительными рисунками, так как образное представление физической задачи облегчает ее решение.
Каждая контрольная работа снабжена таблицей вариантов. Выбор варианта определяется последней цифрой зачетной книжке.
Решая контрольные задачи, Вы можете столкнуться с необходимостью использовать физические постоянные, а также величины, являющиеся табличными данными, числовые значения которых не указаны в тексте задачи, например, эффективный диаметр молекулы азота и т.п. В этом случае необходимо воспользоваться справочным материалом, приведенном в приложении.
Размерности и единицы СИ некоторых физических величин приведены в табл. 4 прил. А.
В случае, если в тексте задачи указаны величины, кратные или дольные единицам СИ, воспользуйтесь табл. А.5 прил. А. Например, р = 0,5 МПа = 0,5×106 Па, q = 12 нКл = 12×10-9 Кл .
Наряду
с буквами латинского алфавита,
используемыми для обозначения физических
величин, встречаются буквы греческого
алфавита, представленного в табл. А.6
прил. А. Например,
![]() (эта)
– коэффициент полезного действия
тепловой машины,
(эта)
– коэффициент полезного действия
тепловой машины,![]() (ро)
– плотность вещества. Приведенные выше
примеры указывают на необходимость
использования сведений прил. А при
решении задач контрольных работ.
(ро)
– плотность вещества. Приведенные выше
примеры указывают на необходимость
использования сведений прил. А при
решении задач контрольных работ.
Основные формулы и законы
Количество вещества тела (системы) – число структурных элементов (молекул, атомов, ионов и т.п.), содержащихся в теле или системе.
Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде – 12 массой 0,012 кг.
Количество вещества тела (системы)
v
=
![]() ,
,
где N – число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); NA – постоянная Авогадро
(NА = 6,02×1023 моль-1).
Молярная масса вещества
М
=
![]() ,
,
где m – масса однородного тела (системы); v – количество вещества этого тела.
Относительная молекулярная масса вещества
![]() ,
,
где ni – число атомов i-го химического элемента, входящих в состав молекулы данного вещества; Ar,i – относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д.И. Менделеева. См. также в табл. А.10. прил. А. Связь молярной массы М с относительной молекулярной массой вещества
М=![]() ,
,
где k = 10-3 кг/моль.
Количество вещества смеси газов
v = v1+v2+…+vn = N1/NA + N2/NA + ... +Nn/NA ,
или
![]() ,
,
где vi, Ni, mi, Mi – соответственно количество вещества, число молекул, масса, молярная масса i-го компонента смеси.
Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа)
pV
=
![]() RT
= vRT,
RT
= vRT,
где m – масса газа, М – молярная масса газа, R – молярная газовая постоянная, v – количество вещества, Т – термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева – Клапейрона для изопроцессов:
а) закон Бойля – Мариотта (изотермический процесс: T = const, m = const)
pV =const,
или для двух состояний газа
p1V1 = p2V2;
б) закон Гей-Люссака (изобарный процесс: р = const, m= const)
![]() =
const,
=
const,
или для двух состояний газа
![]() ;
;
в) закон Шарля (изохорный процесс: V = const, m = const)
![]() =
const,
=
const,
или для двух состояний газа
![]() ;
;
г) объединенный газовый закон (m = const)
![]() =
const,
или
=
const,
или
![]() ,
,
где p1, V1, T1 – давление, объем и температура газа в начальном состоянии; p2, V2, T2 – те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов
p= p1+ p2 +…+ pn ,
где pi – парциальные давления компонентов смеси; п – число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси газов
![]() ,
,
где
mi
–
масса i-го
компонента смеси;
![]() – количество веществаi-го
компонента смеси; п
– число
компонентов смеси.
– количество веществаi-го
компонента смеси; п
– число
компонентов смеси.
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
![]()
![]() ,
,
где m – масса смеси.
Концентрация молекул
![]() ,
,
где N – число молекул, содержащихся в данной системе; ρ – плотность вещества; V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов
![]() ,
,
где
![]() – средняя кинетическая энергия
поступательного движения молекулы.
– средняя кинетическая энергия
поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы
![]() ,
,
где k – постоянная Больцмана.
Средняя полная кинетическая энергия молекулы
![]() ,
,
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры
р = nkT.
Среднее число столкновений, испытываемых одной молекулой газа за 1 с
![]() ,
,
где
d
–
эффективный диаметр молекулы; n
– концентрация молекул; ![]() – средняя арифметическая скорость
молекул газа.
– средняя арифметическая скорость
молекул газа.
Средняя длина свободного пробега молекул газа
![]() ,
,
где
![]() – средняя арифметическая скорость
молекул газа;
– средняя арифметическая скорость
молекул газа;
![]() –среднее
число столкновений, испытываемых одной
молекулой газа за 1
с;
–среднее
число столкновений, испытываемых одной
молекулой газа за 1
с;
d – эффективный диаметр молекулы;
n – концентрация молекул.
Масса
![]() m
газа,
перенесенная за время
m
газа,
перенесенная за время
![]() t
через
поверхность площадью S
в результате диффузии, определяется
законом Фика
t
через
поверхность площадью S
в результате диффузии, определяется
законом Фика
![]()
![]() ,
или
,
или
![]() ,
,
где
D
–
коэффициент диффузии;
![]() – градиент концентрации молекул;m1
–
масса
одной молекулы;
– градиент концентрации молекул;m1
–
масса
одной молекулы;
![]() –градиент
плотности газа.
–градиент
плотности газа.
Коэффициент диффузии
![]() ,
,
где
![]() – средняя арифметическая скорость;
– средняя арифметическая скорость;![]() – средняя длина свободного пробега
молекул газа.
– средняя длина свободного пробега
молекул газа.
Сила F внутреннего трения между движущимися слоями газа определяется законом Ньютона
![]() ,
,
где
![]() – градиент скорости течения газа в
направлении, перпендикулярном к
поверхности площадьюS;
– градиент скорости течения газа в
направлении, перпендикулярном к
поверхности площадьюS;
![]() – коэффициент внутреннего трения
(динамическая вязкость).
– коэффициент внутреннего трения
(динамическая вязкость).
Коэффициент внутреннего трения (динамическая вязкость)
![]() ,
,
где
![]() – средняя арифметическая скорость;
– средняя арифметическая скорость;![]() – средняя длина свободного пробега
молекул газа;
– средняя длина свободного пробега
молекул газа;![]() – плотность газа.
– плотность газа.
Количество
тепла Q,
перенесенное за время
![]() через поверхность площадьюS
в результате теплопроводности определяется
законом Фурье
через поверхность площадьюS
в результате теплопроводности определяется
законом Фурье
![]() ,
,
где
![]() – градиент температуры;
– градиент температуры;![]() –
коэффициент теплопроводности.
–
коэффициент теплопроводности.
Коэффициент теплопроводности
![]() ,
,
где
![]() – средняя арифметическая скорость;
– средняя арифметическая скорость;![]() – средняя длина свободного пробега
молекул газа;
– средняя длина свободного пробега
молекул газа;![]() – плотность газа;сV
– удельная
теплоемкость газа при постоянном объеме.
– плотность газа;сV
– удельная
теплоемкость газа при постоянном объеме.
Удельные теплоемкости газа при постоянном объеме (сV) и постоянном давлении (ср)
![]() ,
,
![]() .
.
Связь между удельной с и молярной С теплоемкостями
с
=
![]() ,
С = сМ.
,
С = сМ.
Уравнение Майера
Cp – CV = R.
Внутренняя энергия идеального газа
![]() .
.
Первое начало термодинамики
Q = ΔU + A,
где Q – теплота, сообщенная системе (газу); ΔU – изменение внутренней энергии системы; А – работа, совершенная системой против внешних сил.
Работа
расширения газа:
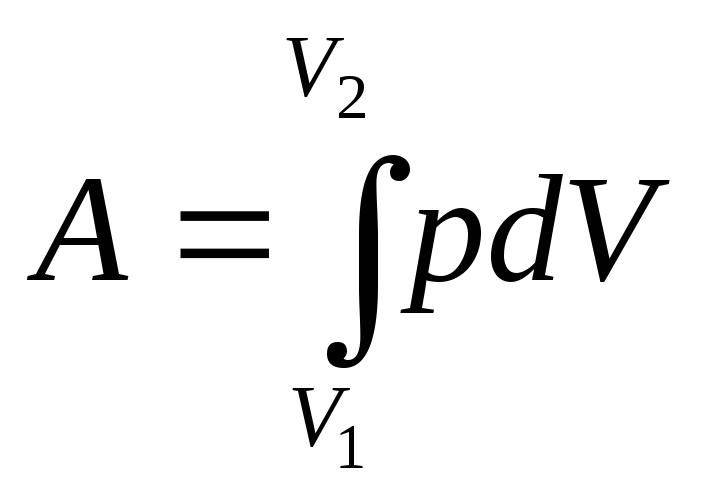 в
общем случае;
в
общем случае;
A = 0 при изохорном процессе, т.к. V = const;
A = p(V2 – V1) при изобарном процессе;
А
=
![]() при
изотермическом процессе;
при
изотермическом процессе;
A
= -ΔU
= -![]() CVΔT,
или
A
=
CVΔT,
или
A
=
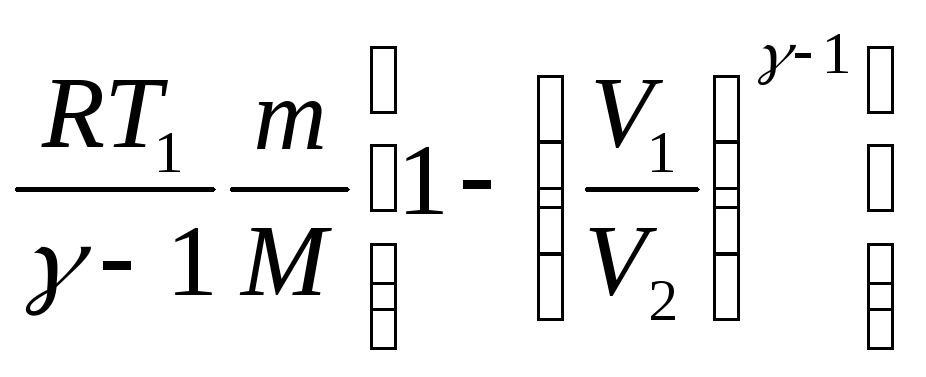 при
адиабатном процессе, где γ=
при
адиабатном процессе, где γ=![]() –
показатель адиабаты.
–
показатель адиабаты.![]()
![]()
Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе:
pVγ
=
const,
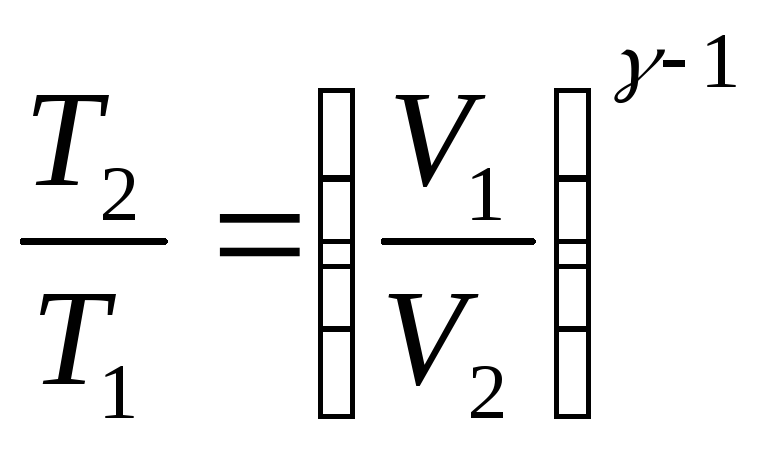 ,
,
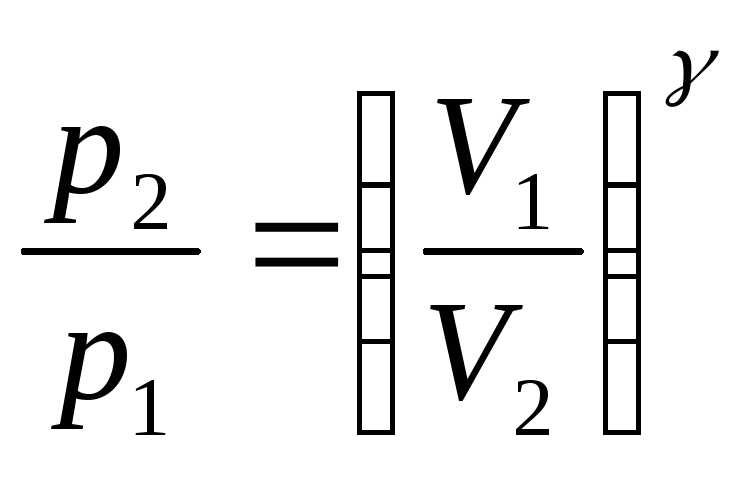 ,
,
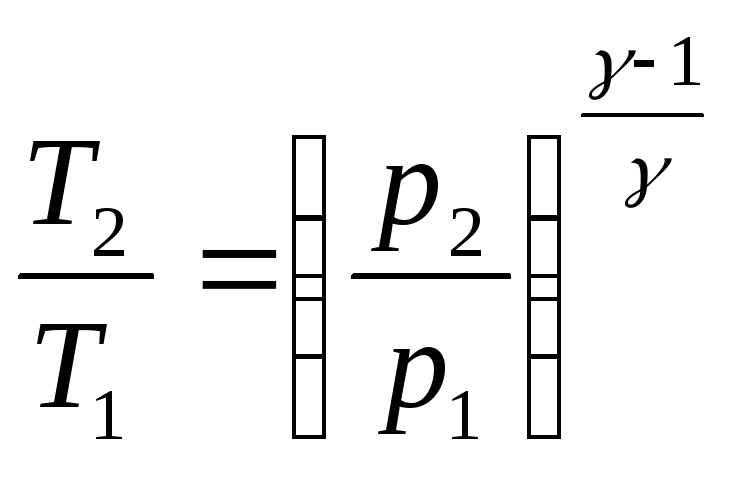 .
.
Термический коэффициент полезного действия (КПД) цикла
![]() ,
,
где Q1 – теплота, полученная рабочим телом от теплоотдатчика;
Q2 – теплота, переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно
![]() ,
,
где Т1 и T2 – термодинамические температуры теплоотдатчика и теплоприемника.
Закон Стефана-Больцмана
Re = σT4,
где Re – энергетическая светимость (излучательность) абсолютно черного тела; σ – постоянная Стефана-Больцмана; Т – термодинамическая температура Кельвина.
Закон смещения Вина
λm = b/T,
где λm – длина волны, на которую приходится максимум энергии излучения; b – постоянная Вина.
Количество
теплоты, проходящее через изотермическую
поверхность
![]() в единицу времени
в единицу времени![]() называетсятепловым
потоком
–
называетсятепловым
потоком
–
![]() ,[Вт=Дж/с].
Тепловой поток, проходящий через единицу
площади
,[Вт=Дж/с].
Тепловой поток, проходящий через единицу
площади
![]()
называют
плотностью
теплового потока
–
![]() [Вт/м2].
[Вт/м2].
Стационарная теплопроводность через плоскую стенку
 Рассмотрим
однородную плоскую стенку толщиной
Рассмотрим
однородную плоскую стенку толщиной
![]() (рис. ), на наружных поверхностях которой
поддерживаются постоянные температуры
(рис. ), на наружных поверхностях которой
поддерживаются постоянные температуры![]() и
и![]() .
Коэффициент теплопроводности стенки
постоянен и равен
.
Коэффициент теплопроводности стенки
постоянен и равен![]() .
В стационарном режиме
.
В стационарном режиме![]() и отсутствии внутренних источников
теплоты (
и отсутствии внутренних источников
теплоты (![]() )
дифференциальное уравнение теплопроводности
примет вид:
)
дифференциальное уравнение теплопроводности
примет вид:
![]()
При
заданных условиях температура изменяться
только в направлении оси
![]() ,
перпендикулярном плоскости стенки. В
этом случае
,
перпендикулярном плоскости стенки. В
этом случае
![]()
и
уравнение теплопроводности запишется
в виде:
![]() .
Запишем граничные условия: при
.
Запишем граничные условия: при![]() ;
при
;
при![]() .
.
Плотность теплового потока вычисляется по формуле
![]() ,
,
а уравнение температурной кривой имеет вид:
![]()
