
- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
Группу VII-А периодической системы составляют р –элементы F, Cl, Br, I и At. Их называют галогенами («солерождающие») за способность взаимодействовать с металлами с образованием солей (NaCl, KF и т.д.). F и Cl относят к типическим элементам, а Br, I и At составляют подгруппу брома.
Все галогены в свободном состоянии образуют двухатомные молекулы и являются неметаллами. Из них F2 и Cl2 – газы, Br2 – жидкость, I2 и At2 – твердые вещества. At – радиоактивный галоген, химические свойства которого подобны свойствам иода.
От F до At радиус атома возрастает, энергия ионизации снижается, поэтому ослабляются неметаллические свойства.
В этом же ряду снижается реакционная способность галогенов, поэтому предыдщий эл-т вытесняет последующий.
Br2 + 2 KI = I2 + 2 KBr
Фтор - получают электролизом расплава:
Фтор активен, т.к. молекула фтора имеет низкую диссациацию, а химическая связь в соединениях прочна, энергия активации реакций с участием фтора низка. Большинство Ме соединяются с фтором при обычных условиях, взаимодействие ограничивается образованием поверхностной пленки. Из неМе фтор непосредственно не реагирует с азотом, кислородом, углеродом (алмаз). С большинством простых соединений фтор реагирует активно. Реакции протекают со взрывом:
Фтороводород получают взаимодействием фтора с водородом:
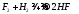
Взаимодействием плавикого шпата с серной конц. к-той:
CaF2 + H2SO4 = CaSO4 + HF
Химические свойства HF зависят от наличия/отсутстивия воды. Сухой HF не действует на большинство Ме и их оксидов. Если реакция начинается, то идет с самоускорением, т.к. образуется вода:
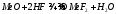
Неограничеснно растворяется в воде образуя плавиковую кислоту. Ее особенность реагировать с диоксидом кремния:
4 НF(г)+ SiO2 = SiF4 + 2 H2O
При взаимодействии плавиковой к-ты с фторидом кремния образуется сильная кремневодоодная к-та:
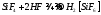
Хлор получают действием соляной к-ты на ок-ли:
Химическая активность хлора высока, он соединяется почти со всеми Ме и неМе кроме азота, кислорода, углерода и инертных газов:
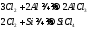
Хлор замещает водород в предельных УВ, и присоединяется к непредельным:
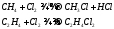
Взаимодействует с водой:
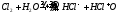
Хлороводород и соляная к-та
Хлороводород получают взаимодействием хлора и водорода:
Н2
+ Cl2
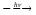 2HCl,
2HCl,
Действием конц. соляной к-ты на твердый хлорид калия:
KCl(т) + H2SO4(конц.) = KHSO4 + HCl
Хлороводород хорошо растворяется в воде с образованием соляной к-ты.
Соляная к-та – сильная, ее соли растворимы.
Кислородные соединения хлора
Т.к. хлор не взаимодействует с кислородом, получают косвенным путем (гидролизом хлора)
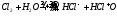
HClO хлорноватистая к-та, слабая, сильный окислитель. Ее соли гипохлориты сильные ок-ли, их получают взаимодействием хлора и щелочи:
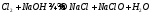
Хлорноватистая к-та в р-ре дает 3 типа превращения:
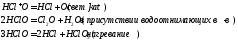
Эти процессы протекают одновременно, но их скорость зависит от условий. Т.к. распад по 3 пути идет при нагревании, то действие хлора на горячий р-р щелочи:
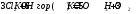
HClO3 хлорноватая к-та, сильная к-та и сильный ок-ль, но для ее солей хлоратов окислительные свойства выражены слабо.
Оксиды хлора
Cl2O оксид хлора(I) - ангидрид хлорноватистой к-ты.
Разлагается на свету:
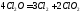
ClO2 ангидрид 2х кислот (HClO3 HClO2):
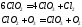
ClO3 ангидрид 2х кислот (HClO3 HClO4) легко димеризуется:
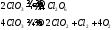
Сl2O7 ангидрид хлорной к-ты
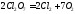
Все оксиды проявляют кислотные свойства, взаимодействие ClO2 с р-ром щелочей сопровождается образованием 2х к-т – хлорноватой и хлористой:
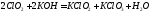
HClO2 хлористая к-та, мало устойчива при нагревании разлагается:
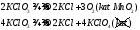
HClO4 - хлорная к-та самая сильная из всех известных к-т.




21. Общая характеристика d- элементов VII группы. Оксиды и гидроксиды марганца, зависимость проявления кислотно-основных свойств от степени окисления марганца. Кислоты, содержащие марганец и их соли. Получение и использование соединений подгруппы марганца.




