
- •ОбЩая химИя
- •Введение
- •Правила работы в лаборатории
- •Определение эквивалентной массы
- •Общие сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение эквивалентной массы металла Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение эквивалента карбоната натрия
- •Оборудование и реактивы
- •Выполнение работы.
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Исследование скорости химических реакций и химического равновесия
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Приготовление раствора и определение его концентрации
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Исследование гидролиза солей
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Приготовление буферного раствора
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8. Исследование растворимости солей
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 9. Исследование окислительно-восстановительных реакций
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 10. Исследование комплексных соединений
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. Определение энтальпии реакции нейтрализации
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. Определение теплоты растворения соли
- •Общие сведения
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Контрольные вопросы
1. Что такое буферный раствор?
2. На протекании каких реакций основано буферное действие?
3. Каковы основные типы буферных растворов?
4. Из каких основных компонентов состоит буферный раствор?
5. По какому уравнению вычисляется рН кислого буферного раствора?
6. По какому уравнению вычисляется рН основного буферного раствора?
7. Что такое интегральная буферная емкость?
8. Как экспериментально определить величину интегральной буферной емкости?
9. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости кислого буферного раствора по кислоте и по щелочи?
10. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости основного буферного раствора по кислоте и по щелочи?
Оборудование и реактивы
В лаборатории: рН-метр; бюретка объемом 100 мл – 4 шт (или мерные цилиндры); уксусная кислота – 0,2 М раствор, ацетат натрия – 0,2 М раствор, гидроксид натрия – 0,2 М раствор, хлорид аммония – 0,2 М раствор, соляная кислота для титрования – 0,05 н. раствор, гидроксид натрия для титрования – 0,05 М раствор. В штативе с реактивами: метилоранж. Получать в лаборантской: пипетка Мора объемом 5 мл – 2 шт., мерная или коническая колба объемом 100 мл – 2 шт., коническая колба для титрования объемом 50 мл – 2 шт., стакан химический объемом 100 мл – 4 шт., стакан химический объемом 50 мл – 2 шт., бюретка объемом 25 мл – 2 шт.; фенолфталеин.
Выполнение работы
I. Выбрать реактивы для приготовления буферного раствора.
Определение состава буфера с заданным рН начинают с подбора слабой кислоты или слабого основания таким образом, чтобы показатель их константы диссоциации отличался от заданного значения рН или рОН не более, чем на единицу в соответствии с формулой рKd = рН 1. При этом пользуются справочными данными.
II. Рассчитать объемы реактивов для приготовления буферного раствора.
Т.к. концентрации компонентов буферного раствора одинаковы, при расчете объемов компонентов можно пользовать в формуле расчета рН буферного раствора соотношение объемов компонентов.
Для ацетатного буферного раствора объемы кислоты и соли можно вычислить исходя из системы уравнений:
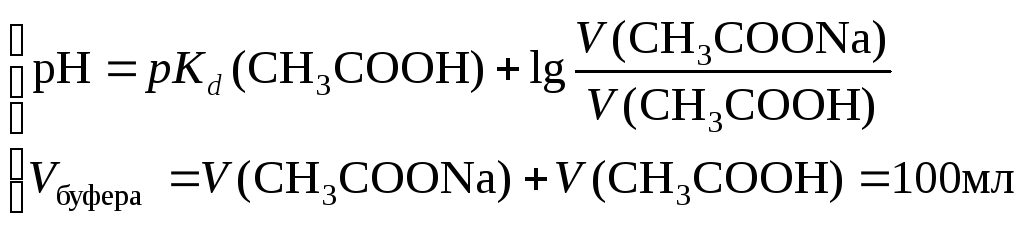 ,
pKd(CH3COOH)
= 4,756.
,
pKd(CH3COOH)
= 4,756.
Для аммиачно-хлоридного буферного раствора следует рассчитать объемы гидроксида натрия и хлорида аммония. Необходимый для формирования буферного раствора гидроксид аммония получится по реакции:
NH4Cl + NaOH = NH4OH + NaCl.
 ,
pKd(NH4OH)
= 4,752.
,
pKd(NH4OH)
= 4,752.
III. Приготовить буферный раствор и определить его рН
1. Рассчитанные в п. 2 объемы выбранных растворов отбирают с помощью бюретки на 100 мл и смешивают в колбе на 100 мл.
2. Пробу буферного раствора отобрать в химический стакан объемом 50 мл
3. Включить рН-метр.
4. Вынуть электрод рН-метра из раствора хранения и протереть его кусочком фильтровальной бумаги.
5. Опустить электрод рН-метра в химический стакан с пробой буферного раствора.
6. После того как показания прибора установятся, считать значение рН на экране рН-метра.
IV. Определить буферную емкость
Для ацетатного буфера определяютемкость по щелочи
1. В две конические колбы объемом 50 мл отбирают пипеткой по 5 мл буферного раствора.
2. К каждой пробе добавляют по 3−4 капли фенолфталеина
3. Титруют 0,05 М раствором NaOH до перехода окраски индикатора от бесцветной к розовой.
4. Записать объем титранта VТдля каждой пробы.
Для аммиачногобуфера определяютемкость по кислоте
1. В две конические колбы объемом 50 мл отбирают пипеткой по 5 мл буферного раствора.
2. К каждой пробе добавляют по 3−4 капли метилового оранжевого
3. Титруют 0,05 М раствором HCl до перехода окраски индикатора от желтой к красной.
4. Записать объем титранта VТдля каждой пробы.
