- •2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
- •3. Биосинтез хс. Схема процесса. Атеросклероз и связь нарушений метаболизма хс и липопротеинов.
- •4.Минеральные вещества крови (Са, р, Na, k, Fe). Участие в обмене.
- •1. Основные этапы биосинтеза белка. Роль нуклеиновых кислот, активация амк, рабочий цикл рибосомы.
- •2. Гетерополисахариды (классы гликозаминокликанов). Строение, распространение в организме. Биологическая роль.
- •3.Структура ферментов. Активный центр. Механизм обр-ия фермент-субстратного комплекса. Аллостерические участки, их биороль.
- •4. Состав молока и роль в питании растущего ор-ма. Сравнительная оценка состава коровьего и женского молока. Преимущества естественного вскармливания.
- •1. Свойства и биолоическая роль белков. Белки как гидрофильные коллоиды. Реакция осаждения белков, использование реакций осаждения в мед.Практике. Методы очистки и разделения белков.
- •2. Переваривание и всасывание у в жкт. Возрастные особенности. Судьба всосавшихся моносахаридов.
- •3. Понятие об энергии активации. Образование фs-комплекса. Принципы количественного определения активности ф. Единицы активности.
- •4.Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
- •1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белка. Св-ва б в ит.
- •2. Биосинтез и мобилизация гликогена, последовательность реакций. Биол.Роль. Регуляция активности фосфорилазы и гликогенсинтетазы.
- •3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
- •4. Содержание глюкозы в крови. Возрастные особенности.
- •1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
- •2. Анаэробный распад глюкозы. Последовательность р-ий, локализация. Биологическая роль.
- •3. Стероидные гормоны, представители. Механизм действия. Особенности биосинтеза стероидных гормонов.
- •4. Содержание белков в плазме крови, возрастные особенности.
- •2. Роль анаэробного и аэробного распада глюкозы в мышцах. Судьба молочной кислоты.
- •3. Кофакторы и их связь с витаминами. Типичные примеры.
- •4. Содержание остаточного азота в крови. Компоненты остаточного азота.
- •1. Белки. Классификация б. Характеристика сложных б. Хромопотеины, классификация, строение, распространение.
- •2. Аэробное окисление у, схема процесса. Образование пвк из глю, последовательность р-ий. Челночный механизм транспорта водорода.
- •3. Регуляция активности ф. Аллостерические механизмы, ограниченный протеолиз, хим.Модифиация ферментов. Биологическая роль регуляции активности ф.
- •4. Возврастные особенности состава крови (белки, остаточный азот, глюкоза).
- •1. Нуклеопротеины. Современные представления о структуре и функциях нуклеиновых кислот. Продукты их гидролиза.
- •2. Окислительное декарбоксилирование пвк. Последовательность реакций, связь с дыхательной цепью.
- •3. Активаторы и ингибиторы ферментов. Типы ингибирования. Применение ингибиторов в качестве лекарственных средств.
- •4. Минеральные вещества крови. Распределение между плазмой и эритроцитами.
- •1. Днк. Первичная, вторичная и третичная структуры. Биологическая роль днк.
- •2. Цикл трикарбоновых кислот, последовательность реакций, связь с дыхательной цепью. Биологическое значение.
- •3. Классификация ферментов. Важнейшие представители основных классов.
- •4. Содержание Са и р в плазме крови.
- •1. Рнк. Первичная и вторичная структура. Типы рнк, особенности строения, локализация в клетке. Биологическая роль.
- •2. Строение коэнзима а, участие в обмене веществ.
- •3. Энергетический обмен. Стадии катаболизма б, л, у. Источники восстановительных эквивалентов для электрон-транспортной цепи. Роль митохондрий в окислении водорода.
- •4. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •1. Гликопротеины. Их строение, классификация, представители. Биологическая роль.
- •2. Пентозофосфатный путь окисления глюкозы, основные этапы процесса. Биологическое значение цикла. Наследственные нарушения.
- •3. Митохондриальная цепь окисления кислорода. Образование электрохимического трансмембранного потенциала, его использование.
- •4. Анализ желудочного сока.
- •1. Липопротеины. Их строение, классификация. Состав и функции липопротеинов крови.
- •2. Роль печени в обмене углеводов. Глюконеогенез, субстраты для синтеза, схема реакций.
- •3. Тканевое дыхание, последовательность реакций. Продукция энергии в дыхательной цепи.
- •4. Формы кислотности желудочного сока.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Поддержание постоянства глюкозы в крови. Источники и пути расходования глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
- •3. Надн-оксидазная система: надн-зависимые дегидрогеназы, флавиновые дг, железосеоцентры. Строение, их роль в транспорте электронов.
- •4. Возрастные особенности желуд сока.
- •1. Заменимые и незаменимые амк. Потребность ор-ма в б в зависимости от возраста. Белковый минимум. Формы баланса азота в организме. Возрастные особенности.
- •2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
- •3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
- •4.Физико-химические показатели мочи. Возрастные особенности.
- •1. Переваривание белков в жкт. Промежуточные и конечные продукты гидролиза белков. Использование амк в тканях.
- •2. Сахарный диабет. Характер нарушений обменных процессов при сах.Диабете. Нарушение уранатного пути использования глюкозы как основа нарушений структуры гликозаминогликанов.
- •3. Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента р/о. Разобщение окисления и фосфорилирования в дых.Цепи.
- •4. РН мочи в норме и при патологии.
- •1. Процессы превращения аминокислот в толстом кишечнике под влиянием гнилостных бактерий. Обзвреживание проуктов гниения.
- •2. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, фруктоземия, непереносимость дисахаридов. Гликоген- и агликогенозы
- •3. Окислительное и субстратное фосфорилирование в процессе биологического окисления.
- •4. Пигменты мочи и их происхождение.
- •2. Современные данные об активных формах углеводов, жирных кислот и аминокислот.
- •3. Надн – оксидазная система: убихинон, цитохромы. Строение, их роль в транспорте электронов
- •4.Органические вещества мочи, их происхождение.
- •1. Роль нуклеиновых кислот в биосинтезе белка. Характеристика генетического кода. Строение и роль т-рнк.
- •2.Взаимосвязь белкового, углеводного и липидного обменов. Роль ключевых метаболитов глюкозо-6-фосфатов, пировинограной кислоты и ацетил-КоА.
- •3. Образование со2 в процессах биологического окисления. Типы декарбоксилирования в цтк.
- •4. Азотсодержащие вещества мочи. Возрастные особенности.
- •1.Основные этапы биосинтеза белков (активация амк, фазы трансляции, участие рибосом).
- •2. Липиды, классификация и распространение. Химическая природа, свойства и биол.Роль триацилглицеридов.
- •3. Микросомальное и митохондриальное окисление. Сходства и различия. Пути использования кислорода. Токсичность кислорода. Механизмы защиты.
- •4. Содержание мочевой кислоты в крови. Причины гиперурикемии.
- •1.Современные представления о регуляции биосинтеза белка. Регуляция действия генов. Строение и функционирование лактозного оперона. Индукция и репрессия синтеза белков в организме человека.
- •2.Классификация глицеролипидов, хим строение и биологическая роль в организме
- •3. Витамины и их значение в жизнедеятельности человека. Классификация. Участие в обмене веществ.
- •4. Индикан мочи,значение исследования.
- •1.Основные типы превращений аминокислот в тканях(дезаминирование, трансаминирование. Декарбоксилирование)
- •3.Витамин с. Химическая природа, распространение. Участие в обменных процессах.
- •4.Парные соединения мочи.
- •1.Непрямое дезаминирование аминокислот, биологическое значение. Роль глутаматдегидрогеназы. Виды аминотрансфераз, их специфичность.
- •3.Витамин в1. Химическая природа, распространение, участие в обменных процессах.
- •4.Минеральные вещества мочи.
- •1.Образование и обезвреживание аммиака. Биосинтез мочевины, последовательность реакций. Роль печени в мочевинообразовании. Возрастные особенности.
- •3.Витамин в2. Химическая природа, распространение, участие в обменных процессах.
- •4.Реакции на патологические составные части мочи(белок. Глюкоза, кровь, ацетоновые тела). Методы экспресс-диагностики.
- •1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
- •2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
- •3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
- •4.Способы определения белка в моче.
- •1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
- •2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
- •3.Витамин в6. Химическая природа, распространение, участие в обменных процессах.
- •4.Глюкозурия и ее причины.
- •1.Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина и меланинов. Наследственные нарушения обмена фенилаланина и тирозина ( фенилкетонурия, алкаптонурия).
- •2.Окисление высших жирных кислот. Последовательность реакций бета-окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью.
- •3.Витамин а. Химическая природа, распространение, участие в обменных процессах.
- •4.Соединительная ткань. Классификация. Клеточные элементы. Основные белки соединительной ткани. Межклеточный матрикс, представление о гликопротеинах соединительной ткани.
- •4.Кетонурия и ее причины.
- •2.Буферные системы крови. Роль буферных систем в поддержании гомеостаза pH. Кислотно-основное состояние. Понятие об ацидозе и алкалозе.
- •3.Функции почек. Транспорт веществ в процессе секреции и реабсорбции. Реабсорбция глюкозы, аминокислот, профильтровавшихся белков. Пороговые и беспороговые вещества.
- •4.Фенилкетонурия, алкаптонурия. Причины их возникновения.
- •Транспорт
4.Фенилкетонурия, алкаптонурия. Причины их возникновения.
ФКУ. фенилпировиноградная олигофрения. Развивается как ре-т потери способности организма синтезировать фенилаланин-4-монооксигеназу, катализирующую превращение фен и тир. Резкое замедление умственного развития ребенка, экскреция с мочой большого кол-ва фенил ПВК(до 1-2г/сут), и фенилацетилглутамина(2-3г/сут), накопление фен в тканях. Его кол-во в крови при норме 15мг/л – до 600мг/л, в СМЖ до 80 при норме 1,5. Предотвращение: исключение фен с пищей с самого рождения.
фен→ фен-гидроксилаза × Тир×катехолаины
↓ ×тиреоид.Г
фенил-ПВК → фенилацетат ×меланины
→ фениллактат
Алкаптонурия. Экскреуия с мочой больших кол-в гомогентизиновой к-ты(до 0,5г/сут), окисление которой О2 воздуха придает моче темную окр. Охроноз, отложение пигмента в тканях и потемнение носа, ушей, склеры. Врожд.дефект связан с отсутствием печени и почках оксидазы гомогентизиновой к-ты.
Билет№32
Биосинтез пуриновых нуклеотидов. Роль фолиевой кислоты. Синтез дезоксирибонуклеотидов, роль системы тиоредоксина. Синтез нуклеотидтрифосфатов.
Роисхождение атомов пуринового кольца:
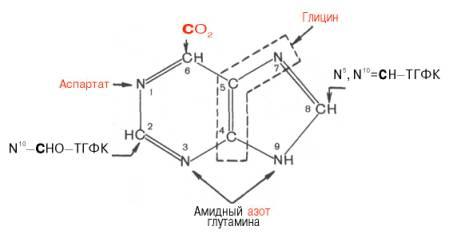
Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре имеют своим источником глицин. Два атома азота (N-3 и N-9) происходят из амидной группы глутамина, один атом азота (N-1) – из азота аспара-гиновой кислоты; углеродный атом (С-2) происходит из углерода N10-фор-мил-ТГФК, атом углерода в 8-м положении – из N5,N10-метенил-ТГФК и, наконец, углерод С-6 имеет своим источником СО2.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих моно-нуклеотидов участвуют по два фермента, различных по своему механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукцинат-лиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно представить в виде химических реакций.
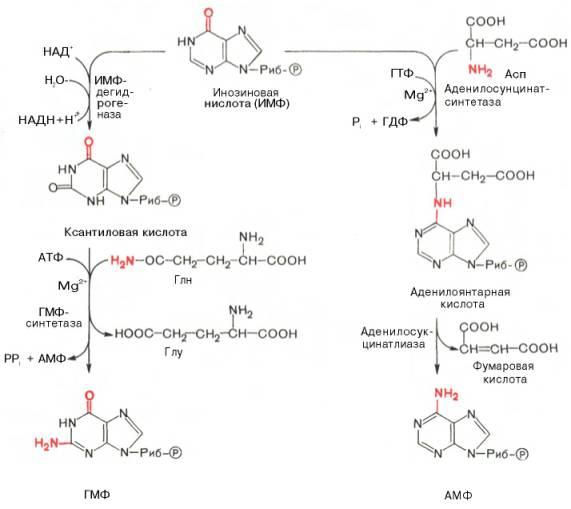
В ферментативном синтезе АМФ из ИМФ специфическое участие принимает аспарагиновая кислота, являющаяся донором NH2-группы, и ГТФ в качестве источника энергии; промежуточным продуктом реакции является аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с де-гидрогеназной реакции ИМФ с образованием ксантозиловой кислоты; в аминировании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклео-зидтрифосфаты также протекает в 2 стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ :
ГМФ + АТФ <=> ГДФ + АДФ; ГДФ + АТФ <=> ГТФ + АДФ.
Фолиевая кислота. Вит.Вс
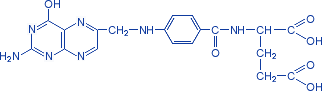
Ее активная форма – ТГФК нужна на этапе синтеза ИМФ.
Синтез дезоксирибонуклеотидов из нуклеотидтрифосфатов
В самом начале процесса происходит потеря рибонуклеозидтрифосфатами одной фосфатной группы и образуются АДФ, ГДФ, ЦДФ, УДФ.
Во второй реакции фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин, его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Депонирование и мобилизация жиров в жировой ткани.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры — наиболее долговременные и более эффективные источники энергии . При голодании запасы жира у человека истощаются за 5—7 недель, тогда как гликоген полностью расходуется примерно за сутки. Если поступление жира превышает потребности организма в энергии , то жир депонируется в адипоцитах — специализированных клетках жировой ткани. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то часть глюкозы также превращается в жиры . Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
1.поступают из хиломикронов, которые приносят экзогенные жиры из кишечника
2.поступают из ЛОНП, которые транспортируют эндогенные жиры, синтезированные в печени из глюкозы
3.образуются из глюкозы в самих клетках жировой ткани.
В первом и во втором случае жиры в составе липопротеинов гидролизуются ЛП—липазой и в клетку поступают жирные кислоты, которые затем используются для синтеза ТАГ. Перед включением в ТАГ жирные кислоты сначала активируются путем образования тиоэфиров кофермента А, а затем взаимодействуют с глицеролфосфатом. Так как глицерол не может быть фосфорилирован в адипоцитах (в этих клетках отсутствует глицеролкиназа), то глицеролфосфат образуется при восстановлении диоксиацетонфосфата.
Следовательно, синтез ТАГ может протекать только в присутствии глюкозы, из которой в процессе гликолиза образуется диаксиацетонфосфат. Инсулин стимулирует синтез ТАГ, потому что в его присутствии повышается проницаемость мембран клеток жировой ткани для глюкозы.
Мобилизацию (липолиз) депонированных ТАГ катализирует тканевая липаза. В результате жиры распадаются на глицерин и свободные жирные кислоты.
Адреналин и глюкагон активируют внутриклеточную липазу. Действие этих гормонов опосредовано аденилатциклазным каскадом реакций, начиная с активации аденилатциклазы и заканчивая фосфорилированием липазы, которая при этом переходит в активную форму и расщепляет эфирные связи в ТАГ. Глицерол как растворимое в плазме вещество транспортируется в печень, где используется в реакциях глюконеогенеза. Жирные кислоты транспортируются кровью в виде комплексов с сывороточными альбуминами в разные органы и ткани, где включаются в процесс окисления.
Ферменты сыворотки крови. Классификация. Диагностическое значение их определения.
1)Плазмоспецифические(секреторные)
2)Экскреторные
3)Индикаторные(клеточные)
Активность ферментов определяется для правильной постановки топического диагноза; для проведения дифференциальной диагностики; для оценки эффективности лечения; для определения прогноза у пациента.
Гиперферментемия:
увеличение проницаемости клет.мембран
деструкция клет.мембран
активация синтеза белков-ферментов
нарушение выведения белков-ферментов с желчью или мочой.
Гипоферментемия – снижение активности в пл.крови:
активный захват ферментов клетками РЭС
нарушение синтеза б-ферментов вследствие алиментарных причин (белковое голодвние), недостаточеого поступления витаминов, микроэл-тов(Fe, Cu, Mg, Mn..), выполняющих роль коферментов.
Плазмаспецифические.
Синтезируются в печени; биологич.роль выполняют в плазме крови, поэтому диагностич.значение имеет только понижение активности данных ф.
ЛХАТ лецитин-холестерин-ацил-трансфераза
Осущ.р.этерификации ХС в стр-ре альфа-липопротеинов.
ЛП-липаза(ф-р просветления)
Уч.в гидролизе триглицеридов в стр-ре ХМ и ЛПОНП(пре-бета-ЛП)
Псевдохолинэстераза
Участ.в расщеп.ацетилхолина, бутирилхолина. Диагностич.значение имеет при б.Боткина и при отравлении фосфоорганич.соединениями(активность резко снижается)
Б. Лизоцим – фактор неспецифической резистентности организма
Церулоплазмин(медь-содержащая оксидаза)
Экскреторные ферменты.
Синтезируются в печени, поджел., слюн.железах. физиологич.роль выполняют в ЖКТ. Диагностич.значение имеет только повыш.активности: поступ.в кровь, где и обнаруживаются.
Альфа-амилаза. Осущ.гидролиз крахмала и глк (через стадии образования декстринов до мальтозы)
Повыш.: патологии поджел.ж., слюн.железы(паротит), заболев.легких.
Щелочная фосфатаза(фосфомоноэстераза первого типа)
Ф.образуется в печени;выходит в ЖКТ, где осущ.гидролиз моноэфиров.
Увелич.: закупорка желчевыв.протоков(ж/к болезнь), патологии костной системы
Лейцин-аминопептидаза. Ф.поджед.железы, гидролизующий короткоцепочечные пептиды. Увелич.: пат.подж.ж.(наруш.процесс выхода в ЖКТ)
Индикаторные ферменты.
Диагностич. Значение имеет только повыш.активности. роль выполняют непосредственно в клетке. Вследствие нарушения проницаемости клет.мембран она обнаруж-ся в плазме крови.
Цитоплазматические:
- АлАТ
- КФК и ее изоферменты (креатин-киназа, ММ, МВ, ВВ)
- лактат-ДГ и ее изоферменты
- альдолаза
Митохондриальные:
- АсАТ
- орнитин-карбамоил-трансфераза
- цитохром-оксидаза
- глутамат-ДГ
Лизосомы:
- протеолитические белки-катепсины h, b, l-классы
- кислые фосфатазы
- виды нуклеаз(ДНКаза, РНКаза)
Роль воды в организме. Содержание и распределение воды в тканях. Возрастные особенности. Регуляция водного обмена.
Вода организма образует 2 водных пространства: внутриклеточное(2/3общей воды) и внеклеточное(1/3). Небольшое кол-во воды входит в жидкости полостей тела: боюшной, плевральной и т.п., а также в цереброспинальную, анутриглазную, внутрисуставную жид.. Внеклеточное пр-во включает: 1) внутрисосудистый вод.сектор, т.е. плазму крови, объем к-рой сост.8%общей воды, и 2) интерстициальный вод.сектор, содержащий ¼ всей воды(15%массы тела) и являющийся наиб.подвижным при избытке или недостатке воды в теле.
25%-интерстициальная жидкость
8%-плазма (внутрисосудистый фактор)
67%-внутриклеточная жидкость.
Вода является основным веществом, из которого состоит организм человека.
Содержание воды в теле зависит от возраста, пола, массы тела. У здорового взрослого мужчины массой 70 кг общее содержание воды в организме составляет около 60% массы тела, т.е. 42 л. У женщин общее количество воды в организме приближается к 50% массы тела, т.е. меньше, чем у мужчин, что обусловлено большим содержанием бедной водой жировой ткани и меньшим – мышечной. У новорожденного ребенка содержание воды в теле достигает 80% массы тела и затем с возрастом постепенно уменьшается вплоть до старости. Это – одно из проявлений старческой инволюции, зависящее от изменения свойств коллоидных систем (снижение cпособности молекул белков связывать воду) и от возрастного уменьшения клеточной массы, главным образом мышечной ткани. Общее содержание воды зависит также от массы тела: у тучных оно меньше, чем у лиц с нормальной массой тела, у худых – больше. Это связано с тем, что в жировой ткани воды значительно меньше, чем в тощих тканях (не содержащих жира).
Вода выполняет важные функции в организме:
- Она является обязательной составной частью всех клеток и тканей.
- Выступает в роли универсального растворителя органических и неорганических веществ.
- В водной среде протекает большинство химических реакций, т.е. процессов обмена веществ,
лежащих в основе жизнедеятельности организма.
- Она участвует в транспорте субстратов, необходимых для клеточного метаболизма, и выведении из организма вредных продуктов обмена веществ.
- Вода определяет физико-химическое состояние коллоидных систем, в частности дисперсность белков, что обусловливает их функциональные особенности.
Регуляция
Осмотическая регуляция.
Поступление воды в организм обеспечивается изменением питьевого поведения, которое зависит от чувства жажды. Центр жажды составляют нейроны ряда областей головного мозга: образований, окружающих 3-й желудочек, преоптической зоны и гипоталамуса. Их особенностью является наличие больших вакуолей, заполненных жидкостью с определенной осмоляльностью. Таким образом, в формировании жажды принимают участие различные системы гипоталамических нейронов, интегрирующие сенсорные влияния, обусловленные видом и вкусом воды с внутренними сигналами, идущими от осморецепторов, локализованных в перижелудочковой, преоптической зонах и в гипоталамусе. Система сравнения, расположенная около нейронов СОЯ, может контролировать их активность и таким образом оказывать влияния на высвобождение АДГ
Волюмическая регуляция, важнейший механизм сохранения вводно-электролитного баланса, также участвует в формировании жажды. Волюморецепторы каротидного синуса и дуги аорты и барорецепторы
предсердий, устьев полых вен и легочной вены реагируют соответственно на изменения объема и давления циркулирующей крови.
В реализации осмо- и волюморефлексов - основных инструментов регуляции осмотического гомеостаза участвуют гуморальные механизмы.
Гуморальная регуляция вводно-электролитного обмена осуществляется гормонами и местно образующимися физиологически активными веществами, в частности простагландинами Е. Основными гормонами, регулирующими осмотический гомеостаз, являются вазопрессин (АДГ), гормоны РААС
(ангиотензин-2 и альдостерон), ПНУФ (атриопептин).
Аргинин – вазопрессин (ВП), или антидиуретический гормон (АДГ), представляет собой нонапептид, образующийся нейроэндокринными нейронами супраоптического (СОЯ), паравентрикулярного (ПВЯ) и ряда добавочных ядер гипоталамуса.
Активация ВП-нейронов возникает при увеличении осмоляльности плазмы крови на 1-2 % и при гиповолемии за счет импульсов от осмо- и волюморецепторов.
Основной эффект ВП можно свести к эуосмии - поддержанию осмотического давления крови и тем самым межклеточной жидкости, что создает условия для сохранения стабильного объема клеток в организме, определяющего их эффективное функционирование, и установлению соответствия объема
циркулирующей крови емкости сосудистого русла.
Главным органом-мишенью для гормонов – регуляторов водно-электролитного обмена являются почки. Основное значение ВП связано с регуляцией конечного этапа реабсорбции воды в почечных канальцах.
Билет№33
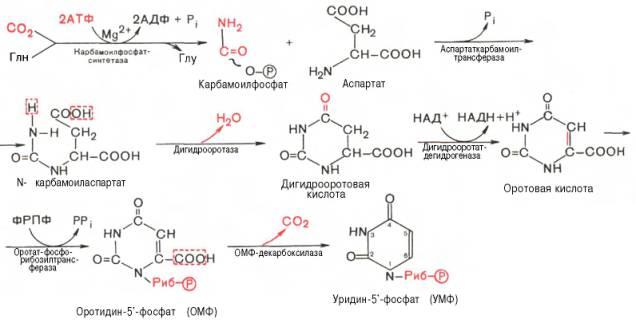
Биосинтез пиримидиновых нуклеотидов. Особенности синтеза тимидиловых нуклеотидов, тимидилатсинтетаза, роль тетрагидрофолиевой кислоты (ТГФК). Нарушения синтеза пиримидиновых нуклеотидов.
В клетках животных и микроорганизмов промежуточными продуктами синтеза не являются свободные пиримидиновые основания, и остаток рибозы присоединяется к уже сформировавшемуся пиримидиновому кольцу.
Последовательность химических реакций синтеза пиримидиновых нук-леотидов, в частности УМФ, можно представить в следующем виде:
Биосинтез тимидиловых нуклеотидов. Тимидиловые нуклеотиды входят в состав ДНК, содержащей дезоксирибозу. Поэтому сначала рассмотрим механизмы синтеза дезоксирибонуклеотидов. При помощи метода меченых атомов было показано, что этот синтез начинается не со свободной дезоксирибозы, а путем прямого восстановления рибонуклеотидов у 2'-го атома углерода. При инкубации меченых предшественников (рибонуклео-тидов) в бесклеточной системе бактерий метку обнаружили в составе дезоксирибонуклеотидов. По данным П. Рейхарда, у Е. coli все 4 рибо-нуклеозиддифосфата восстанавливаются в соответствующие дезоксиана-логи: dАДФ, dГДФ, dЦДФ, dУДФ – при участии сложной ферментной системы, состоящей по меньшей мере из четырех разных ферментов.
Химический смысл превращения рибонуклеотидов в дезоксирибо-нуклеотиды сводится к элементарному акту – восстановлению рибозы в 2-дезоксирибозу, требующему наличия двух атомов водорода. Непосредственным источником последних оказался восстановленный термостабильный белок тиоредоксин, содержащий две свободные SH-группы на 108 аминокислотных остатков. Тиоредоксин легко окисляется, превращаясь в дисульфидную S-S-форму. Для его восстановления в системе имеется специфический ФАД-содержащий фермент тиоредоксинредуктаза (мол. масса 68000), требующая наличия восстановленного НАДФН. Обозначив условно рибонуклеозиддифосфат РДФ, образование дезоксирибонуклео-тидов можно представить следующим образом:
Обе стадии могут быть представлены в виде схемы:
Для синтеза тимидиловых нуклеотидов, помимо дезоксирибозы, требуется также метилированное производное урацила – тимин. Оказалось, что в клетках имеется особый фермент тимидилатсинтаза, катализирующая метилирование не свободного урацила, а dУМФ; реакция протекает по уравнению:
Донором метильной группы в тимидилатсинтазной реакции является N5,N10-метилен-ТГФК, которая одновременно отдает и водородный протон, поэтому одним из конечных продуктов реакции является не тетра-гидро-, а дигидрофолиевая кислота (ДГФК). Последняя вновь восстанавливается до ТГФК под действием НАДФН-зависимой дигидрофолат-редуктазы. Из образовавшегося ТМФ путем фосфотрансферазных реакций образуются dТДФ и dTТФ.
Синтез всех остальных дезоксирибонуклеозид-5'-трифосфатов, непосредственно участвующих в синтезе ДНК, также осуществляется путем фосфорилирования дезоксирибонуклеозид-5'-дифосфатов в присутствии АТФ:
АТФ + dАДФ –> АДФ + dATФ; АТФ + dЦДФ –> АДФ + dЦТФ;
АТФ + dГДФ –> АДФ + dГТФ; АТФ + dТДФ –> АДФ + dТТФ.
Механизмы защиты от активных форм кислорода. Ферментные и неферментные звенья антиоксидантной защиты.
Молекулярный кислород сам по себе обычно не вступает в неконтролируемые химические реакции внутри организма, для его активации нужны ферментативные процессы – главные ферменты метаболизма кислорода у млекопитающих: оксидазы и оксигеназы. Но в каталитических центрах этих ферментов кислород испытывает превращения до конечных соединений, не выделяясь в среду и не подвергая опасности органические макромолекулы клетки, повреждающими же агентами являются активные формы кислорода (АФК), образующиеся в ряде физико-химических процессов в организме.
Во всех аэробных клетках в процессе присоединения одного электрона к молекуле кислорода образуются супероксидный анион-радикал - О2- и его протонированная форма – гидроперекисный радикал - НО2*; оба они порождают ряд других активных форм кислорода. Образование этих АФК наиболее существенно вблизи цепей переноса электронов – дыхательная цепь, микросомы и, в растительных клетках, хлоропласты.
Гидроперекиси липидов являеются весьма активными соединениями и обладают высокой биологической агрессивностью. Для протекания цепного окисления липидов в биологических мембранах совершенно необходимы переходные металлы, в частности, ионы железа.
Простым и доступным методом определения продуктов перекисного окисления липидов является реакция с тиобарбитуровой кислотой (Marcuse, Johnston, 1973). Главным механизмом защиты организма от данных форм АФК является фермент супероксиддисмутаза (СОД), активность ее обычно достаточна, чтобы инактивировать их в месте образования, не допуская диффузии в среде макромолекул ткани.
Дисмутация супероксидных анион-радикалов под действием СОД в биологических тканях ведет к образованию перекиси водорода, способной легко проникать через мембраны клеток. Перекись водорода обнаруживается при фагоцитозе, при работе митохондрий и микросом. В присутствии ионов переходных металлов (например Fe2+) перекись водорода может давать высоко активный гидроксильный радикал (* ОН). Этому процессу препятствуют главные высоко активные ферменты антиоксидантной защиты организма: каталаза и глутатион-пероксидаза.
Высокой реакционной способностью обладает гидроксильный радикал (* ОН), образующийся из перекиси водорода в присутствии ионов переходных металлов. Высокая реакционная способность определяет преимущественно местное воздействие этой форм АФК. Прямое повреждение ДНК при этом характеризуется разрывом цепи (180); с другими биомолекулами * ОН образует вторичные свободные радикалы, в том числе перексиные соединения липидов.
Главные типы повреждений биомолекул * ОН: отрыв атома водорода (таким образом повреждается лецитин – главный компонент биологических мембран, а также сахара в составе нуклеозидов ДНК); присоединение к молекулам по двойным связям (взаимодействие с пуринами и пиримидинами ДНК и РНК, в том числе с образованием вторичных радикалов); перенос электронов также является патогенным механизмом действия * ОН.
ЗАЩИТА ОРГАНИЗМА ОТ АФК
СУПЕРОКСИДДИСМУТАЗА (СОД). Супероксиддисмутаза является важнейшим элементом антиоксидантной защиты организма. Это фермент из двух субъединиц с общей молекулярной массой 32 кДа, содержащий по одному атому меди и цинка (существует также марганец-содержащая СОД, обнаруженная в печени крысы и человека; в бактериальных клетках обнаружена железо-содержащая СОД). Фермент ускоряет распад О2- на 4 порядка.
Источником О2- обычно является система феназинметасульфат + НАД*Н или ксантин + ксантиноксидаза. За единицу активности СОД принято ее количество, тормозящее в 2 раза восстановление цитохрома с при реакции ксантиноксидазы (0,003 ед/мл), ксантина (2 мкмоль/мл) и цитохрома с - 0,6 мкмоль/мл
КАТАЛАЗА. Каталаза расщепляет перекись водорода, до которой дисмутирует супероксидный радикал, до молекул воды и молекулярного кислорода. В клетках каталаза в основном сосредоточена в пероксисомах, в которых содержатся и ферменты, продуцирующие перекись водорода, необходимую в ходе ряда процессов жизнедеятельности организма, в частности, в процессах неспецифической иммунной защиты.
ПЕРОКСИДАЗА. Пероксидаза, в особенности глутатион-пероксидаза, широко распространена в клетках животных и растений. Глутатион-пероксидаза состоит из 4 субъединиц в каждой из которых содержится по молекуле селена. В клектах этот фермент располагается в цитозоле и матриксе митохондрий.
Активность глутатион-пероксидазы зависит от содержания глутатиона клетки, что, в свою очередь, определяется активностью глутатионредуктазы и концентрацией НАДФ*Н, который образуется в пентозофосфатном метаболическом цикле. Лимитирующими органами по активности каталазы, являются легкие, мышцы, глаза.
ДРУГИЕ ФОРМЫ ЗАЩИТЫ ОТ АФК
В защите от АФК в организме участвуют и многие другие молекулы и ферментные системы.
Аскорбиновая кислота инактивирует свободные радикалы, образуя неактивный радикал (семидегидроаскорбат), она же является кофактором пероксидазы, (фермент аскорбат-пероксидаза).
Глутатион, присутствуя в клетках в высоких концентрациях, также является акцептором гидроксильного иона и синглетного кислорода, кроме того, он же является кофактором глутатион-пероксидазы и глутатион-редуктазы. Мочевая кислота присутствует в крови в достаточных количествах, чтобы эффективно акцептировать синглетный кислород и гидроксильный радикал. Аналогичными эффектами обладают этанол, маннит, глюкоза и некоторые другие органические молекулы.
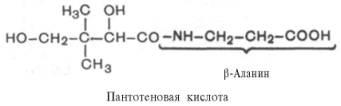
Пантотеновая кислота. Химическая природа, распространения, участие в обменных процессах.
 2,4-диокси-3,3-диметилмасляная
кислота
2,4-диокси-3,3-диметилмасляная
кислота
Витамин В5/антидерматитный. Суточная потребность – 3-5мг; источник – печень, дрожжи, желток, зеленые части растений. Активная форма – коэнзим А(ацетилированная форма кофермента А)
Биол. роль пантотеновой кислоты обусловлена ее участием в биосинтезе кофермента А (КоА, KoASH; ф-ла II)-мол.м. 767,54; бесцв. кристаллы; хорошо раств. в воде; 260 нм (рН 2); 14,6·103. КоА-акцептор и переносчик разл. кислотных остатков (см. Коферменты). Реакционноспособной частью молекулы КоА является концевая сульфгидрильная группа. Ацильные группы присоединяются к коферменту при помощи тиоэфирной связи. Своб. энергия гидролиза ацил-КоА имеет большую отрицат. величину (напр., для гидролиза ацетил-КоА она составляет 31,4 кДж/моль). Таким образом кофермент переносит ацильные группы, подобно тому как АТФ переносит активир. фосфорильные группы. Для КоА характерно тиолдисульфидное взаимод. (RS—SR + + R'SHRS—SR' + RSH), а также регуляторные воздействия на ряд ферментативных р-ций (особенно на регулирующих соотношение КоА/ацил-КоА).
Гиповитаминоз: дерматиты, поражения слизистых оболочек, дистрофии желез внутр.секреции(надпочечники) и НС(невриты, параличи), изменения в сердце и почках, депигментация волос, прекращение роста, потеря аппетита.
Гомеостатическая функция почек. Участие почек в регуляции КОС. Процессы ацидо- и аммониогенеза. Титруемая кислотность мочи. Аммонийные соли.
Роль почек в осмо- и волюморегуляции. Почки являются основным органом осморегуляции. Они обеспечивают выделение избытка воды из организма в виде гипотонической мочи при увеличенном содержании воды (гипергидратация) или экономят воду и экскретируют мочу, гипертоническую по отношению к крови, при обезвоживании организма (дегидратация).
После питья воды или при ее избытке в организме снижается концентрация растворенных осмотически активных веществ в крови и падает ее осмоляльность. Это уменьшает активность центральных осморецепторов, расположенных в области супраоптического ядра гипоталамуса, а также периферических осморецепторов, имеющихся в печени, почке и других органах, что приводит к снижению секреции АДГ нейрогипофизом и увеличению выделения воды почкой.
При обезвоживании организма или введении в сосудистое русло гипертонического раствора NaCl увеличивается концентрация осмотически активных веществ в плазме крови, возбуждаются осморецепторы, усиливается секреция АДГ, возрастает всасывание воды в канальцах, уменьшается мочеотделение и выделяется осмотически концентрированная моча.
Помимо осмо- и натриорецепторов, уровень секреции АДГ определяет активность волюморецепторов, воспринимающих изменение объема внутрисосудистой и внеклеточной жидкости.
Роль почек в регуляции ионного состава крови. Почки являются эффекторным органом системы ионного гомеостаза. В организме существуют системы регуляции баланса каждого из ионов. Для некоторых ионов уже описаны специфические рецепторы, например натриорецепторы. Рефлекторная регуляция транспорта ионов в почечных канальцах осуществляется как периферическими, так и центральными нервными механизмами.
Роль почек в регуляции кислотно-основного состояния.
1)поддержание нормальной концентрации бикарбонатов крови: полная реабсорбция бикарбоната; образование доп.кол-в бикарбоната.
2)избирательная экскреция: оснований(в форме бикарбонатов и двузамен.фосфатов), кислот(в форме титруемых к-т и аммонийных солей)
Образование аммонийных солей.
Кровь просвет канальца
NaCl-←NaCl
Na+ ←Na+ ↓
HCO3←NCO3-←H2CO3→H+→ H+→NH4
Глутамин(1)→глутамат → 2*NH3→ NH3→
↓(2)
альфа-КГ ↓
NH4Cl
экскреция 30-50ммоль
(1)глутаминаза, (2)глутамат-ДГ.
Аммиак в просвете - буфер.осн.для связывания ионов Н+ с образованием аммонийного иона – аммониогенез. рН мочи в норме = 6,0 – 6,5.
Ацидогенез
Ацидогенез. Роль почек в сохранении КОС заключается в выведении из кислой крови Н + и из основной — НСО3. В клетках почечных канальцев под воздействием карбоангидразы происходит реакция
СО2 + Н2О -> Н2СО3
Н2СО3 диссоциирует на Н+ и НСО3В канальцевую мочу поступает бикарбонат натрия, который диссоциирует на Na и НСО3. Н+ из клеток почечных канальцев поступают в канальцевую мочу и, соединясь с НСО3, образуют Н2СО3, из которой диссоциируют Н2О и СО2. В свою очередь, натрий из канальцевой мочи поступает в канальцевые клетки и, соединяясь с НСО3, в виде бикарбоната натрия поступает в венозную кровь капилляров канальцев. СО2, образовавшийся в канальцевой моче, поступает в канальцевые клетки, где также под влиянием карбоангидразы и реакции С02 + Н20 образуется угольная кислота Н2СО3, которая диссоциирует на Н+ и НСО3
В канальцевой моче содержится соль фосфата натрия (Na2HPO4), которая диссоциирует на Na+ и НРО4. Na из канальцевой клетки перемещается в канальцевую мочу, где образуется NaH2PO4 — кислая соль фосфата натрия, которая выводится с мочой. Na+ из канальцевой мочи перемещается в канальцевые клетки, где соединяется с НСО3 и в виде NaHCO3 поступает в венозную кровь капилляров канальцев.
Титруемую кислотность мочи определяют титрованием ее 0,1 н. NaOH. Титрование продолжают до тех пор, пока рН мочи не достигнет величины рН плазмы крови (7,4). Конец титрования определяют выравниванием цвета мочи с исходным цветом буфера (в состав буфера входит моно- и дифосфат). Израсходованное на титрование количество щелочи делят на 10, умножают на суточное количество мочи. Таким образом, определяют количество титруемых кислот, выделенных за сутки в мл 0,1 н. раствора NaOH.
Билет№34
Распад хромопротеинов в тканях. Фазы превращений билирубина. Исследование желчных пигментов с диагностической целью.
У взрослого человека 700-900г гемоглобина; ежесут.распад.0,01часть, т.е 8-9г. Нв превращ.в желчные пигменты.
Осн. Поставщик – эритроциты, которые живут 120дней;при их разруш. Гемогл. →в кровь.
В крови Нв встреч.с белком гаптоглобином(Нр):
Это гемопротеин, транспорт-ся с альфа-2-глобул.фракцией, имеет 2 центра связывания с Нв и в комплексе с Нв не вывод.с мочой
Нр состоит из 4 п/п цепей – 2альфа и 2бета – и имеют 3 нег.типа: Нр1-1, Нр1-2, Нр2-2
Нр строго индивид.для каждого человека. Его исп.для установления отцовства, материнства и т.п.
Нв-Нр комплекс→в кл.РЭС-гистиоциты, кл.Купфера, кл.кр.к.мозга.
Стадии превращения Нв в желчные пигменты:
1)В клетках РЭС
Под действ.гем-оксигеназ.системы(НАДФ, вит.С, тетрагидрофолиевая к-та) превращается в вердоглобин.
Нв+Нр→комплекс
→О2, НАДФН2 ↓Р450, ТГФК, вит.С, гемоксигеназа, →гаптоглобин
НАДФ, Н2О←
Вердоглобин
Fe3+← ↓→глобин→СО
Биливердин – 1й желч.пигмент, зеленый, не токсичный, хорошо раств.в воде.
Биливердин- ↓восст-е
редуктаза,
НАДФН2
Билирубин – пигмент красно-корич.цвета, токсичен, нераств.в воде;обнаруж.в крови – непрямой, несвязанный, неконъюгированный. В крови абсорбирован на альбуминах. В комплексе с последним теряет токсичность, становится хорошо растворим в воде, но с мочой не выводится.
Непрямой несвяз.б/р – для его обнаруж. Необх.осадить Б спиртом или кофеином, затем провести диазореакцию. Он образуется к летках РЭС.
2) Превращение б/р в гепатоцитах.
Идет в 3 фазы:
1. Б\р подходит к гепатоциту, отсоед-ся от альбумина и при участии y и z-протеинов(спец.Б лигандины)поступают в цитозоль гепатоцита, затем в ЭПС
2. В ЭПС гепатоцита: б/р конъюгтрует с УДФГК(акт.фотма глюкурон.к-ты) б/р+УДФГК→БМГ(моно-)→БДГ(ди-)
3. 75% БДГ поступает в желч.пузырь против градиента конц., т.е. это Е-завис.транспорт. Из ж.п. →тон.кишечниу. До 25% БДГ пост.в кровь.
Обнаруж. В крови б/р прямой конъюгированный связанный. Прямой – т.к. он сразу реагирует с диазор-вом Эрлихаю В абс.величинах уровень б/рне превыш. 5 мкмоль/л. Конъюг.-с глюкурон.к-той, возник.хим.свзь;глюкур.к-та присоед.через остатки пропионовой к-ты. Происходит уменьш. Токсичности путем увелич-я р-римости.
3) Превращ.б/р в ЖКТ
БДГ
В тон. ↓→глюк.к-та
кишке
мезобилирубин
восст-е↓редуктазы норм.м/флоры
мезобилиноген(уробилиноген) – его часть всас.через вена порта, поступ.в печень, а там разруш.до пирролов, монодипирролов, а они снова возвращ.в кишечник или вывод. с мочой.
↓
Cтеркобилиноген →с содержимым кишечника и окраш.его; при участии воздуха окисл.в стеркобилин.
(нормальный пигмент кала и мочи)
↓
Через с-му геморроидальных вен всас. →в большой круг→вывод.с мочой
При патологии в печени нарушается превращение мезобилиногена(уробилиногена)в пирролы, и он поступает в кровь, оказывая токсическое действие на ЦНС и др., а затем выводится с мочой. Т.о., это патологический комп.мочи.
Клинический интерес представляет:
С мочой выводится повыш.содерж.уробилиногена→недостаточность функции печени(печеночная или гемолитическая желтуха – потеря печенью способности извлекать пигмент из крови воротной вены)
Исчезновение стеркобилиногена из мочи при наличии б/р и биливердина→полное прекращение поступления желчи в кишечник(при желчекаменной болезни, рак.поражениях поджел.железы)
Биосинтез холестерина, последовательность реакций до образования мевалоновой кислоты, представление о дальнейших этапах. Транспорт холестерина. Холестерин и атеросклероз.
Происходит в цитозоле клеток. Можно выделить 3 этапа:
1)Образование мевалоната.
2 мол-лы Ац-КоА конденсир-ся тиолазой →ацетоАц-КоА. Гидроксиметилглутарил-КоА-синтаза присоед-ет третий ацетильный остаток с обр-ем ГМГ-КоА(3-гидрокси-3-метилглутарил-КоА). Далее под действием ГМГ-КоА-редуктазы идет восстановление ГМГ-КоА до мевалоната с использованием 2 мол. НАДФН.
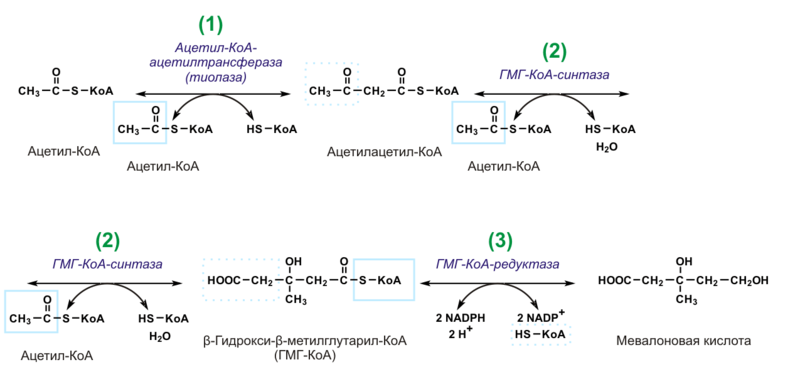
2)Образование сквалена.
Мевалонат превращ. В пятиуглеродную изопреноидную стр-ру, содержащую пирофосфат – изопентенилпирофосфат, 2 мол-лы которого конденсируются с обр. геранилпирофосфата. Присоединение еще одной изопрен.единицы→фарнезилпирофосфат(15 С-ат), 2 мол-лы которого конденсир-ся с обр. сквалена(30 С-атомов, имеет линейную стр-ру)
3)Образование холестерола
Сквален(ф.циклаза)→ланостерол(4 конденсированных цикла и 30 С-ат.) →…20р-ций.. →холестерол(27 С-ат)