
- •13 В продольных волнах частицы среды колеблются в направлении распространения волны, в поперечных — в плоскостях, перпендикулярных направлению распространения волны.
- •Волновое число
- •22. Дифракционную решетку — систему параллельных щелей равной ширины, лежащих в одной плоскости и разделенных равными по ширине непрозрачными промежутками
- •Эффект Доплера для электромагнитных волн в вакууме:
- •42 Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 к:
- •Свободная энергия Гельмгольца
- •Три закона внешнего фотоэффекта.
- •59 Рассмотрим простейший потенциальный барьер прямоугольной формы для одномерного (по оси х) движения частицы. Для потенциального барьера прямоугольной формы высоты u и ширины l можем записать
- •60 Состояние электрона в атоме водорода описывается волновой функцией , удовлетворяющей стационарному уравнению Шредингера учитывающему значение
- •Перечислим основные свойства ядерных сил:
- •68 Обнаруженное излучение было названо радиоактивным излучением, а само явление — испускание радиоактивного излучения — радиоактивностью.
- •Ядерные реакции классифицируются по следующим признакам:
Эффект Доплера для электромагнитных волн в вакууме:
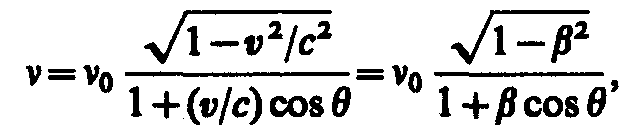 где
v
— скорость источника света относительно
приемника, с
— скорость света в вакууме, =v/c,
— угол между
вектором скорости v
и направлением наблюдения, измеряемый
в системе отсчета, связанной с наблюдателем
где
v
— скорость источника света относительно
приемника, с
— скорость света в вакууме, =v/c,
— угол между
вектором скорости v
и направлением наблюдения, измеряемый
в системе отсчета, связанной с наблюдателем
Из
выражения следует, что при
= 0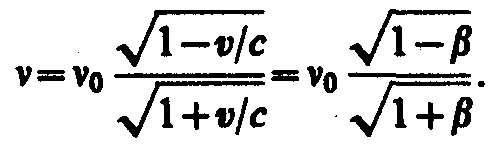
Формула
определяет так называемый продольный
эффект Доплера,
наблюдаемый при движении приемника
вдоль линии, соединяющей его с источником.
При малых относительных скоростях v
(v<<c),
разлагая в ряд по степеням
и пpeнeбрегая членом порядка 2,
получим![]()
Следовательно, при удалении источника и приемника друг от друга (при их положительной относительной скорости) наблюдается сдвиг в более длинноволновую область (<0, >0) — так называемое красное смещение. При сближении же источника и приемника (при их отрицательной относительной скорости) наблюдается сдвиг в более коротковолновую область ((>0, <0) — так называемое фиолетовое смещение.
Если
=/2,
то выражение примет вид![]()
Формула определяет так называемый поперечный эффект Доплера, наблюдаемый при движении приемника перпендикулярно линии, соединяющей его с источником.
29
Дисперсией
света
называется зависимость показателя
преломления n
вещества от частоты
(длины волны )
света или зависимость фазовой скорости
v
световых волн от его частоты .
Дисперсия света представляется в виде
зависимости![]()
Поглощением (абсорбцией) света называется явление уменьшения энергии световой волны при ее распространении в веществе вследствие преобразования энергии волны в другие виды энергии. В результате поглощения интенсивность света при прохождении через вещество уменьшается.
Поглощение
света в веществе описывается законом
Бугера:![]() где
I0
и I
— интенсивности
плоской монохроматической световой
волны на входе и выходе слоя поглощающего
вещества толщиной х,
— коэффициент
поглощения,
зависящий от длины волны света, химической
природы и состояния вещества и не
зависящий от интенсивности света. При
х=1/
интенсивность света I
по сравнению с I0
уменьшается в е
раз.
где
I0
и I
— интенсивности
плоской монохроматической световой
волны на входе и выходе слоя поглощающего
вещества толщиной х,
— коэффициент
поглощения,
зависящий от длины волны света, химической
природы и состояния вещества и не
зависящий от интенсивности света. При
х=1/
интенсивность света I
по сравнению с I0
уменьшается в е
раз.
Рассмотрим различия в дифракционном и призматическом спектрах.
1. Дифракционная решетка разлагает падающий свет непосредственно по длинам воли поэтому по измеренным углам (по направлениям соответствующих максимумов) можно вычислить длину волны. Разложение света в спектр в призме происходит по значениям показателя преломления, поэтому для определения длины волны света надо знать зависимость n=f()
2. Составные цвета в дифракционном и призматическом спектрах располагаются различно. Из следует, что в дифракционной решетке синус угла отклонения пропорционален длине волны. Следовательно, красные лучи, имеющие большую длину волны, чем фиолетовые, отклоняются дифракционной решеткой сильнее. Призма же разлагает лучи в спектр по значениям показателя преломления, который для всех прозрачных веществ с увеличением длины волны уменьшается Поэтому красные лучи отклоняются призмой слабее, чем фиолетовые.
Величина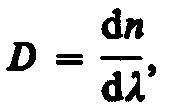 называемая дисперсией
вещества
называемая дисперсией
вещества
что показатель преломления для прозрачных веществ с уменьшением длины волны увеличивается; следовательно, величина dn/d по модулю также увеличивается с уменьшением . Такая дисперсия называется нормальной. Как будет показано ниже, ход кривой n() — кривой дисперсии — вблизи линий и полос поглощения будет иным: n уменьшается с уменьшением . Такой ход зависимости n от называется аномальной дисперсией.
30
![]() Выражение называется
основным уравнением молекулярно-кинетической
теории идеальных газов.
Выражение называется
основным уравнением молекулярно-кинетической
теории идеальных газов.
Следствия:
1. Учитывая, что концентрация n = N/V, получаем
г![]() де
E
– суммарная кинетическая энергия
поступательного движения всех молекул
газа. Таким образом, давление равно двум
третям энергии поступательного движения
молекул, содержащихся в единице объема
газа.
де
E
– суммарная кинетическая энергия
поступательного движения всех молекул
газа. Таким образом, давление равно двум
третям энергии поступательного движения
молекул, содержащихся в единице объема
газа.
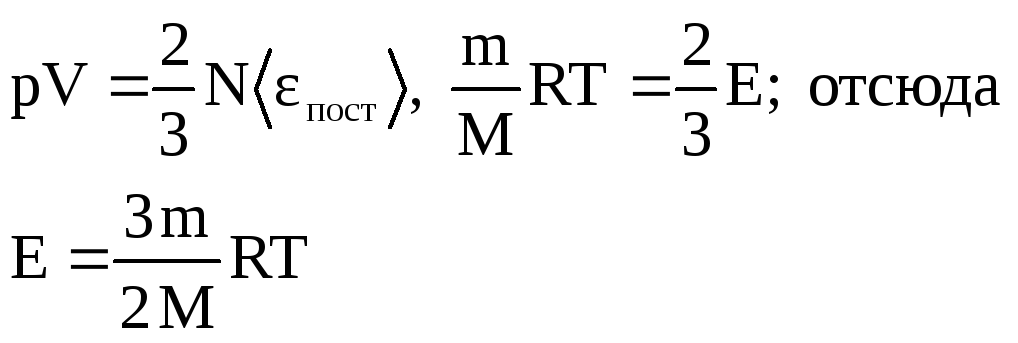 2.
Для вывода второго следствия воспользуемся
первым следствием и уравнением
Менделеева-Клапейрона:
2.
Для вывода второго следствия воспользуемся
первым следствием и уравнением
Менделеева-Клапейрона:
Энергия молекул Е в веществе пропорциональна количеству вещества в системе и температуре.
-
Н
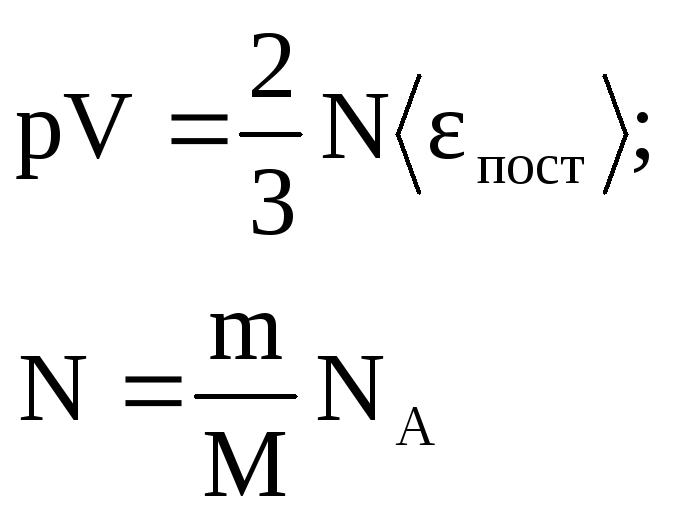 айдем
еще кинетическую энергию поступательного
движения одной молекулы ‹ εпост›,
учитывая
айдем
еще кинетическую энергию поступательного
движения одной молекулы ‹ εпост›,
учитывая
k =R/NA получим:
![]() Отсюда
следует, что средняя кинетическая
энергия хаотического поступательного
движения молекул идеального газа
пропорциональна его абсолютной
температуре и зависит только от нее,
т.е. температура есть количественная
мера энергии теплового движения молекул.
При одинаковой температуре средние
кинетические энергии молекул любого
газа одинаковы. При Т=0К ‹εпост›
= 0 и поступательное движение молекул
газа прекращается, однако анализ
различных процессов показывает, что Т
= 0К – недостижимая температура.
Отсюда
следует, что средняя кинетическая
энергия хаотического поступательного
движения молекул идеального газа
пропорциональна его абсолютной
температуре и зависит только от нее,
т.е. температура есть количественная
мера энергии теплового движения молекул.
При одинаковой температуре средние
кинетические энергии молекул любого
газа одинаковы. При Т=0К ‹εпост›
= 0 и поступательное движение молекул
газа прекращается, однако анализ
различных процессов показывает, что Т
= 0К – недостижимая температура.
4. Учитывая, что ‹εпост› = 3kT/2, р = 2n‹ εпост›/3, получим отсюда: р = nkT.
Мы получили уже знакомый нам вариант уравнения Менделеева-Клапейрона, выведенный в данном случае из понятий молекулярно-кинетической теории статистическим методом. Последнее уравнение означает, что при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул.
31
Средняя кинетическая энергия
поступательного движения одной молекулы
идеального газа![]()
пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при Т=0 <0>=0, т. е. при 0К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула раскрывает молекулярно-кинетическое толкование температуры.
Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В соответствии с решением XI Генеральной конференции по мерам и весам (1960) в настоящее время можно применять только две температурные шкалы — термодинамическую и Международную практическую, градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С). В Международной практической шкале температура замерзания и кипения воды при давлении 1,013105 Па соответственно 0 и 100°С (реперные точки).
32
закон Больцмана
о равномерном распределении энергии
по степеням свободы молекул:
для статистической системы, находящейся
в состоянии термодинамического
равновесия, на каждую поступательную
и вращательную степени свободы приходится
в среднем кинетическая энергия, равная
kT/2,
а на каждую колебательную степень
свободы — в среднем энергия, равная kT.
Колебательная
степень «обладает» вдвое большей
энергией потому, что на нее приходится
не только кинетическая энергия (как в
случае поступательного и вращательного
движений), но и потенциальная, причем
средние значения кинетической и
потенциальной энергий одинаковы.
Таким образом, средняя энергия молекулы![]() где i
— сумма
числа поступательных, числа вращательных
в удвоенного числа колебательных
степеней свободы молекулы:
где i
— сумма
числа поступательных, числа вращательных
в удвоенного числа колебательных
степеней свободы молекулы:
![]()
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
числа степеней свободы: это число независимых переменных (координат), полностью определяющих положение системы в пространстве.
33
Закон Максвелла описывается некоторой
функцией f(v),
называемой функцией
распределения молекул по скоростям.
Если разбить диапазон скоростей молекул
на малые интервалы, равные dv,
то на каждый интервал скорости будет
приходиться некоторое число молекул
dN(v),
имеющих скорость, заключенную в этом
интервале. Функция f(v)
определяет относительное число молекул
dN(v)/N,
скорости которых лежат в интервале от
v
до v+dv,
т. е.![]() откуда
откуда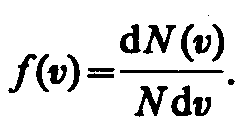
Применяя методы теории вероятностей. Максвелл нашел функцию f(v) — закон о распределеня молекул идеального газа по скоростям:
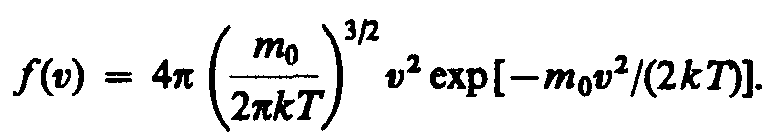
34
![]()
Выражение называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту: Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение может быть записано в виде
![]() где
р —
давление на высоте h.
где
р —
давление на высоте h.
![]()
Выражение называется распределением Больцмана для внешнего потенциального поля. Из вето следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцманасправедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
35 Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул <l>.
36 В термодинамически неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса). Для простоты ограничимся одномерными явлениями переноса. Систему отсчета выберем так, чтобы ось х была ориентирована в направлении переноса.
1. Теплопроводность. Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, т. е., иными словами, выравнивание температур.
Перенос
энергии в форме теплоты подчиняется
закону Фурье:![]() где jE
— плотность
теплового потока
— величина, определяемая энергией,
переносимой в форме теплоты в
единицу времени через единичную площадку,
перпендикулярную оси х,
—
теплопроводность,
где jE
— плотность
теплового потока
— величина, определяемая энергией,
переносимой в форме теплоты в
единицу времени через единичную площадку,
перпендикулярную оси х,
—
теплопроводность,
![]() — градиент температуры, равный скорости
изменения температуры на единицу длины
х
в направлении нормали к этой площадке.
Знак минус показывает, что при
теплопроводности энергия переносится
в направлении убывания температуры
(поэтому знаки jE
и
— градиент температуры, равный скорости
изменения температуры на единицу длины
х
в направлении нормали к этой площадке.
Знак минус показывает, что при
теплопроводности энергия переносится
в направлении убывания температуры
(поэтому знаки jE
и
![]() – противоположны). Теплопроводность
численно равна плотности теплового
потока при градиенте температуры, равном
единице.
– противоположны). Теплопроводность
численно равна плотности теплового
потока при градиенте температуры, равном
единице.
Можно
показать, что
![]() где
сV
—
удельная теплоемкость газа при постоянном
объеме
(количество теплоты, необходимое для
нагревания 1 кг газа на 1 К при постоянном
объеме),
— плотность
газа, <v>
— средняя скорость теплового движения
молекул, <l>
— средняя длина свободного пробега.
где
сV
—
удельная теплоемкость газа при постоянном
объеме
(количество теплоты, необходимое для
нагревания 1 кг газа на 1 К при постоянном
объеме),
— плотность
газа, <v>
— средняя скорость теплового движения
молекул, <l>
— средняя длина свободного пробега.
2. Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия сводится к обмену масс частиц этих тел, возникает и продолжается, пока существует градиент плотности. Во время становления молекулярно-кинетической теории по вопросу диффузии возникли противоречия. Так как молекулы движутся с огромными скоростями, диффузия должна происходить очень быстро. Если же открыть в комнате сосуд с пахучим веществом, то запах распространяется довольно медленно. Однако противоречия здесь нет. Молекулы при атмосферном давлении обладают малой длиной свободного пробега и, сталкиваясь с другими молекулами, в основном «стоят» на месте.
Явление диффузии для химически однородного газа подчиняется закону Фука:
![]() где
jm
— плотность
потока массы
— величина, определяемая массой вещества,
диффундирующего в
единицу времени через единичную площадку,
перпендикулярную оси х,
D
— диффузия
(коэффициент диффузии),
d/dx
— градиент
плотности, равный скорости изменения
плотности на единицу длины х
в направлении нормали к этой площадке.
Знак минус показывает, что перенос массы
происходит в направлении убывания
плотности (поэтому знаки jm
и d/dx
противоположны). Диффузия D
численно равна плотности потока массы
при градиенте плотности, равном единице.
Согласно кинетической теории газов,
где
jm
— плотность
потока массы
— величина, определяемая массой вещества,
диффундирующего в
единицу времени через единичную площадку,
перпендикулярную оси х,
D
— диффузия
(коэффициент диффузии),
d/dx
— градиент
плотности, равный скорости изменения
плотности на единицу длины х
в направлении нормали к этой площадке.
Знак минус показывает, что перенос массы
происходит в направлении убывания
плотности (поэтому знаки jm
и d/dx
противоположны). Диффузия D
численно равна плотности потока массы
при градиенте плотности, равном единице.
Согласно кинетической теории газов,
![]()
3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Согласно
формуле сила внутреннего трения между
двумя слоями газа (жидкости) подчиняется
закону
Ньютона:![]() где
— динамическая
вязкость (вязкость), dv/dx
— градиент
скорости, показывающий быстроту изменения
скорости в направлении х,
перпендикулярном направлению движения
слоев, S
— площадь,
на которую действует сила F.
где
— динамическая
вязкость (вязкость), dv/dx
— градиент
скорости, показывающий быстроту изменения
скорости в направлении х,
перпендикулярном направлению движения
слоев, S
— площадь,
на которую действует сила F.
37
Как уже указывалось, состояние некоторой
массы газа определяется тремя
термодинамическими параметрами:
давлением р,
объемом V
и температурой Т.
Между этими параметрами существует
определенная связь, называемая
уравнением состояния,
которое в общем виде дается выражением
![]() где каждая из переменных является
функцией двух других.
где каждая из переменных является
функцией двух других.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среда и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
38 Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
![]()
Как
уже указывалось , из первого начала
термодинамики (Q=dU+A)
для
изохорного
процесса следует, что вся теплота,
сообщаемая газу, идет на увеличение его
внутренней энергии:![]() Согласно формуле,
Согласно формуле,![]()
Тогда
для произвольной массы газа получим![]()
Изобарный
процесс
(p=const).
Диаграмма этого процесса (изобара) в
координатах р,
V изображается
прямой, параллельной оси V.
При изобарном процессе работа газа при
увеличения объема от V1
до V2
равна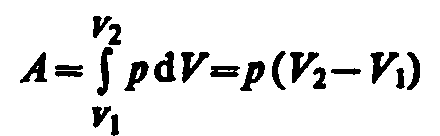 \и
определяется площадью заштрихованного
прямоугольника (рис. 82). Если использовать
уравнение Клапейрона — Менделеева для
выбранных нами двух состояний, то
\и
определяется площадью заштрихованного
прямоугольника (рис. 82). Если использовать
уравнение Клапейрона — Менделеева для
выбранных нами двух состояний, то![]() Откуда
Откуда
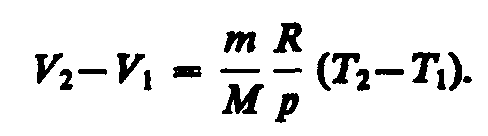
Тогда
выражение для работы изобарного
расширения примет вид
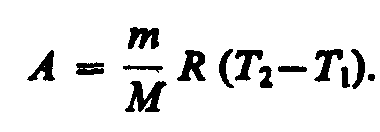
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 =1 К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты
![]() его
внутренняя энергия возрастает на
величину
его
внутренняя энергия возрастает на
величину
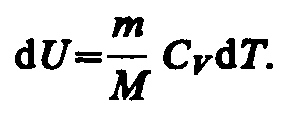
Изотермический
процесс
(T=const).
Как уже указывалось, изотермический
процесс описывается законом Бойля—Мариотта:
![]()
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из выражений найдем работу изотермического расширения газа:
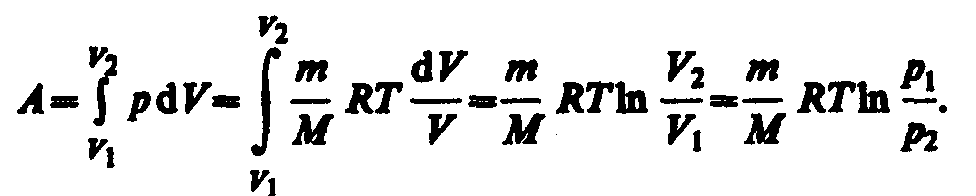
Так как при Т=const внутренняя энергия идеального газа не изменяется:
![]() то
из первого начала термодинамики
(Q=dU+A)
следует, что для изотермического
процесса
то
из первого начала термодинамики
(Q=dU+A)
следует, что для изотермического
процесса![]() т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]()
Адиабатическим называется процесс, при котором отсутствует теплообмен (Q=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из
первого начала термодинамики (Q=dU+A)
для адиабатического процесса следует,
что![]() т. е. внешняя
работа совершается за счет изменения
внутренней энергии системы.
т. е. внешняя
работа совершается за счет изменения
внутренней энергии системы.
Используя выражения для произвольной массы газа перепишем уравнение в виде
![]()
Продифференцировав
уравнение состояния для идеального
газа
![]() получим
получим
![]()
Исключим
температуру Т.
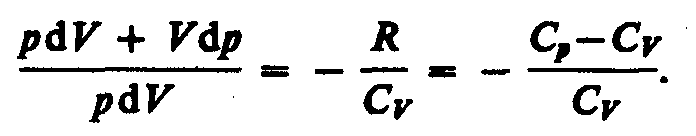
Разделив
переменные и учитывая, что Сp/СV=
(см. найдем
![]()
Интегрируя
это уравнение в пределах от p1
до p2
и соответственно от V1
до V2,
а затем потенцируя, придем к выражению
![]()
Так
как состояния 1
и 2
выбраны произвольно, то можно записать
![]()
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для
перехода к переменным Т,
V
или
p,
Т исключим
из с помощью уравнения Клапейрона —
Менделеева
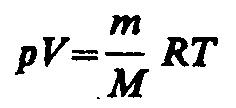
соответственно
давление или объем:![]()
![]()
Выражения представляют собой уравнения адиабатического процесса. В этих
уравнениях
безразмерная величина
![]()
называется показателем адиабаты (или коэффициентом Пуассона).
39 Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
![]() где
S
— площадь
поршня, Sdl=dV—
изменение объема системы.
где
S
— площадь
поршня, Sdl=dV—
изменение объема системы.
Таким
образом,
![]()
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы
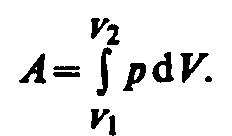
При изохорном процессе газ не совершает работы над внешними телами, т. е.
![]()
При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
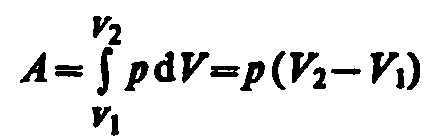
Исходя из выражений) найдем работу изотермического расширения газа:
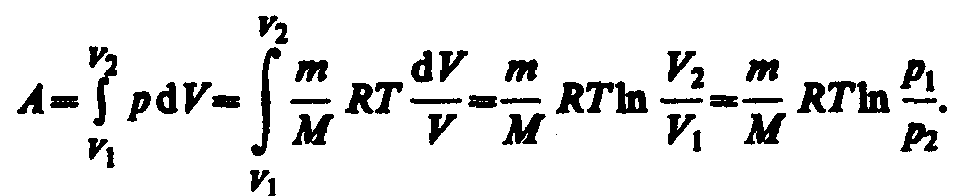
Из первого начала термодинамики (Q=dU+A) для адиабатического процесса следует, что
![]()
40 Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
Внутренняя
энергия реального газа складывается
из кинетической энергии теплового
движения его молекул (определяет
внутреннюю энергию идеального газа,
равную СVТ;
и потенциальной энергии межмолекулярного
взаимодействия. Потенциальная энергия
реального газа обусловлена только
силами притяжения между молекулами.
Наличие сил притяжения приводит к
возникновению внутреннего давления на
газ
![]()
41
![]()
Уравнение
выражает
первое начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил. Выражение в дифференциальной форме
будет иметь вид
![]() или
в более корректной формеь
или
в более корректной формеь![]() где dU
— бесконечно
малое изменение внутренней энергии
системы, A
— элементарная
работа, Q
— бесконечно
малое количество теплоты. В этом выражении
dU является
полным дифференциалом, а
A
и Q
таковыми не являются. В дальнейшем будем
использовать запись первого начала
термодинамики в форме
где dU
— бесконечно
малое изменение внутренней энергии
системы, A
— элементарная
работа, Q
— бесконечно
малое количество теплоты. В этом выражении
dU является
полным дифференциалом, а
A
и Q
таковыми не являются. В дальнейшем будем
использовать запись первого начала
термодинамики в форме
Из формулы следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии U=0.
Тогда, согласно первому началу
термодинамики,![]() т. е. вечный
двигатель первого рода
— периодически действующий двигатель,
который совершал бы бóльшую работу, чем
сообщенная ему извне энергия, — невозможен
(одна из формулировок первого начала
термодинамики).
т. е. вечный
двигатель первого рода
— периодически действующий двигатель,
который совершал бы бóльшую работу, чем
сообщенная ему извне энергия, — невозможен
(одна из формулировок первого начала
термодинамики).
Из первого начала термодинамики (Q=dU+A) для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
![]()
из
первого начала термодинамики (Q=dU+A)
следует, что для изотермического
процесса![]()
В изобарном процессе при сообщении газу массой т количества теплоты
![]() его
внутренняя энергия возрастает на
величину
его
внутренняя энергия возрастает на
величину
![]()
При этом газ совершит работу, определяемую выражением
Из первого начала термодинамики (Q=dU+A) для адиабатического процесса следует, что
![]() т.
е. внешняя работа совершается за счет
изменения внутренней энергии системы.
т.
е. внешняя работа совершается за счет
изменения внутренней энергии системы.
