
- •13 В продольных волнах частицы среды колеблются в направлении распространения волны, в поперечных — в плоскостях, перпендикулярных направлению распространения волны.
- •Волновое число
- •22. Дифракционную решетку — систему параллельных щелей равной ширины, лежащих в одной плоскости и разделенных равными по ширине непрозрачными промежутками
- •Эффект Доплера для электромагнитных волн в вакууме:
- •42 Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 к:
- •Свободная энергия Гельмгольца
- •Три закона внешнего фотоэффекта.
- •59 Рассмотрим простейший потенциальный барьер прямоугольной формы для одномерного (по оси х) движения частицы. Для потенциального барьера прямоугольной формы высоты u и ширины l можем записать
- •60 Состояние электрона в атоме водорода описывается волновой функцией , удовлетворяющей стационарному уравнению Шредингера учитывающему значение
- •Перечислим основные свойства ядерных сил:
- •68 Обнаруженное излучение было названо радиоактивным излучением, а само явление — испускание радиоактивного излучения — радиоактивностью.
- •Ядерные реакции классифицируются по следующим признакам:
Три закона внешнего фотоэффекта.
I. Закон Столетова: при фиксированной частоте падающего света число фотоэлектронов, вырываемых из катода в единицу времени, пропорционально интенсивности света (сила фототока насыщения пропорциональна энергетической освещенности Ее катода).
II. Максимальная начальная скорость (максимальная начальная кинетическая энергия) фотоэлектронов не зависит от интенсивности падающего света, а определяется только его частотой .
III. Для каждого вещества существует красная граница фотоэффекта, т. е. минимальная частота 0 света (зависящая от химической природы вещества и состояния его поверхности), ниже которой фотоэффект невозможен.
Энергия
падающего фотона расходуется на
совершение электроном работы выхода
А
из металла и на сообщение вылетевшему
фотоэлектрону кинетической энергии
mv2max/2.
По закону сохранения энергии,![]()
Уравнение называется уравнением Эйнштейна для внешнего фотоэффекта.
51 Эффект
Комптона (Комптон-эффект, Комптоновское
рассеяние) — неупругое рассеяние фотонов на
свободных электронах.
Эффект сопровождается изменением частоты фотонов,
часть энергии которых после рассеяния
передается электронам. Обнаружен
американским физиком Артуром
Комптоном в 1923
году в экспериментах с рентгеновским
излучением. В 1927 Комптон
получил за это открытие Нобелевскую
премию по физике. Иллюстрация
к эффекту Комптона При рассеянии фотона на
покоящемся электроне частоты
фотона ![]() и
и ![]() (до
и после рассеяния соответственно)
связаны соотношением:
(до
и после рассеяния соответственно)
связаны соотношением:
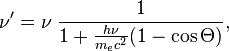 где
где ![]() —
угол рассеяния (угол между правлениями
распространения фотона до и после
рассеяния).
—
угол рассеяния (угол между правлениями
распространения фотона до и после
рассеяния).
Перейдя к длинам
волн:
![]() где
где ![]() — комптоновская
длина волны электрона, равная
— комптоновская
длина волны электрона, равная ![]() м.
м.
52 Большую роль в выяснении строения атома, а именно распределения электронов по оболочкам, сыграло излучение, открытое в 1895 г. немецким физиком В. Рентгеном (1845—1923) и названное рентгеновским. Самым распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод (металлическая мишень из тяжелых металлов, например W или Pt), испытывая на нем резкое торможение.
Спектр представляет собой наложение сплошного спектра, ограниченного со стороны коротких длин волн некоторой границей min, называемой границей сплошного спектра, и линейчатого спектра — совокупности отдельных линий, появляющихся на фоне сплошного спектра.
Из классической теории, однако, не вытекает существование коротковолновой границы сплошного спектра. Из опытов следует, что чем больше кинетическая энергия электронов, вызывающих тормозное рентгеновское излучение, тем меньше min. Это обстоятельство, а также наличие самой границы объясняются квантовой теорией. Очевидно, что предельная энергия кванта соответствует такому случаю торможения, при котором вся кинетическая энергия электрона переходит в энергию кванта, т. е.
![]() где
U—разность
потенциалов, за счет которой электрону
сообщается энергия Еmax,
max
— частота, соответствующая границе
сплошного спектра. Отсюда граничная
длина волны
где
U—разность
потенциалов, за счет которой электрону
сообщается энергия Еmax,
max
— частота, соответствующая границе
сплошного спектра. Отсюда граничная
длина волны
![]() что
полностью соответствует экспериментальным
данным. Измеряя границу рентгеновского
сплошного спектра, по формуле можно
определить экспериментальное значение
постоянной Планка h,
которое наиболее точно совпадает с
современными данными.
что
полностью соответствует экспериментальным
данным. Измеряя границу рентгеновского
сплошного спектра, по формуле можно
определить экспериментальное значение
постоянной Планка h,
которое наиболее точно совпадает с
современными данными.
53 При достаточно большой энергии бомбардирующих анод электронов на фоне сплошного спектра появляются отдельные резкие линии — линейчатый спектр, определяемый материалом анода и называемый характеристическим рентгеновским спектром (излучением).
По сравнению с оптическими спектрами характеристические рентгеновские спектры элементов совершенно однотипны и состоят из нескольких серий, обозначаемых К, L, М, и O. Каждая серия, в свою очередь, содержит небольшой набор отдельных линий, обозначаемых в порядке убывания длины волны индексами , , ,... (К, К, К,.... L, L, L, ...). При переходе от легких элементов к тяжелым структура характеристического спектра не изменяется, лишь весь спектр смещается в сторону коротких волн. Особенность этих спектров заключается в том, что атомы каждого химического элемента, независимо от того, находятся ли они в свободном состоянии или входят в химическое соединение, обладают определенным, присущим только данному элементу линейчатым спектром характеристического излучения. Так, если анод состоит из нескольких элементов, то и характеристическое рентгеновское излучение представляет собой наложение спектров этих элементов.
Исследуя рентгеновские спектры элементов, английский физик Г. Мозли (1887—1915) установил в 1913 г. соотношение, называемое законом Мозли:
![]() где
— частота, соответствующая данной линии
характеристического рентгеновского
излучения, R
— постоянная Ридберга,
— постоянная
экранирования, т
= 1, 2, 3, ...
(определяет рентгеновскую серию), n
принимает целочисленные значения
начиная с m+1
(определяет отдельную линию соответствующей
серии). Закон Мозли подобен обобщенной
формуле Бальмера для атома водорода.
где
— частота, соответствующая данной линии
характеристического рентгеновского
излучения, R
— постоянная Ридберга,
— постоянная
экранирования, т
= 1, 2, 3, ...
(определяет рентгеновскую серию), n
принимает целочисленные значения
начиная с m+1
(определяет отдельную линию соответствующей
серии). Закон Мозли подобен обобщенной
формуле Бальмера для атома водорода.
54 Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В
стационарном состоянии атома электрон,
двигаясь по круговой орбите, должен
иметь дискретные квантованные значения
момента импульса, удовлетворяющие
условию![]() где
те
— масса
электрона, v
— его скорость
по n-й
орбите радиуса rn,
ћ
= h/(2).
где
те
— масса
электрона, v
— его скорость
по n-й
орбите радиуса rn,
ћ
= h/(2).
Втором
постулат Бора (правило частот): при
переходе электрона с одной стационарной
орбиты на другую излучается (поглощается)
один фотон с энергией
![]()
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя
Бору, рассмотрим движение электрона в
водородоподобной системе, ограничиваясь
круговыми стационарными орбитами. Решая
совместно уравнение
![]() ,
предложенное Резерфордом, и уравнение
получим выражение для радиуса n-й
стационарной орбиты:
,
предложенное Резерфордом, и уравнение
получим выражение для радиуса n-й
стационарной орбиты:![]() где
n
= 1, 2, 3, ... . Из
выражения следует, что радиусы орбит
растут пропорционально квадратам
целых чисел.
где
n
= 1, 2, 3, ... . Из
выражения следует, что радиусы орбит
растут пропорционально квадратам
целых чисел.
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым боровоским радиусом (а), равен
![]() что
соответствует расчетам на основании
кинетической теории газов. Так как
радиусы стационарных орбит измерить
невозможно, то для проверки теории
необходимо обратиться к таким величинам,
которые могут быть измерены экспериментально.
Такой величиной является энергия,
излучаемая и поглощаемая атомами
водорода.
что
соответствует расчетам на основании
кинетической теории газов. Так как
радиусы стационарных орбит измерить
невозможно, то для проверки теории
необходимо обратиться к таким величинам,
которые могут быть измерены экспериментально.
Такой величиной является энергия,
излучаемая и поглощаемая атомами
водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (тev2/2) и потенциальной энергии в электростатическом поле ядра (–Ze2/(40r)):
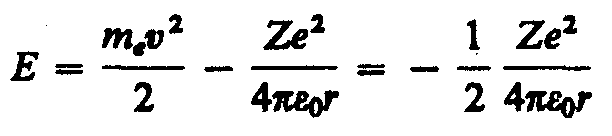 (учли,
что
(учли,
что
![]() ;
Учитывая квантованные для радиуса n-й
стационарной орбиты значения, получим,
что энергия электрона может принимать
только следующие дозволенные дискретные
значения:
;
Учитывая квантованные для радиуса n-й
стационарной орбиты значения, получим,
что энергия электрона может принимать
только следующие дозволенные дискретные
значения: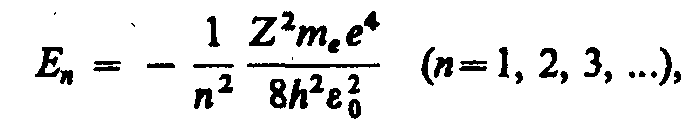
55 Французский ученый Луи де Бройль (1892—1987), осознавая существующую в природе симметрию и развивая представления о двойственной корпускулярно-волновой природе света, выдвинул в 1923 г. гипотезу об универсальности корпускулярно-волнового дуализма. Де Бройль утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Итак,
согласно де Бройлю, с каждым
микрообъектом
связываются, с одной стороны,
корпускулярные
характеристики — энергия Е
и импульс p,
а с другой — волновые
характеристики —
частота
и длина волны .
Количественные соотношения, связывающие
корпускулярные и волновые свойства
частиц, такие же, как для фотонов:![]()
Смелость
гипотезы де Бройля заключалась именно
в том, что соотношение постулировалось
не только для фотонов, но и для других
микрочастиц, в частности для таких,
которые обладают массой покоя. Таким
образом, любой частице, обладающей
импульсом, сопоставляют волновой процесс
с длиной волны, определяемой
по формуле де Бройля:![]() Это соотношение справедливо для любой
частицы с импульсом р.
Это соотношение справедливо для любой
частицы с импульсом р.
Вскоре гипотеза де Бройля была подтверждена экспериментально. В 1927 г. американские физики К. Дэвиссон (1881—1958) и Л. Джермер (1896—1971) обнаружили, что пучок электронов, рассеивающийся от естественной дифракционной решетки — кристалла никеля, — дает отчетливую дифракционную картину. Дифракционные максимумы соответствовали формуле Вульфа — Брэггов, а брэгговская длина волны оказалась в точности равной длине волны, вычисленной по формуле. В дальнейшем формула де Бройля была подтверждена опытами П. С. Тартаковского и Г. Томсона, наблюдавших дифракционную картину при прохождении пучка быстрых электронов (энергия 50 кэВ) через металлическую фольгу (толщиной 1 мкм).
56
В. Гейзенберг, учитывая волновые свойства
микрочастиц и связанные с волновыми
свойствами ограничения в их поведении,
пришел в 1927 г. к выводу, что объект
микромира невозможно одновременно с
любой наперед заданной точностью
характеризовать и координатой и
импульсом. Согласно соотношению
неопределенностей Гейзенберга,
микрочастица (микрообъект) не может
иметь одновременно и определенную
координату (х,
у, z),
и определенную соответствующую проекцию
импульса (рх,
pу,
pz),
причем неопределенности этих величин
удовлетворяют условиям
![]() т. е. произведение неопределенностей
координаты и соответствующей ей проекции
импульса не может быть меньше величины
порядка h.
т. е. произведение неопределенностей
координаты и соответствующей ей проекции
импульса не может быть меньше величины
порядка h.
В квантовой теории рассматривается также соотношение неопределенностей для энергии Е и времени t, т. е. неопределенности этих величии удовлетворяют условию
57
Чтобы устранить эти трудности, немецкий
физик М. Борн (1882—1970) в 1926 г. предположил,
что по волновому закону меняется не
сама вероятность, а величина, названная
амплитудой
вероятности
и обозначаемая (х,
у, z,
t).
Эту величину называют также волновой
функцией
(или -функцией).
Амплитуда вероятности может быть
комплексной, и вероятность W
пропорциональна квадрату ее модуля:
![]() (||2=*,
*
— функция,
комплексно сопряженная с ).
Таким образом, описание состояния
микрообъекта с помощью волновой функции
имеет
статистический, вероятностный
характер:
квадрат модуля волновой функции (квадрат
модуля амплитуды волн де Бройля)
определяет вероятность нахождения
частицы в момент времени t
в области с
координатами х
и x+dx,
у и y+dy,
z
и z+dz.
(||2=*,
*
— функция,
комплексно сопряженная с ).
Таким образом, описание состояния
микрообъекта с помощью волновой функции
имеет
статистический, вероятностный
характер:
квадрат модуля волновой функции (квадрат
модуля амплитуды волн де Бройля)
определяет вероятность нахождения
частицы в момент времени t
в области с
координатами х
и x+dx,
у и y+dy,
z
и z+dz.
Итак,
в квантовой механике состояние микрочастиц
описывается принципиально по-новому —
с помощью волновой функции, которая
является основным
носителем информации об
их корпускулярных и волновых свойствах.
Вероятность нахождения частицы в
элементе объемом dV
равна![]()
Величина
![]() (квадрат модуля -функции)
имеет смысл
плотности вероятности,
т. е. определяет вероятность нахождения
частицы в единичном объеме в окрестности
точки с координатами х,
у, z.
Таким образом, физический смысл имеет
не сама -функция,
а квадрат ее модуля ||2,
которым задается интенсивность
волн де Бройля
(квадрат модуля -функции)
имеет смысл
плотности вероятности,
т. е. определяет вероятность нахождения
частицы в единичном объеме в окрестности
точки с координатами х,
у, z.
Таким образом, физический смысл имеет
не сама -функция,
а квадрат ее модуля ||2,
которым задается интенсивность
волн де Бройля
Функция , характеризующая вероятность обнаружения действия микрочастицы в элементе объема, должна быть конечной (вероятность не может быть больше единицы), однозначной (вероятность не может быть неоднозначной величиной) и непрерывной (вероятность не может изменяться скачком).
Волновая
функция ,
являясь основной характеристикой
состояния микрообъектов, позволяет в
квантовой механике вычислять средние
значения физических величин, характеризующих
данный микрообъект. Например, среднее
расстояние r
электрона от ядра вычисляют по формуле
![]()
58
Уравнение Шредингера имеет вид![]() где ћ=h/(2),
т—масса
частицы, —оператор
Лапласа
где ћ=h/(2),
т—масса
частицы, —оператор
Лапласа
![]() i
— мнимая единица, U
(х, у, z,
t)
— потенциальная
функция частицы в силовом поле, в котором
она движется, (х,
у, z,
t)
— искомая волновая функция частицы.
i
— мнимая единица, U
(х, у, z,
t)
— потенциальная
функция частицы в силовом поле, в котором
она движется, (х,
у, z,
t)
— искомая волновая функция частицы.
![]()
Уравнение называется уравнением Шредингера для стационарных состояний. В это уравнение в качестве параметра входит полная энергия Е частицы.
Проведем качественный анализ решений уравнения Шредингера применительно к частице в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками». Такая «яма» описывается потенциальной энергией вида (для простоты принимаем, что частица движется вдоль оси х)
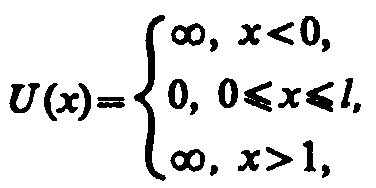 где
l
— ширина «ямы», а энергия отсчитывается
от ее дна
где
l
— ширина «ямы», а энергия отсчитывается
от ее дна
Уравнение
Шредингера для стационарных состояний
в случае одномерной задачи запишется
в виде![]()
По
условию задачи (бесконечно высокие
«стенки»), частица не проникает за
пределы «ямы», поэтому вероятность ее
обнаружения (а следовательно, и волновая
функция) за пределами «ямы» равна нулю.
На границах «ямы» (при х=0
и х=1)
непрерывная волновая функция также
должна обращаться в нуль. Следовательно,
граничные условия в данном случае
имеют вид
![]()
В пределах «ямы» (0 х l) уравнение Шредингера сведется к уравнению
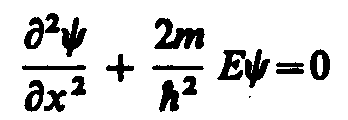 или
или![]() где
где![]()
Общее
решение дифференциального уравнения
![]()
Так
как (0)=0,
то В=0.
Тогда![]()
Условие
(l)=A
sin
kl
= 0 выполняется
только при kl
= n,
где n
— целые числа, т.е. необходимо, чтобы
![]()
Из
выражений следует, что
![]() т. е. стационарное уравнение Шредингера,
описывающее движение частицы в
«потенциальной яме» с бесконечно
высокими «стенками», удовлетворяется
только при собственных значениях Еn,
зависящих от целого числа п.
Следовательно, энергия Еn
частицы в «потенциальной яме» с бесконечно
высокими «стенками» принимает лишь
определенные
дискретные значения, т.е.
квантуется.
Квантованные значения энергии Еn
называются
уровнями энергии,
а число п,
определяющее энергетические уровни
частицы, называется
главным квантовым числом.
Таким образом, микрочастица в
«потенциальной яме» с бесконечно
высокими «стенками» может находиться
только на определенном энергетическом
уровне Еn,
или, как говорят, частица находится в
квантовом состоянии n.
т. е. стационарное уравнение Шредингера,
описывающее движение частицы в
«потенциальной яме» с бесконечно
высокими «стенками», удовлетворяется
только при собственных значениях Еn,
зависящих от целого числа п.
Следовательно, энергия Еn
частицы в «потенциальной яме» с бесконечно
высокими «стенками» принимает лишь
определенные
дискретные значения, т.е.
квантуется.
Квантованные значения энергии Еn
называются
уровнями энергии,
а число п,
определяющее энергетические уровни
частицы, называется
главным квантовым числом.
Таким образом, микрочастица в
«потенциальной яме» с бесконечно
высокими «стенками» может находиться
только на определенном энергетическом
уровне Еn,
или, как говорят, частица находится в
квантовом состоянии n.
Подставив
значение k
найдем собственные функции:![]()
Постоянную интегрирования А найдем из условия нормировки, которое для данного случая запишется в виде
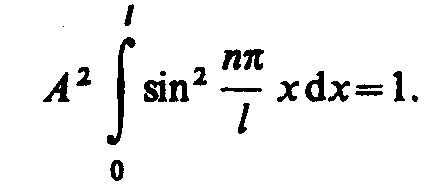
В
результате интегрирования получим А
=![]() ,
а собственные функции будут иметь вид
,
а собственные функции будут иметь вид ![]()
