
- •Методические указания по выполнению практических занятий по курсу физики
- •Темы практических занятий по разделам «Механика. Молекулярная физика и термодинамика» (1 семестр)
- •Практическое занятие №1 «Кинематика и динамика поступательного и вращательного движения абсолютно твердого тела»
- •1. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •2. Примеры выполнения тестовых заданий
- •Практическое занятие №2 «Работа и энергия. Законы сохранения в механике. Механические колебания и волны»
- •1. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •2. Примеры выполнения тестовых заданий
- •Практическое занятие №3
- •Решение
- •Решение
- •2. Примеры выполнения тестовых заданий
- •Индивидуальные задания по практическим занятиям Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
Практическое занятие №3
«Молекулярно-кинетическая теория идеальных газов. ТЕРМОДИНАМИКА»
Примеры решения задач
Задача 1. Какова масса кислорода, заполняющего объем 5 л при давлении 2∙105 Па и температуре 50 С?
Дано: M = 32∙10-3 кг/моль, V = 5∙10-3 м3, р = 2∙105 Па, Т =278 К; m - ?
Решение
Будем считать кислород идеальным газом, для которого справедливо уравнение Клапейрона-Менделеева
![]() .
.
Подставляя данные, получим
![]() (кг).
(кг).
Задача 2. Если в баллоне, в котором находится идеальный газ, давление уменьшилось в 4 раза, а абсолютная температура понизилась вдвое, то какой процент газа выпустили из баллона?
Дано: р1
= 4 р2,
Т1
= 2Т2,
![]()
Решение
Параметры идеального газа в состояниях I и II (до и после утечки газа) приведены на рисунке

Запишем уравнение Клапейрона – Менделеева для двух состояний газа
![]() и
и
![]()
Решая систему этих уравнений, получим
![]() или
или
![]()
Задача 3. При какой температуре средняя квадратичная скорость молекулы кислорода больше их наиболее вероятной скорости на 100 м/c.
Дано: M = 32∙10-3 кг/моль, ∆υ = 100 м/c; Т - ?
Решение
Средняя квадратичная и наиболее вероятная скорости определяются следующими выражениями
![]() и
и
![]() ,
,
где M –молярная масса, R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
![]() .
.
Или
![]() (К).
(К).
Задача 4. Водород, находящийся при давлении р1 = 0,5 МПа и температуре Т1 = 350 К, подвергли сначала адиабатическому расширению от объема V1= 1 л до объема V2= 2 л, а затем изобарному расширению, в результате которого объем газа увеличился до объема V3 = 3 л. Определить для каждого из этих процессов: 1) работу, совершенную газом; 2) изменение его внутренней энергии; 3) количество подведенной к газу теплоты.
Дано: р1 = 0,5·106 Па, Т1 = 350 К, V1= 10-3 м3, V2= 2·10-3 м3, V3 = 3·10-3 м3;
А12 - ? А23 - ? U 12 - ? U 23 - ? Q 12 - ? Q 23 - ?
Решение
Согласно первому началу термодинамики, количество теплоты Q, сообщенное газу, расходуется на изменение внутренней энергии газа ∆U и совершение газом работы А против внешних сил
Q = ∆U + А.
Адиабатический процесс совершается без теплообмена с окружающей средой (Q12 = 0), поэтому ∆U12 = - А12.
Работа, совершаемая газом в адиабатическом процессе, определяется выражением
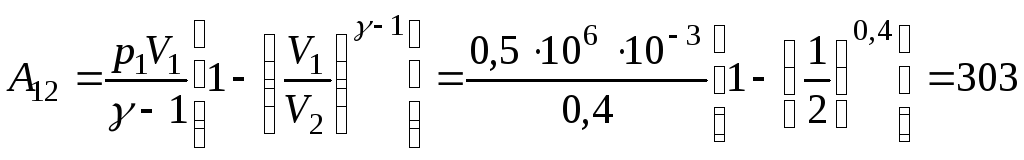 (Дж),
(Дж),
где
![]() - коэффициент Пуассона;
- коэффициент Пуассона;
i – число степеней свободы молекулы (для водорода – двухатомного газа i= 5, γ = 1,4).
Работа изобарного расширения равна А23=р2(V3 –V2).
Давление р2
найдем, воспользовавшись уравнением
Пуассона для адиабаты
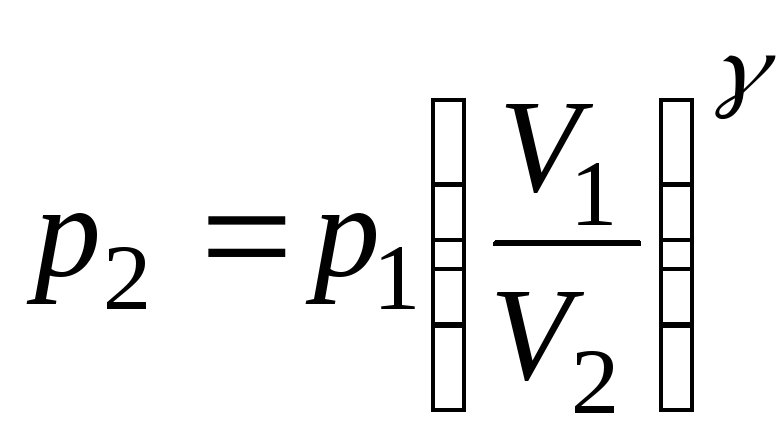 .
.
В итоге получим
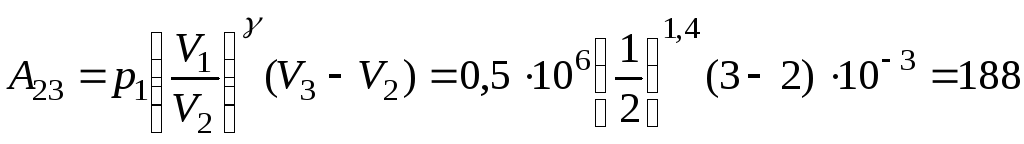 (Дж).
(Дж).
Изменение внутренней энергии при изобарном расширении газа определяется выражением
![]() (Дж).
(Дж).
Количество подведенной теплоты при изобарном расширении газа равно
Q23 = ∆U23 + А23 = 472 +188 = 660 (Дж).
Задача 5. Определить изменение энтропии ΔS при изотермическом расширении азота массой m = 10 г, если давление газа уменьшилось от р1 =0,1 МПа до р2 = 50 кПа.
Дано: М=28·10-3 кг/моль, р1 = 105 Па, р2 = 5·104 Па, m = 10-2 кг;
ΔS -?
Решение
Изменение энтропии, учитывая, что процесс изотермический,
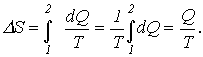
Согласно первому началу термодинамики, количество теплоты, полученное газом, равно
Q = А + U.
Для изотермического процесса U = 0, поэтому Q=А. Работа газа в изотермическом процессе определяется выражением
![]() .
.
Найдем изменение энтропии
![]() (Дж/К).
(Дж/К).
