
Лекция 2
.pdf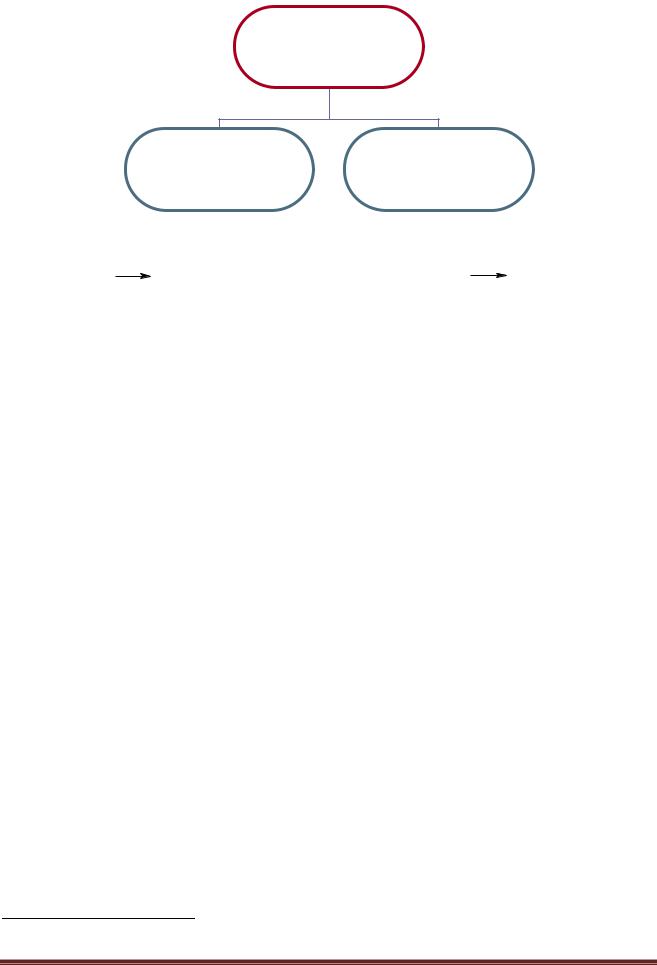
Разрыв связи
Гетеролитический |
Гомолитический |
(ионный) |
(радикальный) |
A |
|
B |
A+ + B |
|
|
A |
|
B |
A. + B. |
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
катион анион |
|
|
|
радикалы |
||
При гетеролитическом разрыве ковалентной связи образуются ионы, при гомолитическом образуются радикалы – частицы с неспаренными электронами1.
3.1.1.Классификация органических реакций по типу частиц, участвующих в реакции.
1.Радикальные реакции протекают с участием радикалов (например, радикальное замещение SR, радикальное присоединение AR)
2.Электрофильные реакции протекают с участием электрофилов. (например, электрофильное замещение SE, электрофильное присоединение AE). Электрофилы - ("любящие электроны") – это частицы (катионы или молекулы), имеющие свободную орбиталь, на которую они могут принимать электроны (практически “электрофил” это синоним кислоты Льюиса). Примеры электрофилов: H+, Br+, Cl+, NO2+ (катион нитрония), карбокатионы, Br2, Cl2, SO3 и т.д.
3.Нуклеофильные реакции протекают с участием нуклеофилов (например, нуклеофильное замещение SE, нуклеофильное присоединение AE)
1 При разложении катион-радикалов и анион-радикалов образуются ионы и радикалы – это ещѐ один способ разрыва связи.
norgchem.professorjournal.ru |
Страница 11 |

Нуклеофил (лат. nucleus – ядро (а оно положительно заряжено!), греч. любить)
– частица, имеющая отрицательный заряд или подвижную электронную пару. Фактически нуклеофилы являются основаниями Льюиса.
Примеры нуклеофилов: H-, F-, Cl-, Br-, I-, OH-, CH3O-, H2O, спирты, NH3, амины и т.д.
4. “Без механизма”. Реакции, протекающие без образования и участия радикалов или ионов. Например, реакция Дильса-Альдера:
+
бутадиен-1,3 этилен |
активированный комплекс циклогексен |
3.1.2. Классификация органических реакций по конечному результату реакции
1. Присоединение
Реакции присоединения обозначаются буквой A (англ. addition – присоединение).
1а. Пример реакции электрофильного присоединения AE – присоединение брома к этилену:
H2C |
|
CH2 + Br2 |
H2C |
|
CH2 |
|
|
||||
|
|
||||
|
|
|
Br Br |
||
1,2-дибромэтан
1б. Пример реакции нуклеофильного присоединения AN – присоединение синильной кислоты к ацетону:
H3C |
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|||
C |
|
O + HCN |
NC |
|
C |
|
O |
|
H |
|
|
||||||||||
|
|
|
|
|||||||
H3C |
|
|
|
|
|
|
|
|
||
|
|
CH3 |
||||||||
|
|
|
|
|
||||||
|
|
|
циангидрин ацетона |
|||||||
1в. Пример реакции радикального присоединения AR – присоединение хлора к |
||||||||||
бензолу на свету: |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
norgchem.professorjournal.ru |
|
|
|
|
|
|
|
Страница 12 |
||

Cl
Cl Cl
h
+ 3Cl2
Cl
 Cl
Cl
Cl
1,2,3,4,5,6,-гексахлорциклогексан
2. Замещение
Реакции замещения обозначаются буквой S (англ. substitution – замещение). 2а. Пример реакции радикального замещения SR – взаимодействие метана с хлором на свету:
CH4 + |
Cl2 |
h |
+ HCl |
CH3Cl |
|||
метан |
хлор |
хлорметан |
хлороводород |
2б. Пример реакции электрофильного замещения SE – взаимодействие бензола с бромом в присутствии катализатора:
|
H |
|
Br |
H |
H |
H |
H |
|
+ Br2 |
FeBr3 |
+ HBr |
|
|
||
H |
H |
H |
H |
|
H |
|
H |
|
бензол |
бромбензол |
|
2в. Пример реакции нуклеофильного замещения SE – взаимодействие бромэтана с гидроксидом натрия в спирте:
C2H5Br + NaOH |
C2H5OH + NaBr |
3. Элиминирование (отщепление)
Реакции элиминирования обозначаются буквой E (англ. elimination – отщепление). Реакции элиминирования обычно делятся на три типа: E1, E2, E1cb. Элиминирование обычно приводит к образованию кратной связи2. Например, элиминирование
2 При -элиминировании образуются карбены
norgchem.professorjournal.ru Страница 13

галогеноводородов от галогенопроизводных или воды от спиртов приводит к алкенам
:
|
CH3 |
KOH, C2H5OH |
CH |
2 |
|||||
CH |
|
Br |
|
|
|
|
|||
|
|
|
|
|
|
||||
|
CH |
|
|||||||
|
-HBr |
|
|||||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|||||||
2-бромпропан |
|
пропен |
|||||||
CH |
|
CH |
|
|
CH |
|
CH3 |
H2SO4 |
CH |
|
CH |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
||||||||
3 |
2 |
|
|
-H2O |
3 |
|
|
||||||||
|
|
|
|||||||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
бутанол-2 |
|
|
|
бутен-2 |
|||||||||||
4. Изомеризация – превращение вещества в его изомер.
Изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100oС в присутствии катализатора хлорида алюминия:
|
|
|
|
|
AlCl , 100o |
|
|
|
|
|
|
CH3 |
CH2 |
CH2 |
CH2 |
CH3 |
3 |
CH3 |
|
CH |
|
CH2 |
CH3 |
|
|
|
|||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
CH3 |
|
|||
|
н-пентан |
|
2-метилбутан |
||||||||
5. Окислительно-восстановительные реакции (ОВ-реакции).
Это реакции сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате перемещения электронов от восстановителя к окислителю.
Окисление – процесс перехода электронов от субстрата к окислителю. Восстановление – процесс перехода электронов от восстановителя к субстрату. Этот тип реакций может в себя включать вышерассмотренные типы реакций.
norgchem.professorjournal.ru |
Страница 14 |
Классификация ОВ реакций
5.1. Перенос электрона. При этом образуются катион-радикалы или анионрадикалы
-e |
. |
|
|
|
+ |
+e |
|
5.2. Отщепление водорода – дегидрирование
|
|
|
|
|
|
|
|
|
Cu |
|
|
O |
|
|
|
|
|
||
CH |
|
|
|
CH |
|
OH |
CH |
|
C |
+ H2 |
|||||||||
|
|
|
|
|
3 |
||||||||||||||
3 |
2 |
350oC |
|||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
этанол |
|
этаналь |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
OH |
H2Cr2O7 |
|
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
циклогексанол |
|
|
|
циклогексанон |
|||||||||||||||
Реакция окисления этанола НАД+-зависимым ферментом алкогольдегидрогеназой идѐт в печени:
|
|
|
|
|
O |
CH |
|
CH2 |
OH |
CH3 |
C |
3 |
|||||
|
|
|
|
|
H |
|
|
|
NAD+ |
NADH + H+ |
|
Окисление тиолов в дисульфиды является важной реакцией, идущей в организме: например, два остатка SH-содержащих аминокислоты цистеина образуют цистин, содержащий S-S связь, что очень важно для поддержания третичной структуры белка.
|
|
|
-2H+, -2e |
|||||||
2 R |
|
SH |
|
R |
|
S |
|
S |
|
R |
|
|
|
|
|
||||||
|
|
|
+2H+, +2e |
|||||||
тиол |
|
|
дисульфид |
|||||||
norgchem.professorjournal.ru |
Страница 15 |

Очень важной реакциями, идущими в живых организмах является обратимое окисление убихинона (коэнзим Q) в электронтранспортной цепи мембран митохондрий и с пластохинона в электрон-транспортный цепи хлоропластов. При этом образуются хиноны (показано на примере гидрохинона, лежащего в основе строения убихинона и пластохинона):
|
OH |
O |
||
|
|
|
|
|
|
|
|
|
|
-2H+, -2e
+2H+, +2e
|
|
|
|
|
OH |
O |
|||
гидрохинон п-бензохинон
5.3. Замещение водорода на более электроотрицательные группы.
|
|
|
O |
KMnO4, H+ |
|
O |
CH |
|
|
C |
CH3 |
C |
|
|
|
|
||||
3 |
|
|||||
|
H |
|
|
OH |
||
|
|
|
|
|
||
этаналь |
|
|
уксусная кислота |
|||
К этому типу ОВ реакций можно также отнести реакции радикального галогенирования алканов и многие другие.
5.4. Присоединение электроотрицательных атомов
Реакция Вагнера – качественная реакция на двойную связь: при добавлении алкена в щелочной раствор KMnO4 на холоду, выпадает бурый осадок оксида марганца IV:
H |
|
H |
KMnO4, OH |
- |
|
|
H |
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
H |
|
C |
|
C |
|
H |
|||
|
-MnO2 |
|
|
|
|
||||||||
|
|
||||||||||||
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
OH |
||||||||
|
|
|
|
|
|
|
|||||||
этилен |
|
|
этиленгликоль |
||||||||||
Окисление алкенов надкислотами до эпоксидов (Реакция Прилежаева):
norgchem.professorjournal.ru |
Страница 16 |
H |
|
H |
RCOOOH |
H |
|
H |
|
|
|
|
|
|
|
C |
|
C |
- RCOOH |
C |
|
C |
|
|
|||||
|
|
|||||
H |
|
H |
H |
O |
H |
|
|
|
|||||
|
|
|
|
|
|
|
этилен |
|
окись этилена |
||||
Образованием эпоксидов объясняется активация проканцерогенов – полициклических ароматических углеводородов.
5.5. Реакции, идущие с разрывом связи С-С.
Кетоны окисляются с разрывом связи С-С в жѐстких условиях, например в реакции Байера-Виллигера:
O O
RCOOOH  O -RCOOH
O -RCOOH
циклопентанон валеролактон
5.6. Полная деструкция.
Реакции горения и окисления в очень жѐстких условиях с образованием углекислого газа.
CH4 + 2 O2  CO2 + 2H2O
CO2 + 2H2O
5 C6H12O6 + 24KMnO4 + 36H2SO4 |
30 CO2 + 66H2O + 24 MnSO4 + 12K2SO4 |
norgchem.professorjournal.ru |
Страница 17 |
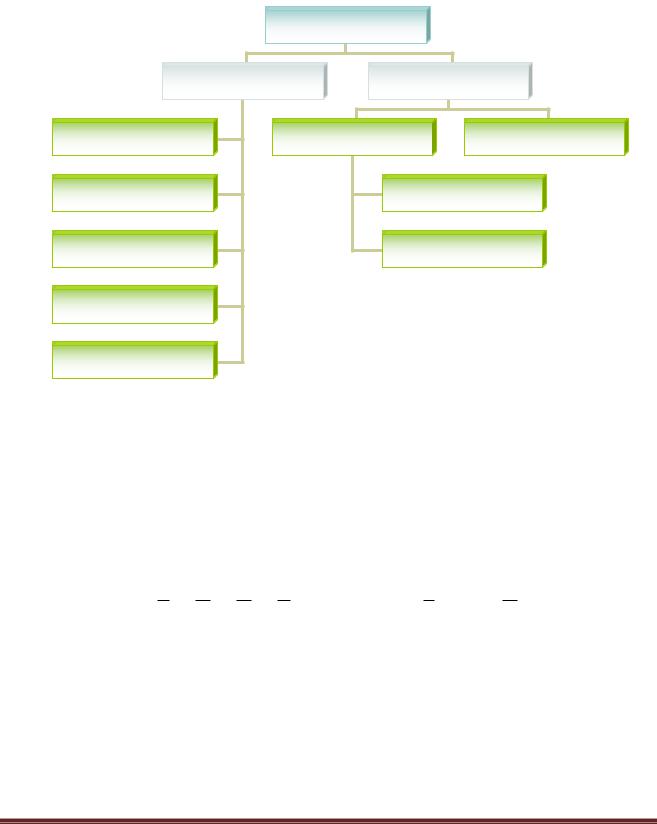
4. Изомерия.
Изомерия – явление существование веществ, имеющих одинаковую молекулярную формулу (т.е. имеющих одинаковый качественный и количественный состав), но различных по физическим и химическим свойствам.
Изомерия
Структурная Стереоизомерия (пространственная)
Изомерия углеродного скелета
Изомерия положения
Изомерия функциональной группы
Диастереомерия |
Энантиомерия |
|
|
- Диастереомерия
- Диастереомерия
Валентная изомерия
Другие виды (метамерия, межклассовая и т.д.)
4.1. Структурные изомеры отличаются структурой, то есть порядком соединения атомов в молекуле и порядком распределения связей.
1) изомерия углеводородного скелета (цепи):
|
|
|
|
|
C5H12 |
|
|||||
CH3 |
CH2 |
CH2 |
CH2 |
CH3 |
|
CH3 |
|
CH |
|
CH2 |
CH3 |
|
|||||||||||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
CH3 |
||||
|
н-пентан |
2-метилбутан (изопентан) |
|||||||||
2) изомерия положения: |
|
|
|
|
|
|
|
||||
norgchem.professorjournal.ru |
Страница 18 |

C6H12
гексен-1 |
гексен-2 |
гексен-3 |
3) изомерия функциональной группы:
|
|
|
C2H4O |
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|||
CH |
|
C |
|
H C |
|
CH |
|
3 |
|
|
2 |
||||
|
|||||||
|
|
H |
2 |
|
|
||
|
|
|
|
|
|
|
|
ацетальдегид |
|
окись этилена |
|||||
Ацетальдегид содержит альдегидную группу, а окись этилена – эпокси-группу.
4) Валентная изомерия:
C6H6
бензол |
бензол Дьюара |
Бензол и бензол Дьюара имеют разное распределение связей между атомами.
4.2. Стереоизомеры различаются пространственным расположением атомов в молекулах, т.е. стереоизомеры имеют различную конфигурацию. При этом последовательность связей в их молекулах одинакова.
Конфигурация – относительное пространственное расположение атомов в молекуле.
4.2.1 Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
norgchem.professorjournal.ru |
Страница 19 |
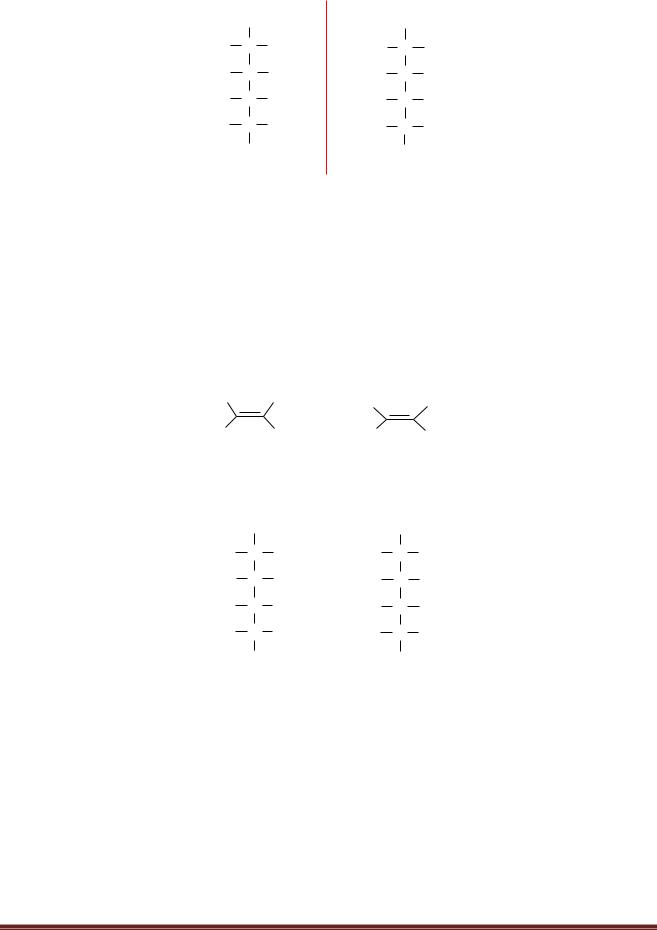
(например, D-глюкоза и L-глюкоза).
CHO
H C OH
HO C H
H C OH
H C OH
CH2OH
D-глюкоза
CHO HO C H
H C OH HO C H HO C H
CH2OH
L-глюкоза
4.2.2 Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Например, цис-транс изомеры (пример -диастереомерии), галактоза и глюкоза
(пример - диастереомерии).
H3C CH3
H H
цис-бутен-2
CHO
H C OH HO C H
H C OH H C OH CH2OH
D-глюкоза
H CH3
H3C H
транс-бутен-2
CHO
H C OH
HO C H
HO C H
H C OH
CH2OH
D-галактоза
Более подробно энантиомерия и диастереомерия будут рассмотрены в теме “гидроксикислоты”
norgchem.professorjournal.ru |
Страница 20 |
