
- •Методические рекомендации для студентов
- •3.Цели занятия.
- •3.2. Конкретные цели и задачи.
- •4.Вопросы, изученные на предшествующих дисциплинах и необходимые для усвоения темы.
- •5.Задания для самостоятельной подготовки к лабораторному занятию.
- •5.2. Задания для срс во внеучебное время.
- •6. Этапы проведения лабораторного занятия.
- •7.Ориентировочная основа действия (оод) для проведения самостоятельной работы студентов в учебное время.
- •8.Задания для контроля уровня сформированности компетенций в учебное время.
- •9.Учебно – материальное обеспечение.
- •9.1. Литература
- •10.Материальное обеспечение:
6. Этапы проведения лабораторного занятия.
|
№ п/п |
Название этапа |
Цель этапа |
Время (мин.) |
|
1 |
2 |
3 |
4 |
|
I. Вводная часть занятия |
10 | ||
|
1. |
Организация занятия |
Мобилизация внимания студентов: проверка присутствующих, их внешнего вида, наличия рабочих тетрадей и лекций. |
3 |
|
2. |
Определение темы, мотивации, целей и задач занятия |
Формирование мотивации данного занятия, значимости его в подготовке врача и, как следствие, активизация познавательной деятельности студентов. |
7 |
|
II. Основная часть занятия |
160 | ||
|
3. |
Контроль исходных знаний, умений, навыков (ЗУН) |
Выявление исходного уровня ЗУН. |
10 |
|
4. |
Общие и индивидуальные задания для СРС в учебное время |
Дифференцированное ориентирование студентов к предстоящей работе. |
30 |
|
5. |
Демонстрация методики лабораторной работы |
Разбор ориентировочной основы действия (ООД) в малых группах. |
15 |
|
6. |
Управляемая СРС в учебное время |
Выполнение эксперимента. Овладение профессиональными компетенциями ПК – 2, ПК – 3. |
50 |
|
7. |
Реализация лабораторной работы |
Обработка экспериментальных данных (расчёт массы сухого ионита, расчёт ПДОЕ). Контроль результатов обучения и оценка с помощью дескрипторов. |
35 |
|
8. |
Итоговый контроль |
Оценивание индивидуальных достижений студента, выявление ошибок и их корректировка. |
20 |
|
III. Заключительная часть занятия |
10 | ||
|
9. |
Подведение итогов занятия |
Оценка деятельности студентов и достижения цели занятия. |
8 |
|
10. |
Общие и индивидуальные задания для СРС во внеучебное время |
Подготовка по методическим рекомендациям для студентов к лабораторной работе «Определение порога коагуляции. Коллоидная защита». |
2 |
7.Ориентировочная основа действия (оод) для проведения самостоятельной работы студентов в учебное время.
Ӏ группа.
Приборы и реактивы: бюретка на 25 мл с винтовым зажимом, мерные цилиндры на 25 мл и 5 мл, пипетки на 5 мл, конические колбы для титрования, катионит КУ – 1; растворы - СuSO4 С(1/2СuSO4)=0,05 моль/л, KI ω=20%, H2SO4 (1/2 H2SO4) = 2,0 моль/л, Na2S2O3 C(1/1Na2S2O3) = 0,05 моль/л, крахмал.
Методика выполнения эксперимента
Колонку заполняют 4 мл набухшего катионита КУ – 1 в Н+ - форме. Отрегулировав скорость потока жидкости из бюретки по воде (~25 капель в минуту), выпускают воду, не допуская оголения катионита. Далее заполняют бюретку раствором СuSO4 и собирают фильтрат в мерные цилиндры по 25 мл, поддерживая установленный уровень раствора в бюретке. Количество непоглощенного СuSO4 в фильтрате проводят методом иодометрии.
Для этого из каждой порции на 25 мл отбирают пипеткой 5 мл фильтрата, переносят в коническую колбу, добавляют 4 мл Н2SO4, 10 мл раствора КI и 2 капли раствора крахмала.
Признаком появления в фильтрате непоглощенного СuSO4 является появление синего окрашивания по реакции:
2
СuSO4+4KI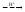 I2+2СuI+2К2SO4
I2+2СuI+2К2SO4
Выделившийся иод оттитровывают раствором тиосульфата натрия до обесцвечивания раствора, происходящего в результате реакции:
2Na2S2O3+I2→Na2S4O6+2NaI
Последняя порция, в которой на титрование 5 мл фильтрата затрачивается 10 мл раствора Na2S2O3, не учитывается, так как содержание в ней СuSO4 соответствует исходному и свидетельствует об истощении ионита.
Обработка результатов эксперимента.
Полная динамическая обменная емкость катионита (ПДОЕ) вычисляется путем использования экспериментально найденных значений объема пропущенного через катионит раствора СuSO4 и объема пошедшего на титрование раствора Na2S2O3.
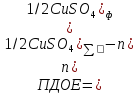

где а - число отбираемых порций фильтрата. Оно зависит от того, насколько быстро истощается катионит;
V(Na2S2O3) =V1+V2+V3 +……, т.е. сумма объёмов Na2S2O3, пошедших на титрование первой, второй и т.д. порций фильтрата (5 мл).
Массу сухого ионита находят по формуле:
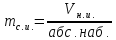
где Vн.и. - объём набухшего ионита; абс. наб. – абсолютная набухаемость.
ӀӀ группа.
Приборы и реактивы: бюретка на 25 мл с винтовым зажимом, мерный цилиндр на 10 мл, склянка вместимостью 250 мл, предметное стекло, пипетка глазная, капельницы; раствор меди сульфата С = 0, 025 моль/л, калий гексацианоферрат (ӀӀ) (кристалл.), катионит КУ – 1.
Методика выполнения эксперимента.
В нижнюю часть бюретки до первой отметки помещают кусочек стеклянной ваты, а затем - 10-15 мл набухшего сильнокислотного катионита в Н+ – форме. Катионит заливают водой и встряхивают до удаления пузырьков воздуха. Бюретку с помощью резинового шланга соединяют со склянкой, содержащей раствор СuSO4. Открывают винтовой зажим бюретки и пропускают раствор СuSO4 со скоростью 3 – 4 мл/мин. Фильтрат собирают в мерный цилиндр ёмкостью 10 мл. Отобранные фракции (объемом 10 мл) сливают в общую емкость – склянку вместимостью 250 мл. Для определения момента проскока ионов Сu2+периодически (через 2 – 3 мл) отбирают на предметное стекло по 1 – 2 капли фильтрата, добавляя 1 – 2 кристаллика К4[Fe(CN)6]. При появлении красно-коричневого окрашивания - качественная реакция на ион меди - пропускание раствора СuSO4 прекращают.
Обработка результатов эксперимента.
Вычисляют общий объем раствора СuSO4 [V(СuSO4)], пропущенный через катионит – фильтр, суммируя все фракции фильтрата по 10 мл и последнюю, которая может быть меньше 10 мл.
Количество вещества ионов меди (ммоль), поглощенных ионитом, рассчитывают по формуле
n(Cu2+)=C(СuSO4)·V(СuSO4)
ПДОЕ вычисляют, исходя из соотношения:
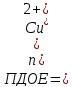 ,
моль/л
,
моль/л
где V (ионита) – объем набухшего катионита.
Зная абсолютную набухаемость (а.н.) катионита можно рассчитать ПДОЕ на единицу массы катионита (ммоль/г).
Сравнивают результаты, полученные I и II группами, рассчитывают ошибку эксперимента. Объясняют возможные причины ошибки.
