
овр
.pdf
Полуреакции окисления и восстановления
MnO4– + 8H+ Mn2+ + 4H2O |
Полуреакции с учетом |
|||
|
|
|
|
материального и |
|
|
|
|
|
SO |
2– + H O SO 2– + 2H+ |
|
электронного баланса |
|
3 |
2 |
4 |
|
|
Составление уравнения реакции в ионной форме:
2 MnO4– + 8H+ + 5e = Mn2+ + 4H2O
MnO4– + 8H+ + 5e = Mn2+ + 4H2O
5 SO32– + H2O – 2e = SO42– + 2H+
SO32– + H2O – 2e = SO42– + 2H+
5SO32– + 2MnO4– + 6H+ = 5SO42– + 2Mn2+ + 3H2O
Составление уравнения реакции в молекулярной форме:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 +K2SO4 + 3H2O

Сопряженные пары
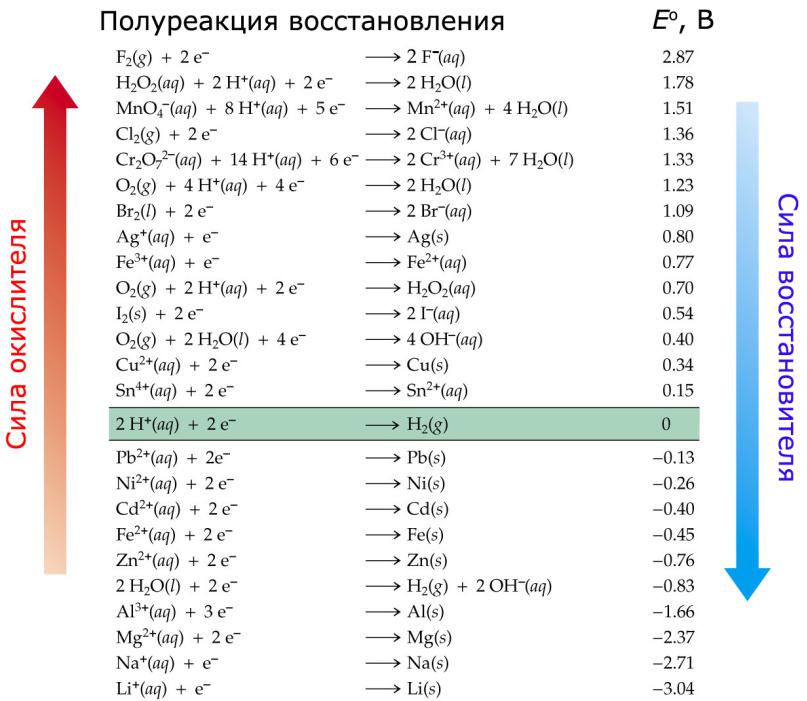
Общий вид полуреакции: |
Ox + ne Red, Eo (В) |
Ox – окислитель, Red – восстановитель, вместе – сопряженная пара
Количественная характеристика –
cтандартный окислительно-восстановительный потенциал E0 (В)
Чем больше E0, тем сильнее Ox как окислитель и слабее R как восстановитель
1 |
|
2H+ |
2e |
H |
, |
E |
= 0.000 В, |
H+ |
окислитель |
|||
|
||||||||||||
|
|
(р-р) |
|
|
2 |
|
|
|
|
|
|
|
1 |
|
Zn2+ |
2e |
Zn, |
|
E |
= 0.763 В, |
|
Zn |
восстановитель |
||
|
|
(р-р) |
|
|
|
|
|
|
|
|
|
|
Zn + 2H+ |
= Zn2+ |
+ H |
, |
|
E |
= E + |
E |
2+ |
|
= +0.763 В |
||
|
|
|
|
2 |
|
|
|
H |
/ H2 |
Zn / Zn |
|
|
|
|
|
|
|
|
|
|
|
||||

Стандартный окислительновосстановительный потенциал
Стандартный окислительно-восстановительный потенциал определяется как электродный потенциал относительно стандартного водородного потенциала
По определению: |
E (H+/H ) = 0.000 В |
|
2 |
Стандартные условия:
активности всех ионов равны 1, давления всех газов – 1 бар.
Примеры:
E (Zn2+ / Zn) = –0.760 В |
|
E (Cu2+ / Cu) = +0.337 В |

Полезные уравнения:
= nFE, F – заряд одного моля электронов, 96500 Кл / моль G = - nFE, то есть если
E>0, то G<0 и процесс самопроизвольно протекает
E<0, то G>0 и для проведения процесса необходима эдс
G0 = - nFE0 = - RTlnK, nFE0 / RT = lnK, E = (RT / nF) lnK
Вольт – эквивалент реакции (полуреакции) - величина,
равная произведению электродного потенциала на число электронов, принимающих участие в данной реакции.
Уравнение Нернста
G = -nFE,
где n – количество электронов, F – число Фарадея
F = 96485 Кл/моль
Уравнение Нернста связывает стандартный электродный потенциал с реальным, т.е. зависящим от активности компонентов
Для реакции |
Ox + ne Red |
|
|
E = E |
RT |
ln |
aOx |
= E |
0.059 |
lg |
aOx |
|
|
|
|
|
|||||
|
nF aR |
n |
|
aR |
||||
Следствие:
потенциал полуреакции зависит от pH среды

Применение уравнение Нернста
Для полуреакции: |
2H+ + 2e H |
|
2 |
При pH=7 (в чистой воде)
E = E |
0.059 |
lg |
C2 |
= 0.00 |
0.059lgCH = 0.059pH = 0.41 В |
|||||
|
|
H |
||||||||
|
2 |
|
pH2 |
|
|
|
|
|
|
|
|
|
|
|
Зависимость от pH среды |
||||||
|
|
|
|
|
||||||
Для полуреакции: |
|
MnO4– + 8H+ + 5e Mn2+ + 4H2O |
|
|||||||
|
|
|
||||||||
|
|
E = E0 + (0.059/5)lg[H+]8 = 1.51 – 0.094pH |
|
|||||||
|
|
|
|
|
|
|
pH=1 |
E=1.416 |
||
|
|
|
|
|
|
|
pH=2 |
E=1.322 |
||
|
|
|
|
|
|
|
pH=3 |
E=1.228 |
||
|
|
|
|
|
|
|
pH=4 |
E=1.134 |
||
|
|
|
|
|
|
|
pH=5 |
E=1.040 |
||
|
|
|
|
|
|
|
pH=6 |
E=0.946 |
||
|
|
|
|
|
|
|
pH=7 |
E=0.852 |
||

Диаграммы Латимера
Диаграммы Латимера – система обобщения количественных red/ox данных для конкретного элемента.
Слева направо записываются соединения элемента в порядке Понижения СО. Над стрелками записывают величины потенциалов.
Пример построения
Даны потенциалы электродных полуреакций:
Fe3+ |
+ 3e- = Fe0 |
E0 |
= -0.036 В |
Fe2+ |
+ 2e- = Fe0 |
E0 |
= -0.44 В |
Найдем E0(Fe3+/Fe2+):
E0(Fe3+/Fe2+) = 3E0(Fe3+/Fe0) – 2E0(Fe2+/Fe0) =
= 3x(-0.036) – 2x(-0.44) = +0.771 |
|
|
|||
+3 |
|
+2 |
|
0 |
|
|
0.771 |
|
0.44 |
||
Fe3+(aq) |
Fe2+(aq) |
Fe(тв.) |
|||
|
|
||||
0.036

Анализ диаграммы Латимера
+3 |
|
+2 |
|
0 |
|
|
0.771 |
|
0.44 |
||
Fe3+(aq) |
Fe2+(aq) |
Fe(тв.) |
|||
|
|
0.036
Справедливо только для pH=0
1.Fe3+ окислитель, восстанавливается только до Fe2+
2.Fe0 восстановитель, в отсутствие сильного окислителя окислится только до Fe2+
3.Fe2+ окисляется под действием сильного окислителя
|
|
|
|
|
|
|
|
Примеры реакций |
|
|
|
|
||||||||
1. |
2FeCl |
3 |
+ 2HI = I |
2 |
+ 2FeCl |
2 |
+ 2HCl |
|
|
Fe3+ |
Fe2+ |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. |
Fe + 2HCl = FeCl |
2 |
+ H |
2 |
|
|
|
|
|
|
|
|
Fe0 |
Fe2+ |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3. |
3Fe(NO |
) + 4HNO |
3 |
= 3Fe(NO |
3 |
) |
3 |
+ NO + 2H |
2 |
O |
Fe2+ |
Fe3+ |
||||||||
|
|
|
|
3 2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
Диаграммы Латимера для pH=0 и pH=14
ClO –(aq) + 2H+(aq) + 2e– = ClO |
–(aq) + H |
O(ж.) |
E = +1.201 В |
||
4 |
|
3 |
2 |
|
|
|
|
|
|||
ClO |
–(aq) + H O(ж) + 2e– = ClO –(aq) + 2OH –(aq) |
E = +0.374 В |
|||
4 |
2 |
3 |
|
|
|
Потенциалы электродных полуреакций различны для кислой и щелочной среды
Вкислой среде стандартное условие pH=0, pOH=14
Вщелочной среде стандартное условие pH=14, pOH=0
E0(ClO4-/ClO3-) = +1.201 В для pH=0 (стандартное условие кислой среды)
E0(ClO4-/ClO3-) = +0.374 В для pH=14 (стандартное условие щелочной среды)
