
- •Содержание
- •Термодинамика электрохимических процессов. Электродвижущие силы и электродные потенциалы Термодинамика электрохимических систем
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Электрохимические цепи
- •Экспериментальная часть Лабораторная работа 1 определение электродвижущих сил гальванических элементов
- •Методика эксперимента
- •Отчет по работе
- •Лабораторная работа 2 измерение температурного коэффициента гальванического элемента и расчёт термодинамических величин
- •Методика эксперимента
- •Отчет по работе
- •Определение коэффициента активности измерением эдс гальванических элементов
- •Методика эксперимента
- •Отчет по работе
- •Определение pН буферного раствора с помощью хингидронного электрода
- •Методика эксперимента
- •Отчет по работе
- •Потенциометрическое титрование
- •Методика эксперимента
- •Отчет по работе
- •Библиографический список
Содержание
|
Термодинамика электрохимических процессов. Электродвижущие силы и электродные потенциалы |
4 |
|
Экспериментальная часть Лабораторная работа 1 Определение электродвижущих сил гальванических элементов
|
17 17 |
|
Лабораторная работа 2 Измерение температурного коэффициента гальванического элемента и расчет термодинамических величин
|
19
|
|
Лабораторная работа 3 Определение коэффициента активности измерением ЭДС гальванических элементов
|
21 |
|
Лабораторная работа 4 Определение рН буферного раствора с помощью хингидронного электрода
|
23 |
|
Лабораторная работа 5 Потенциометрическое титрование
|
24 |
|
Библиографический список
|
29 |
Термодинамика электрохимических процессов. Электродвижущие силы и электродные потенциалы Термодинамика электрохимических систем
В электрохимических системах происходит взаимное превращение свободной энергии химических реакций и электрической энергии. Для термодинамически обратимой химической реакции
aА + bB= cC + dD,
протекающей в электрохимической цепи (гальваническом элементе) при постоянных температуре и давлении, уменьшение энергии Гиббса равно максимальной полезной работе, которую может совершить система, т.е. электрической работе, которую может совершить гальванический элемент:
![]() ,
(1)
,
(1)
где z – число электронов, участвующих в реакции, E – электродвижущая сила элемента (ЭДС), В, F – число Фарадея.
Подстановка (1) в
уравнение Гиббса-Гельмгольца
 даёт выражение
даёт выражение ,
(2)
,
(2)
в котором
![]() есть температурный коэффициент,
определяемый экспериментально по
зависимости ЭДС
гальванического
элемента от температуры. Для малых
температурных интервалов, когда
зависимость
есть температурный коэффициент,
определяемый экспериментально по
зависимости ЭДС
гальванического
элемента от температуры. Для малых
температурных интервалов, когда
зависимость
![]() близка к линейной,
температурный коэффициент может быть
найден приближённо по формуле
близка к линейной,
температурный коэффициент может быть
найден приближённо по формуле
 ,
(3)
,
(3)
где E1
и E2
– ЭДС элемента соответственно при
температурах T1
и T2.
Если температурный коэффициент ЭДС
положительный, то энтропия реакции ∆S
и теплота обратимого процесса Т∆S
положительны. При этом элемент работает
с поглощением теплоты из окружающей
среды при изотермическихусловиях
или с охлаждением при адиабатических
условиях. И, наоборот, если
![]() отрицательно, то элемент работает за
счёт убыли внутренней энергии с выделением
теплоты в окружающую среду или с
нагреванием в адиабатических условиях.
При
отрицательно, то элемент работает за
счёт убыли внутренней энергии с выделением
теплоты в окружающую среду или с
нагреванием в адиабатических условиях.
При =0,
т.е. когда ЭДС элемента не зависит от
температуры, работа элемента происходит
за счёт только убыли внутренней энергии
системы без выделения или поглощения
теплоты.
=0,
т.е. когда ЭДС элемента не зависит от
температуры, работа элемента происходит
за счёт только убыли внутренней энергии
системы без выделения или поглощения
теплоты.
По зависимости ЭДС от температуры можно рассчитать изменение энтропии:
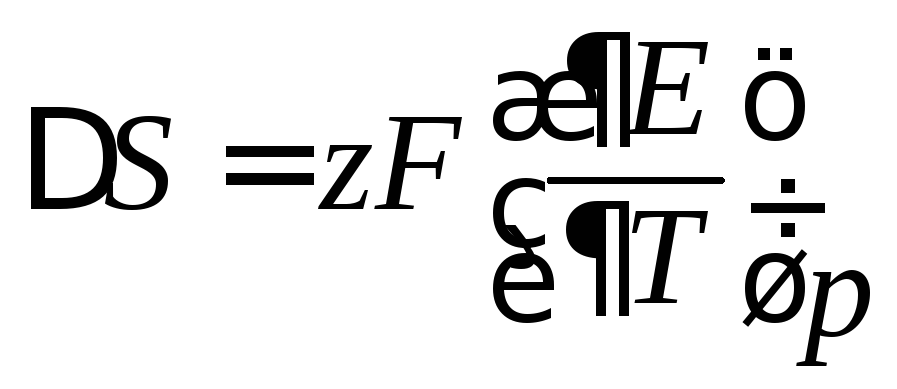 ,
(4)
,
(4)
а по уравнению (2) – изменение энтальпии H:
![]() .
(5)
.
(5)
Полученную величину полезно сравнить со значением H, рассчитанным по уравнению
 .
(6)
.
(6)
Применение законов термодинамики к электрохимическим системам позволяет рассчитать значения ЭДС и равновесных электродных потенциалов. Для указанной выше реакции, протекающей в электрохимической цепи при постоянных давлении и температуре, из уравнения изотермы химической реакции следует:
 ,
(7)
,
(7)
где Ка – константа равновесия.
Учитывая формулу (1), получаем термодинамическое выражение для ЭДС:
 .
(8)
.
(8)
Если активность каждого компонента равна единице, то ЭДС гальванического элемента называется стандартной и обозначается Е0:
![]() .
(9)
.
(9)
С учетом (9) уравнение (8) можно представить в виде:
 .
(10)
.
(10)
Учитывая, что
R=8,314
![]() иF=96500
иF=96500
![]() и заменяя натуральный логарифм на
десятичный, приT=298
К уравнение (10) можно преобразовать к
виду:
и заменяя натуральный логарифм на
десятичный, приT=298
К уравнение (10) можно преобразовать к
виду:
 .
(11)
.
(11)
В разбавленных растворах активности в уравнениях могут быть заменены на концентрации. Если в электродных процессах участвуют чистые твердые или жидкие вещества, то их активности равны 1.
