
- •Требования к оформлению отчета
- •Лабораторная работа №1 электродные потенциалы металлов
- •Лабораторная работа № 2 Контактная коррозия металлов
- •Практическая часть
- •Ход работы
- •Обработка экспериментальных данных
- •Лабораторная работа №3 защита сталей внешним током от коррозии
- •Практическая часть
- •Обработка экспериментальных данных
- •Защита стали от коррозии с помощью анодного протектора
- •Практическая часть
- •Ход работы
- •Приложение 1
Наука о коррозии металлов имеет огромное прикладное значение в металлургической промышленности, позволяя разрабатывать и внедрять новые методы противокоррозионной защиты металла, а также увеличивать коррозионную стойкость сплава путем варьирования его химического состава и металлографической структуры. Именно поэтому целью любого научного исследования в области коррозии является выявление закономерностей процесса разрушения металла в различных условиях для создания теоретических основ и практической реализации методов защиты. Таким образом, наука о коррозии - коррозиология - занимает промежуточное положение между естественными и прикладными науками, а научной базой курса «Коррозия и защита металлов» являются физическая химия, металловедение и материаловедение, позволяющие связывать закономерности физико-химических превращений металлов и сплавов с их металлографическими, механическими и другими характеристиками. Поэтому в практику коррозионных исследований широко вошли такие физико-химические методы анализа, как хронопотенцио-, вольтамперо- и гравиметрия.
Для будущих специалистов металлургического профиля хорошее усвоение курса «Коррозия и защита металлов» невозможно без ознакомления с этими методами на лабораторных занятиях, конечной целью которых является, во-первых, овладение основами методов коррозионных исследований, и, во-вторых, умение интерпретировать полученные результаты и в должной мере распространять их на иные условия эксплуатации металлоизделия.
Результаты каждой лабораторной работы должны быть оформлены и представлены в виде отчета в соответствии с требованиями, изложенными ниже.
Требования к оформлению отчета
Отчет по лабораторной работе должен включать:
название работы;
цель работы;
теоретическую часть, содержащую основные теоретические сведения об изучаемом в работе явлении или процессе;
практическую часть, содержащую схемы лабораторных установок, таблицы полученных величин и параметров, необходимые их графические представления;
вывод, кратко отражающий результаты лабораторной работы.
Лабораторная работа №1 электродные потенциалы металлов
Цель работы: определение значений и природы электродных потенциалов железа и меди в растворах электролитов.
Процесс электрохимической коррозии металла в электролите представляет собой совокупность двух сопряженно протекающих электрохимических реакций – анодной (1.1) и катодной (1.2):
Ме→Меn++ne, (1.1)
D+ne→[Dne]. (1.2)
Веществом D (деполяризатором) могут являться как ионы металла Men+, так и Н+-ионы, О2--молекулы и другие частицы, способные к восстановлению. Возможность протекания электрохимической коррозии определяется величиной разности электродных потенциалов анодной (Е0а) и катодной (Е0к) реакций, значения которых могут быть рассчитаны из уравнения Нернста:
![]() ,
(1.3)
,
(1.3)
![]() ,
(1.4)
,
(1.4)
где
![]() и
и![]() - стандартные значения электродных
потенциалов,
- стандартные значения электродных
потенциалов,![]() и
и![]() - активности частиц Меn+
и
D
в растворе.
- активности частиц Меn+
и
D
в растворе.
Если
металл (Ме) погружен в раствор, содержащий
одноименные с ним Меn+-ионы,
то в катодной реакции (1.2) под веществом
D
понимаются Меn+-ионы,
и процесс сводится к их разряду на
поверхности металла и вхождению в его
решетку. В этом случае коррозионное
разрушение металла не происходит, и
значение потенциала, формирующегося
на металле в таком растворе, называется
обратимым (![]() ).
).
В реальных условиях в катодной реакции (1.2) принимают участие, как правило, иные частицы, поэтому ионы, перешедшие из решетки металла в раствор по реакции (1.1), обратно в решетку не возвращаются, и развивается электрохимическая коррозия. Потенциал металла называют необратимым и его значение не подчиняется уравнению Нернста (1.3). Примерами такой катодной реакции, называемой деполяризацией, могут служить процессы восстановления водорода и кислорода:
![]() ,
(1.5)
,
(1.5)
![]() .
(1.6)
.
(1.6)
Уравнение Нернста в этом случае имеет вид
 ,
(1.7)
,
(1.7)
где
![]() -
стандартный электродный потенциал,
равный +0,401 В при 250С
с изотермическим коэффициентом
-
стандартный электродный потенциал,
равный +0,401 В при 250С
с изотермическим коэффициентом
 мВ/град,
мВ/град,![]() -
парциальное давление кислорода (для
воздуха
-
парциальное давление кислорода (для
воздуха![]() =0,21
атм),
=0,21
атм),![]() - активность ОН—ионов
в растворе.
- активность ОН—ионов
в растворе.
Для
выявления природы электродного потенциала
металла в растворе следует сопоставить
измеренное значение (Ех)
и рассчитанное теоретически по уравнению
(1.3), для чего необходимо знать величину
активности Меn+-ионов
в электролите. В нейтральных электролитах
коррозия металла сопровождается
образованием труднорастворимого
соединения состава MemAn
(например, Fe(OH)2)
на поверхности металла. При этом
активность Men+-ионов
рассчитывают из значения произведения
растворимости (![]() )
соединения:
)
соединения:
![]() ,
(1.8)
,
(1.8)
откуда
следует, что активность
![]() равна
равна
 .
(1.9)
.
(1.9)
Выявление природы электродного потенциала металла имеет большое значение при изучении кинетики электрохимической коррозии для установления контролирующего фактора, то есть наиболее замедленной ступени коррозионного процесса. Такими ступенями являются реакции: ионизации металла (1.1), восстановления деполяризатора (1.2). Количественно величина контролирующего фактора оценивается степенью анодного (Са) и катодного (Ск) контроля:
 ,
(1.10)
,
(1.10)
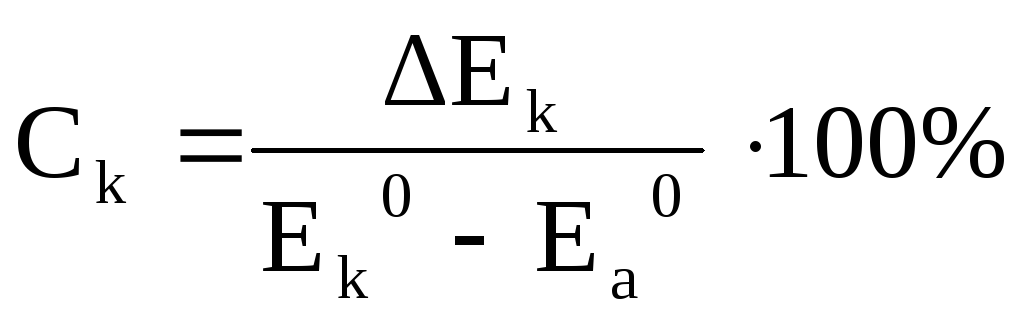 ,
(1.11)
,
(1.11)
где Ек0 и Еа0 – обратимые электродные потенциалы анодной и катодной реакций, ∆Еа = ЕМе - Еа0, ∆Ек = ЕМе - Ек0, ЕМе – измеренное по водородной шкале значение электродного потенциала металла.
Сравнивая значения Са и Ск, можно установить, какой из процессов – анодный или катодный – определяет скорость электрохимической коррозии металла.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Лабораторная работа состоит из следующих заданий:
Измерить электродный потенциал меди в растворах, содержащих Cu2+-ионы.
Измерить электродный потенциал железа в растворах, содержащих Fe2+-ионы.
Измерить электродный потенциал железа в растворе хлорида натрия.
Ход работы
Измерение значений электродных потенциалов проводят на установке, схема которой представлена на рис. 1.1. Поверхность образца исследуемого металла зачищают абразивным материалом, обезжиривают органическим растворителем и закрепляют клеммой в тексталитовой пластине.
Установку собирают в такой последовательности:
Заполняют солевые мостики и хлорсеребряный электрод сравнения раствором хлорида калия;
Устанавливают солевые мостики и электрод сравнения в установку;
Подключают электрические контакты.
П осле
этого стакан с рабочим электродом
заполняют исследуемым раствором,
фиксируют время начала эксперимента,
снимают показания вольтметра (Ех)
и записывают результаты в таблицу (1.1)
отдельно для каждого металла и раствора.
Опыт продолжают в течение 15 мин, измеряя
и фиксируя значения электродного
потенциала металла через каждую минуту.
осле
этого стакан с рабочим электродом
заполняют исследуемым раствором,
фиксируют время начала эксперимента,
снимают показания вольтметра (Ех)
и записывают результаты в таблицу (1.1)
отдельно для каждого металла и раствора.
Опыт продолжают в течение 15 мин, измеряя
и фиксируя значения электродного
потенциала металла через каждую минуту.
Перед измерением электродного потенциала металла в новом растворе образец промывают водой и вновь осуществляют обработку его поверхности.
Таблица 1.1
Исследуемый металл:
Рабочий электролит:
Температура:
|
Время, мин |
Ех , В |
ЕМе, В |
|
|
Етеор, В |
Примечание |
|
|
|
|
|
|
|
|
Измеренные значения электродного потенциала (Ех) пересчитывают на нормальный водородный электрод (нвэ) по формуле
ЕМе = Ех + 0,22, (1.12)
и полученные значения заносят в таблицу.
Обработка экспериментальных данных по заданию №1,2
Величину активности ионов металла в растворе рассчитывают на основании значения концентрации раствора по формуле
![]() ,
(1.13)
,
(1.13)
где
m
– моляльная концентрация электролита
(указана на склянке с раствором),
![]() - средний коэффициент активности,
зависящий от ионной силы раствора;
значения
- средний коэффициент активности,
зависящий от ионной силы раствора;
значения![]() приведены в приложении 1.
приведены в приложении 1.
На
основании активности ионов металла в
растворе по уравнению (1.3) рассчитывают
теоретическое значение электродного
потенциала (Етеор).
Необходимые значения стандартных
потенциалов
![]() и
и![]() приведены в приложении 2.
приведены в приложении 2.
На
миллиметровой бумаге строят графики
зависимости измеренного значения
потенциала, пересчитанного на водородную
шкалу (ЕМе)
и рассчитанного по уравнению (1.3) от
величины
![]() ,
сравнивают полученные кривые и делают
вывод об обратимости или необратимости
электродного потенциала металла в
данном растворе.
,
сравнивают полученные кривые и делают
вывод об обратимости или необратимости
электродного потенциала металла в
данном растворе.
Обработка экспериментальных данных по заданию №3
Считая,
что при коррозии железа в растворе
хлорида натрия катодная реакция
осуществляется молекулами О2
в соответствии с уравнением (1.6), значение
электродного потенциала катодного
процесса (Ек)
рассчитывают по уравнению (1.7). При этом
необходимую величину
![]() определяют из условия нейтральности
раствора (рН=7), принимая ее равной 10-7
моль/л. Активность ионов металла в
растворе
определяют из условия нейтральности
раствора (рН=7), принимая ее равной 10-7
моль/л. Активность ионов металла в
растворе
![]() рассчитывают по формуле (1.9), считая, что
продуктом коррозии (MemAn)
является малорастворимое вещество
Fe(OH)2
и используя величину произведения
растворимости L=1,65.10-15.
После этого по формулам (1.10) и (1.11)
рассчитывают степень анодного и катодного
контроля и для установившегося значения
электродного потенциала делают вывод
о природе электродного потенциала
железа в растворе соли.
рассчитывают по формуле (1.9), считая, что
продуктом коррозии (MemAn)
является малорастворимое вещество
Fe(OH)2
и используя величину произведения
растворимости L=1,65.10-15.
После этого по формулам (1.10) и (1.11)
рассчитывают степень анодного и катодного
контроля и для установившегося значения
электродного потенциала делают вывод
о природе электродного потенциала
железа в растворе соли.
На основании полученных результатов делают выводы о природе электродных потенциалов (обратимые или необратимые) исследованных металлов в разных электролитах, указывают контролирующий фактор и степень контроля при протекании коррозионного процесса.
