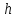2012
Отчет по лабораторной работе
«Определение отношения теплоемкостей воздуха при постоянных давлении и объеме»
Выполнил студент группы 1538
Ермаков Михаил
Цель работы – изучение процессов
в идеальных газах, определение отношения
теплоемкостей (коэффициента Пуассона)

Удельной теплоемкостью вещества называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для изменения ее температуры на один кельвин:

Соответственно наименование размерности удельной теплоемкости Дж/(кг·К).

Молярной теплоемкостью вещества называется физическая величина C равная количеству теплоты, которую необходимо сообщить одному молю вещества для изменения его температуры на один кельвин:
 ,
где m–масса, μ–молярная масса вещества,
отношение
,
где m–масса, μ–молярная масса вещества,
отношение
 определяет число молей. Наименование
размерности молярной теплоемкости -
Дж/(моль·К).
определяет число молей. Наименование
размерности молярной теплоемкости -
Дж/(моль·К).
Значение теплоемкости газов зависит от условий их нагревания. В соответствии с первым началом (законом) термодинамики количество теплоты δQ, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы δА против внешних сил:

Увеличение внутренней энергии идеального газа в случае изменения его температуры на dТ равно

Здесь R – универсальная газовая постоянная, i – число степеней свободы молекулы, под которыми подразумевается число независимых координат, определяющих положение молекулы в пространстве.
Для одноатомной молекулы i=3, поскольку такая молекула имеет только три поступательных степени свободы, соответствующие трем осям декартовой системы координат.
Для двухатомной молекулы i=5, так как добавляются еще две вращательных степени свободы, соответствующие возможности вращения вокруг двух осей перпендикулярных воображаемой прямой, «соединяющей» атомы. И, наконец, i=6 – для трехатомных (нелинейных) молекул, поскольку добавляется третья вращательная степень свободы. При расширении газ выполняет работу

Если идеальный газ нагревать при постоянном объеме V=const, то δА=0 , и согласно первому началу термодинамики все полученное газом количество теплоты расходуется только на увеличение его внутренней энергии δQV=dU. С учетом выражения (4.4), молярная теплоемкость газа при постоянном объеме CV:

Если идеальный газ нагревать при постоянном давлении (Р=const), то полученное газом количество теплоты расходуется не только на увеличение внутренней энергии dU , но и выполнение работы δА: δQP = dU + PdV .
Тогда молярная теплоемкость газа при постоянном давлении CP:

Используя уравнение состояния идеального газа (уравнение Клапейрона-
Менделеева)

можно показать, что для одного моля идеального газа

и поэтому

Отношение теплоемкостей

Адиабатным называется процесс, протекающий без теплообмена с окружающей средой, т.е. при выполнении условия dQ=0.
На практике он может быть осуществлен в системе, окруженной теплоизоляционной оболочкой, но поскольку для теплообмена необходимо некоторое время, то адиабатным можно считать также процесс, который протекает так быстро, что система не успевает вступить в теплообмен с окружающей средой.
Первое начало (закон) термодинамики с учетом для адиабатного процесса имеет вид

Продифференцировав уравнение Клапейрона-Менделеева
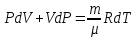
и подставив dТ в формулу, получим

Учитывая соотношение между молярными теплоемкостями идеального газа при постоянном давлении и объеме, которое описывается формулой Майера, а также отношение, получим

Решение написанного дифференциального уравнения имеет вид

Уравнение называют уравнением адиабаты (уравнением Пуассона), а величину γ – показателем адиабаты (коэффициентом Пуассона). Метод определения показателя адиабаты, предложенный Клеманом и Дезормом (1819), основывается на изучении параметров состояния некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатным и изохорным. Эти процессы на диаграмме P–V (рис. 4.1) изображены соответственно кривыми 1–2 и 2–3. Если в баллон, соединенный с открытым водяным манометром, накачать воздух и подождать до установления теплового равновесия с окружающей средой, то в этом начальном состоянии газ имеет параметры P1, V1, T1, причем температура газа в баллоне равна температуре окружающей среды Т1= Т0, а давление P1=P0+Р' немного больше атмосферного.
Если теперь на короткое время соединить баллон с атмосферой, то произойдет адиабатное расширение воздуха. При этом воздух в баллоне перейдет в состояние 2, а его давление понизится до атмосферного P2=P0. Масса воздуха, оставшегося в баллоне, которая в состоянии 1 занимала часть объема баллона, расширяясь, займет весь объем V2. В процессе расширения температура воздуха, оставшегося в баллоне, понизится до Т2. Поскольку процесс 1–2 – адиабатный, к нему можно применить уравнение Пуассона:

Откуда следует, что

 После
кратковременного соединения баллона
с атмосферой охлажденный из-за адиабатного
расширения воздух в баллоне будет
нагреваться (процесс 2–3) до температуры
окружающей среды Т3=Т0 при
постоянном объеме V3=V2.
При этом давление поднимется до P3=P2+P’’
Поскольку процесс 2–3 - изохорный, к нему
можно применить закон Шарля:
После
кратковременного соединения баллона
с атмосферой охлажденный из-за адиабатного
расширения воздух в баллоне будет
нагреваться (процесс 2–3) до температуры
окружающей среды Т3=Т0 при
постоянном объеме V3=V2.
При этом давление поднимется до P3=P2+P’’
Поскольку процесс 2–3 - изохорный, к нему
можно применить закон Шарля:

и получить соотношение:

Из уравнений находим:

После логарифмирования этого уравнения получаем:

Поскольку избыточные давления P' и P'' малы по сравнению с атмосферным давлением P0 и применяя приближенную формулу ln(1+x)≈x (формула справедлива при х<<1), будем иметь:

Откуда
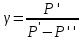
Избыточные давления P' и P'' измеряют с помощью U- образного манометра по разности уровней жидкости с плотностью ρ:


где H и h – разности уровней в коленах U-образного манометра. Получим расчетную формулу для определения γ:


Рис. 4.2. Общий вид экспериментальной установки ФПТ 1-6:
1 – стойка, 2 – блок манометра, 3 – блок приборов, 4 – пневмотумблер «Атмосфера»
Для определения отношения теплоемкостей
воздуха
 предназначена
экспериментальная установка ФПТ 1-6,
общий вид которой показан на рис. 4.
предназначена
экспериментальная установка ФПТ 1-6,
общий вид которой показан на рис. 4.
Установка состоит из стеклянной колбы, соединенной с открытым водяным манометром 2. Воздух нагнетается в колбу микропроцессором, размещенным в блоке рабочего элемента 3. Микропроцессор включается тумблером «Воздух», установленным на передней панели приборного блока. Пневмотумблер «Атмосфера» 4, расположенный на приборной панели блока, позволяет при повороте его по часовой стрелке до щелчка соединить колбу с атмосферой.
Результаты измерений
Таблица 1
|
№ |
|
|
|
|
|
|
|
|
||||||||
|
1 |
1 |
95 |
-65 |
160 |
35 |
-10 |
45 |
1.4 |
0.02 |
|||||||
|
2 |
95 |
-65 |
35 |
-10 |
||||||||||||
|
3 |
95 |
-65 |
35 |
-10 |
||||||||||||
|
2 |
1 |
100 |
-70 |
170 |
36 |
-9 |
45 |
1.36 |
0.016 |
|||||||
|
2 |
100 |
-70 |
36 |
-9 |
||||||||||||
|
3 |
100 |
-70 |
36 |
-9 |
||||||||||||
|
3 |
1 |
105 |
-75 |
180 |
37 |
-8 |
45 |
1.33 |
0.015 |
|||||||
|
2 |
105 |
-75 |
37 |
-8 |
||||||||||||
|
3 |
105 |
-75 |
37 |
-8 |
||||||||||||
|
4 |
1 |
110 |
-80 |
190 |
40 |
-15 |
55 |
1.4 |
0.015 |
|||||||
|
2 |
110 |
-80 |
40 |
-15 |
||||||||||||
|
3 |
110 |
-80 |
40 |
-15 |
||||||||||||
|
5 |
1 |
115 |
-85 |
200 |
40 |
-15 |
55 |
1.37 |
0.014 |
|||||||
|
2 |
115 |
-85 |
40 |
-15 |
||||||||||||
|
3 |
115 |
-85 |
40 |
-15 |
||||||||||||
|
6 |
1 |
120 |
-90 |
210 |
40 |
-15 |
55 |
1.35 |
0.013 |
|||||||
|
2 |
120 |
-90 |
40 |
-15 |
||||||||||||
|
3 |
120 |
-90 |
40 |
-15 |
||||||||||||
|
7 |
1 |
125 |
-95 |
220 |
40 |
-11 |
51 |
1.3 |
0.012 |
|||||||
|
2 |
125 |
-95 |
40 |
-11 |
||||||||||||
|
3 |
125 |
-95 |
40 |
-11 |
||||||||||||
|
8 |
1 |
130 |
-100 |
230 |
47 |
-20 |
67 |
1.41 |
0.013 |
|||||||
|
2 |
130 |
-100 |
47 |
-20 |
||||||||||||
|
3 |
130 |
-100 |
47 |
-20 |
||||||||||||
|
9 |
1 |
135 |
-105 |
240 |
55 |
-26 |
81 |
1.5 |
0.013 |
|||||||
|
2 |
135 |
-105 |
55 |
-26 |
||||||||||||
|
3 |
135 |
-105 |
55 |
-26 |
||||||||||||
|
10 |
1 |
140 |
-110 |
250 |
52 |
-22 |
74 |
1.42 |
0.011 |
|||||||
|
2 |
140 |
-110 |
52 |
-22 |
||||||||||||
|
3 |
140 |
-110 |
52 |
-22 |
||||||||||||


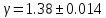
Вывод: коэффициент Пуассона для воздуха совпадает с табличным значением в пределах погрешности.