
- •46. Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
- •Формула
- •48. Первый закон термодинамики
- •Термодинамическая работа
- •49. Теплота (обозначается q, также называется количество теплоты) — мера энергии, переходящей от одного тела к другому в процессе теплопередачи. В системе сИединицей измерения теплоты является джоуль.
- •50. Теплоемкость идеального газа в изопроцессах
41. Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура,давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия.
Изолированная система (замкнутая cистема) — термодинамическая система, которая не обменивается с окружающей средой нивеществом, ни энергией. В термодинамике постулируется (как результат обобщения опыта), что изолированная система постепенно приходит в состояние термодинамического равновесия, из которого самопроизвольно выйти не может (нулевое начало термодинамики).
|
|
Масса (лат. massa), магнитное квантовое число (англ. magnetic quantum number), магнитный момент (англ. magnetic moment), эффективная масса, дефект массы, масса Планка |
|
|
Частота, нейтрино, кинематический коэффициент вязкости, стехиометрический коэффициент, количество вещества, ларморова частота, колебательное квантовое число |
|
|
Коэффициент трения, динамическая вязкость, магнитная проницаемость, магнитная постоянная, химический потенциал, магнетон Бора, мюон , возведённая масса, молярная масса, коэффициент Пуассона, ядерный магнетон |
|
|
Объём (фр. volume), напряжение (англ. voltage), потенциальная энергия, видность полосы интерференции, постоянная Верде (англ. Verdet constant) |
|
|
Температура (лат. temperātūra), период (лат. tempus), кинетическая энергия, критическая температура, терм, период полураспада, критическая энергия, изоспин |
42.
Молекулярно-кинетическая
теория — это раздел физики, изучающий
свойства различных состояний вещества,
основывающийся на представлениях о
существовании молекул и атомов как
мельчайших частиц вещества. В основе
МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших
частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном
хаотическом движении, скорость которого
определяет температуру вещества.
3. Между частицами существуют силы
притяжения и отталкивания, характер
которых зависит от расстояния между
ними.
Основные положения МКТ подтверждаются
многими опытными фактами. Существование
молекул, атомов и ионов доказано
экспериментально, молекулы достаточно
изучены и даже сфотографированы с
помощью электронных микроскопов.
Способность газов неограниченно
расширяться и занимать весь предоставленный
им объем объясняется непрерывным
хаотическим движением молекул. Упругость
газов, твердых и жидких тел, способность
жидкостей смачивать некоторые твердые
тела, процессы окрашивания, склеивания,
сохранения формы твердыми телами и
многое другое говорят о существовании
сил притяжения и отталкивания между
молекулами. Явление диффузии — способность
молекул одного вещества проникать в
промежутки между молекулами другого —
тоже подтверждает основные положения
МКТ. Явлением диффузии объясняется,
например, распространение запахов,
смешивание разнородных жидкостей,
процесс растворения твердых тел в
жидкостях, сварка металлов путем их
расплавления или путем давления.
Подтверждением непрерывного хаотического
движения молекул является также и
броуновское движение — непрерывное
хаотическое движение микроскопических
частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется
хаотическим движением частиц жидкости,
которые сталкиваются с микроскопическими
частицами и приводят их в движение.
Опытным путем было доказано, что скорость
броуновских частиц зависит от температуры
жидкости. Теорию броуновского движения
разработал А. Эйнштейн. Законы движения
частиц носят статистический, вероятностный
характер. Известен только один способ
уменьшения интенсивности броуновского
движения — уменьшение температуры.
Существование броуновского движения
убедительно подтверждает движение
молекул.
Любое вещество состоит из частиц, поэтому
количество вещества v принято считать
пропорциональным числу частиц, т. е.
структурных элементов, содержащихся в
теле.
Единицей количества вещества является
моль. Моль — это количество вещества,
содержащее столько же структурных
элементов любого вещества, сколько
содержится атомов в 12 г углерода С12.
Отношение числа молекул вещества к
количеству вещества называют постоянной
Авогадро:
![]() Постоянная Авогадро показывает, сколько
атомов и молекул содержится в одном
моле вещества. Молярная масса — масса
одного моля вещества, равная отношению
массы вещества к количеству
вещества:
М = m/v.
Молярная масса выражается в кг/моль.
Зная молярную массу, можно вычислить
массу одной молекулы:
Постоянная Авогадро показывает, сколько
атомов и молекул содержится в одном
моле вещества. Молярная масса — масса
одного моля вещества, равная отношению
массы вещества к количеству
вещества:
М = m/v.
Молярная масса выражается в кг/моль.
Зная молярную массу, можно вычислить
массу одной молекулы:
![]() Средняя масса молекул обычно определяется
химическими методами, постоянная
Авогадро с высокой точностью определена
несколькими физическими методами. Массы
молекул и атомов со значительной степенью
точности определяются с помощью
масс-спектрографа.
Массы молекул очень малы. Например,
масса молекулы воды:
Средняя масса молекул обычно определяется
химическими методами, постоянная
Авогадро с высокой точностью определена
несколькими физическими методами. Массы
молекул и атомов со значительной степенью
точности определяются с помощью
масс-спектрографа.
Массы молекул очень малы. Например,
масса молекулы воды: ![]() Молярная масса связана с относительной
молекулярной массой Мг. Относительная
молекулярная масса — это величина,
равная отношению массы молекулы данного
вещества к 1/12 массы атома углерода С12.
Если известна химическая формула
вещества, то с помощью таблицы Менделеева
может быть определена его относительная
масса, которая, будучи выражена в
килограммах, показывает величину
молярной массы этого вещества.
Диаметром молекулы принято считать
минимальное расстояние, на которое им
позволяют сблизиться силы отталкивания.
Однако понятие размера молекулы является
условным. Средний размер молекул порядка
10^-10м.
Молярная масса связана с относительной
молекулярной массой Мг. Относительная
молекулярная масса — это величина,
равная отношению массы молекулы данного
вещества к 1/12 массы атома углерода С12.
Если известна химическая формула
вещества, то с помощью таблицы Менделеева
может быть определена его относительная
масса, которая, будучи выражена в
килограммах, показывает величину
молярной массы этого вещества.
Диаметром молекулы принято считать
минимальное расстояние, на которое им
позволяют сблизиться силы отталкивания.
Однако понятие размера молекулы является
условным. Средний размер молекул порядка
10^-10м.
43.
Основное
уравнение молекулярно-кинетической
теории![]() устанавливает
связь макроскопического параметра
(давления) с микроскопическими параметрами
(средней кинетической энергией и
концентрацией молекул). Средняя
кинетическая энергия молекул
устанавливает
связь макроскопического параметра
(давления) с микроскопическими параметрами
(средней кинетической энергией и
концентрацией молекул). Средняя
кинетическая энергия молекул![]() и
давление связаны соотношением
и
давление связаны соотношением ![]() .
Т.к.
.
Т.к. ![]() ,
еще одна форма записи основного уравнения
молекулярно-кинетической теории газов
имеет вид
,
еще одна форма записи основного уравнения
молекулярно-кинетической теории газов
имеет вид
![]() .
.
Здесь k
- постоянная Больцмана,
k=1,38·10−23 Дж/ºС. Множитель ![]() представляет
собой соотношение между джоулем (единицей
измерения энергии) и градусом (единицей
измерения температуры).
представляет
собой соотношение между джоулем (единицей
измерения энергии) и градусом (единицей
измерения температуры).
Основное уравнение молекулярно-кинетической теории газов теоретически обосновывает закон Дальтона: давление смеси газов равно сумме парциальных давлений. Парциальным давлением называется давление, которое оказывал бы газ, входящий в состав смеси, если бы он был единственным содержанием того же сосуда.
Любая
однородная термодинамическая система
в состоянии теплового равновесия
характеризуется уравнением
состояния,
связывающим давление объем и абсолютную
температуру системы p
= f(V,T).
Для идеального газа таким уравнением
является уравнение
Клапейрона - Менделеева![]() ,
полученное путем обобщение экспериментально
установленных законов Бойля - Мариотта,
Гей-Люссака и Шарля.
,
полученное путем обобщение экспериментально
установленных законов Бойля - Мариотта,
Гей-Люссака и Шарля.
Коэффициент R= 8,31 Дж/(моль·К) называется универсальной газовой постоянной.
Процессы, протекающие при неизменном значении одного из термодинамических параметров системы (давлении, температуре, объеме) называются изопроцессами. Изменение параметров системы для изопроцессов подчиняется законам
|
Бойля-Мариотта: |
(изотермический проц. T = const): |
|
|
Гей-Люссака: |
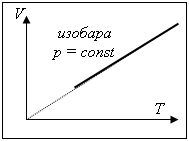
(изобарный процесс p = const): |
|
|
Шарля: |
(изохорный процесс V = const): |
|
Важно отметить, что в указанных изопроцессах масса идеального газа не меняется.

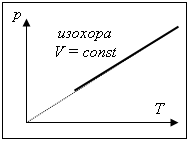
Законы Дальтона — два физических закона, определяющих суммарное давление и растворимость смеси газов. Сформулированы Джоном Дальтоном в начале XIX века[1].
Закон о суммарном давлении смеси газов
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
![]()
Закон о растворимости компонентов газовой смеси
При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
![]()
44. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекулможно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц и др.[1].
Конкретный вид этой формулы зависит от физических свойств рассматриваемой термодинамической системы.
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым уравнением Клапейрона-Менделеева:
|
|
(2.2) |
где: ![]() -
давление газа,
-
давление газа, ![]() -
занимаемый им объем,
-
занимаемый им объем, ![]() -
количество молей газа,
-
количество молей газа, ![]() -
универсальная газовая постоянная,
-
универсальная газовая постоянная, ![]() -
абсолютная температура. Уравнение (2.2) названо
в честь французского физика Бенуа
Поля Эмиля Клапейрона (1799
- 1864) и русского химика Дмитрия
Ивановича Менделеева (1834
- 1907).
-
абсолютная температура. Уравнение (2.2) названо
в честь французского физика Бенуа
Поля Эмиля Клапейрона (1799
- 1864) и русского химика Дмитрия
Ивановича Менделеева (1834
- 1907).
Встречаются процессы, когда какой-либо параметр газа остаетcя в процессе изменения его состояния постоянным. Эти процессы называются изопроцессами. Линии, изображающие на каком-либо из графиков зависимость параметров газа друг от друга: называются изотерма (T = const), изохорой (V = const), изобарой(p = const).
Для изопроцессов уравнение Менделеева–Клапейрона преобразуется следующим образом (предполагается, что масса газа и его состав неизменны):
1.
Если T =
const, то pV =
const (изотермический процесс) или 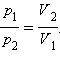
2.
Если V =
const, то (изохорический процесс) или: 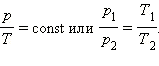
3.
Если p =
const, то (изобарический процесс) или: 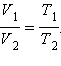
45. Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основаниикинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому континууму энергии.
Распределение Максвелла может быть получено при помощи статистической механики (см. происхождение статсуммы). Как распределение энергии, оно соответствует самому вероятному распределению энергии, в столкновительно-доминируемой системе, состоящей из большого количества невзаимодействующих частиц, в которой квантовые эффекты являются незначительными. Так как взаимодействие между молекулами в газе является обычно весьма небольшим, распределение Максвелла даёт довольно хорошее приближение ситуации, существующей в газе.
Во многих других случаях, однако, даже приблизительно не выполнено условие доминирования упругих соударений над всеми другими процессами. Это верно, например, в физике ионосферы и космической плазмы, где процессы рекомбинации и столкновительного возбуждения (то есть излучательные процессы) имеют большое значение, в особенности для электронов. Предположение о применимости распределения Максвелла дало бы в этом случае не только количественно неверные результаты, но даже предотвратило бы правильное понимание физики процессов на качественном уровне. Также, в том случае где квантовая де Бройлева длина волнычастиц газа не является малой по сравнению с расстоянием между частицами, будут наблюдаться отклонения от распределения Максвелла из-за квантовых эффектов.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
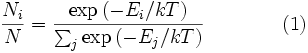 ,
,
где ![]() является
числом молекул имеющих энергию
является
числом молекул имеющих энергию ![]() при
температуре системы
при
температуре системы ![]() ,
, ![]() является
общим числом молекул в системе
и
является
общим числом молекул в системе
и ![]() — постоянная
Больцмана.
(Отметьте, что иногда вышеупомянутое
уравнение записывается с множителем
— постоянная
Больцмана.
(Отметьте, что иногда вышеупомянутое
уравнение записывается с множителем ![]() ,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы). Поскольку скорость
связана с энергией, уравнение (1) может
использоваться для получения связи
между температурой и скоростями молекул
в газе. Знаменатель в уравнении (1)
известен как каноническая статистическая
сумма.
,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы). Поскольку скорость
связана с энергией, уравнение (1) может
использоваться для получения связи
между температурой и скоростями молекул
в газе. Знаменатель в уравнении (1)
известен как каноническая статистическая
сумма.
Распределение по модулю скоростей
Обычно, более интересно распределение по абсолютному значению, а не по проекциям скоростей молекул. Модуль скорости, v определяется как:
![]()
поэтому
модуль скорости всегда будет больше
или равен нулю. Так как все ![]() распределены
нормально,
то
распределены
нормально,
то ![]() будет
иметь хи-квадрат
распределение с
тремя степенями свободы. Если
будет
иметь хи-квадрат
распределение с
тремя степенями свободы. Если ![]() — функция
плотности вероятности для
модуля скорости, то:
— функция
плотности вероятности для
модуля скорости, то:
![]() ,
,
где
![]()
таким образом, функция плотности вероятности для модуля скорости равна
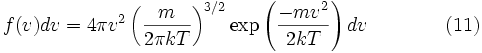
46. Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального
газа,
имеющего постоянную температуру ![]() и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения
и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения ![]() одинаково),
барометрическая формула имеет следующий
вид:
одинаково),
барометрическая формула имеет следующий
вид:
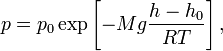
где ![]() —
давление газа в слое, расположенном на
высоте
—
давление газа в слое, расположенном на
высоте ![]() ,
, ![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
), ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — газовая
постоянная,
— газовая
постоянная, ![]() —абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул
—абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул ![]() (или
плотность газа) убывает с высотой по
тому же закону:
(или
плотность газа) убывает с высотой по
тому же закону:
где ![]() —
масса молекулы газа,
—
масса молекулы газа, ![]() — постоянная
Больцмана.
— постоянная
Больцмана.
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см.Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Барометрическая
формула показывает, что плотность газа
уменьшается с высотой по экспоненциальному
закону. Величина ![]() ,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной
,
определяющая быстроту спада плотности,
представляет собой отношение потенциальной
энергии частиц к их средней кинетической
энергии, пропорциональной ![]() .
Чем выше температура
.
Чем выше температура ![]() ,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести
,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести ![]() (при
неизменной температуре) приводит к
значительно большему уплотнению нижних
слоев и увеличению перепада (градиента)
плотности. Действующая на частицы сила
тяжести
(при
неизменной температуре) приводит к
значительно большему уплотнению нижних
слоев и увеличению перепада (градиента)
плотности. Действующая на частицы сила
тяжести ![]() может
изменяться за счёт двух величин:
ускорения
может
изменяться за счёт двух величин:
ускорения![]() и
массы частиц
и
массы частиц ![]() .
.
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
Барометрическая
формула лежит в основе барометрического
нивелирования —
метода определения разности высот ![]() между
двумя точками по измеряемому в этих
точках давлению (
между
двумя точками по измеряемому в этих
точках давлению (![]() и
и ![]() ).
Поскольку атмосферное давление зависит
от погоды, интервал времени между
измерениями должен быть возможно
меньшим, а пункты измерения располагаться
не слишком далеко друг от друга.
Барометрическая формула записывается
в этом случае в виде:
).
Поскольку атмосферное давление зависит
от погоды, интервал времени между
измерениями должен быть возможно
меньшим, а пункты измерения располагаться
не слишком далеко друг от друга.
Барометрическая формула записывается
в этом случае в виде: ![]() (в
м), где
(в
м), где ![]() —
средняя температура слоя воздуха между
точками измерения,
—
средняя температура слоя воздуха между
точками измерения, ![]() —
температурный коэффициент объёмного
расширения воздуха. Погрешность при
расчётах по этой формуле не превышает
0,1—0,5 % от измеряемой высоты. Более
точна формула Лапласа, учитывающая
влияние влажности воздуха и изменение
ускорения свободного падения.
—
температурный коэффициент объёмного
расширения воздуха. Погрешность при
расчётах по этой формуле не превышает
0,1—0,5 % от измеряемой высоты. Более
точна формула Лапласа, учитывающая
влияние влажности воздуха и изменение
ускорения свободного падения.
47.
Средняя
скорость теплового движения
молекул.Уравнение
(9.9) дает возможность найти средний
квадрат скорости движения молекулы.
Подставив в это уравнение ![]() получим
выражение для среднего квадрата скорости:
получим
выражение для среднего квадрата скорости:
![]()
Квадратный корень из этой величины называется средней квадратичной скоростью:
![]()
Вычисляя
по формуле (9.12) скорость молекул, например
азота при t=0°С,
получим ![]() .
Молекулы водорода при той же температуре
имеют среднюю скорость
.
Молекулы водорода при той же температуре
имеют среднюю скорость ![]() .
Когда впервые были получены эти числа
(вторая половина XIX в.), многие физики
были ошеломлены. Скорости молекул газа
по расчетам оказались больше, чем
скорости артиллерийских снарядов! На
этом основании высказывали даже сомнения
в справедливости кинетической теории.
Ведь известно, что запахи распространяются
довольно медленно: нужно время порядка
десятков секунд, чтобы запах духов,
пролитых в одном углу комнаты,
распространился до другого угла. Это
нетрудно объяснить. Из-за столкновения
молекул траектория каждой молекулы
представляет собой запутанную ломаную
линию (рис.9.4).
Большие скорости молекула имеет на
прямолинейных отрезках ломаной.
Перемещение же молекулы в каком-либо
направлении в среднем невелико даже за
время порядка нескольких минут. Вот и
получается, что при перемещении молекулы
из точки A в
точку B пройденный
ею путь оказывается гораздо больше
расстоянияAB.
.
Когда впервые были получены эти числа
(вторая половина XIX в.), многие физики
были ошеломлены. Скорости молекул газа
по расчетам оказались больше, чем
скорости артиллерийских снарядов! На
этом основании высказывали даже сомнения
в справедливости кинетической теории.
Ведь известно, что запахи распространяются
довольно медленно: нужно время порядка
десятков секунд, чтобы запах духов,
пролитых в одном углу комнаты,
распространился до другого угла. Это
нетрудно объяснить. Из-за столкновения
молекул траектория каждой молекулы
представляет собой запутанную ломаную
линию (рис.9.4).
Большие скорости молекула имеет на
прямолинейных отрезках ломаной.
Перемещение же молекулы в каком-либо
направлении в среднем невелико даже за
время порядка нескольких минут. Вот и
получается, что при перемещении молекулы
из точки A в
точку B пройденный
ею путь оказывается гораздо больше
расстоянияAB.
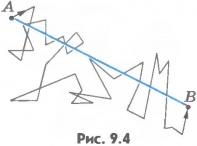
Экспериментальное определение скоростей молекул. Опыты по определению скоростей молекул доказали справедливость формулы (9.12). Один из опытов был предложен и осуществлен О. Штерном в 1920 г. Прибор Штерна состоит из двух коаксиальных цилиндров A и B, жестко связанных друг с другом (рис.9.5, а). Цилиндры могут вращаться с постоянной угловой скоростью. Вдоль оси малого цилиндра натянута тонкая платиновая проволочка C, покрытая слоем серебра. По проволочке пропускают электрический ток. В стенке этого цилиндра имеется узкая щель O. Воздух из цилиндров откачан. Цилиндр B находится при комнатной температуре.
Вначале
прибор неподвижен. При прохождении тока
по нити слой серебра испаряется и
внутренний цилиндр заполняется газом
из атомов серебра. Некоторые атомы
пролетают через щель O и,
достигнув внутренней поверхности
цилиндра B,
осаждаются на ней. В результате прямо
против щели образуется узкая
полоска D серебра
(рис.9.5,
б).
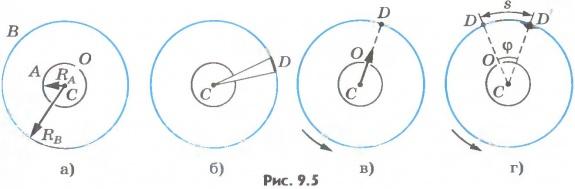
Затем цилиндры приводят во вращение с
большим числом оборотов n в
секунду (до 1500 1/c). Теперь за время t,
необходимое атому для прохождения пути,
равного разности радиусов цилиндров RB-RA,
цилиндры повернутся на некоторый угол ![]() .
В результате атомы, движущиеся с
постоянной скоростью, попадают на
внутреннюю поверхность большого цилиндра
не прямо против щели O (рис.9.5,
в),
а на некотором расстоянии s от
конца радиуса, проходящего через середину
щели (рис.9.5,
г):
ведь атомы движутся прямолинейно.
Если через
.
В результате атомы, движущиеся с
постоянной скоростью, попадают на
внутреннюю поверхность большого цилиндра
не прямо против щели O (рис.9.5,
в),
а на некотором расстоянии s от
конца радиуса, проходящего через середину
щели (рис.9.5,
г):
ведь атомы движутся прямолинейно.
Если через ![]() обозначить
модуль скорости вращения точек поверхности
внешнего цилиндра, то
обозначить
модуль скорости вращения точек поверхности
внешнего цилиндра, то
![]()
В
действительности не все атомы серебра
имеют одну и ту же скорость. Поэтому
расстояния s для
различных атомов будут несколько
отличаться. Под s следует
понимать расстояние между участками
на полосках ![]() с
наибольшей концентрацией атомов серебра.
Этому расстоянию будет соответствовать
средняя скорость атомов, которая равна:
с
наибольшей концентрацией атомов серебра.
Этому расстоянию будет соответствовать
средняя скорость атомов, которая равна:
![]()
Подставляя в эту формулу значение времени t из выражения (9.13), получим
![]()
Зная n, RA и RB и измеряя среднее смещение полоски серебра, вызванное вращением прибора, можно найти среднюю скорость атомов серебра. Модули скоростей, определенные из опыта, совпадают с теоретическим значением средней квадратичной скорости. Это служит экспериментальным доказательством справедливости формулы (9.12), а следовательно, и формулы (9.9), согласно которой средняя кинетическая энергия молекулы прямо пропорциональна абсолютной температуре. Средние скорости молекул превышают скорость звука и достигают сотен метров в секунду. Эти скорости удалось измерить благодаря тому, что макроскопическим телам (цилиндрам в опытах Штерна) можно сообщить столь большую скорость, что за время пролета молекул между цилиндрами они поворачиваются на заметный угол.
Длина
свободного пробега молекулы —
это среднее расстояние (обозначаемое ![]() ),
которое частица пролетает за время
свободного пробега от одного столкновения
до следующего.
),
которое частица пролетает за время
свободного пробега от одного столкновения
до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
