
Методичка №2 Как правильно делать
.PDF14.КОНТРОЛЬНАЯ РАБОТА
15.КРАТКАЯ ТЕОРИЯ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
1. Введение
Цель работы: необходимо ознакомиться с атомно-кристаллическим строением материалов и понятием кристаллической решётки и их видами; научиться определять координаты узлов, индексы кристаллографических направлений и атомных плоскостей.
2.Кристаллическое строение твёрдых тел |
|
Все вещества, находящиеся в твёрдом состоянии, могут быть либо |
|
|
АГНИ |
аморфными, либо кристаллическими. Аморфное состояние твёрдых тел |
|
характеризуется тем, что атомы, молекулы или ионы вещества располагаются в |
||||||||
пространстве хаотически. Аналогичную внутреннююкаструктуру имеют |
||||||||
|
|
|
|
|
|
|
|
е |
жидкости, но в них частицы вещества за счёт энергии теплового движения |
||||||||
|
|
|
|
|
|
|
т |
|
совершают частые перескоки с места на место, |
что является причиной |
|||||||
|
|
|
|
|
|
о |
|
|
текучести. Необходимо помнить, что в аморфных материалах более сильное |
||||||||
|
|
|
|
|
и |
|
|
|
взаимодействие удерживает частицы вещества вместе и при той же температуре |
||||||||
не позволяет им совершать частые |
|
л |
|
|
итоге образец остаётся |
|||
перескоки. В |
||||||||
|
|
|
б |
|
|
|
|
|
твёрдым и не течёт, хотя и имеет структуру жидкости. Аморфное состояние |
||||||||
|
|
и |
|
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
обычно отождествляют с переохлаждённой жидкостью, у которой бесконечно |
||||||||
|
ая |
|
|
|
|
|
|
|
высокая вязкость. Вязкость этой «твёрдой жидкости» с повышением |
||||||||
температуры плавно пониж ется, |
вещество размягчается и постепенно |
|||||||
нн |
|
|
|
|
|
|
|
|
переходит из твёрдого состояния в жидкое. Примером аморфного материала является обычное окон ое стекло, а также янтарь - окаменевшая смола древних
деревьев. |
ро |
|
|
В кристаллических твёрдых телах частицы вещества располагаются в |
|
пространстве упо ядоченно, т.е. выстроены правильными рядами, плоскостями, |
||||||
симметричнымит |
блоками, |
что |
придаёт |
отдельным |
кристаллам |
|
к |
|
|
|
|
|
|
(монокристаллам) характерную правильную огранку. Кристаллическое |
||||||
состояниее |
твёрдых тел встречается в природе чаще, чем аморфное, поскольку |
|||||
обладаетл |
меньшей |
свободной |
энергией и, в |
силу этого, является более |
||
Эстабильным. Многие аморфные тела с течением времени стремятся перейти в кристаллическое состояние. Примерами кристаллических материалов являются различные горные минералы (кварц, гранит, алмаз и т.д.), а также металлы и сплавы, которые в отличие от монокристаллов имеют поликристаллическое строение, т.е. состоят из множества микроскопических кристалликов неправильной формы (зёрен), случайным образом ориентированных в
11
пространстве.
Необходимо помнить, что одно и то же вещество может быть получено как в кристаллическом, так и в аморфном состоянии. Например: в металлах и сплавах при их сверхбыстром охлаждении из жидкого или газообразного состояний не успевает сформироваться упорядоченная кристаллическая структура. В результате образуется аморфное твёрдое тело (metal glass - металлическое стекло) и свойства аморфного металла могут заметно отличаться от свойств кристаллического образца. Это свидетельствует о важности внутренней атомной структуры материала в формировании его
свойств. |
|
|
|
|
|
|
|
|
|
|
АГНИ |
||
|
|
|
|
3.Тип и размеры кристаллических |
|||||||||
|
|
|
|
|
|
решёток металлов |
е |
||||||
|
Положительно заряжённые ионы и нейтральные атомы в процессе |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
т |
|
|
кристаллизации металла или сплава из расплавленного состоянияка |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
группируются в строго определённой последовательн с и, образуя |
|||||||||||||
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
кристаллические решётки. Кристаллические решётки характеризуются типом |
|||||||||||||
и размерами. |
|
|
|
|
|
л |
|
|
|
Для описания |
|||
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
упорядоченного расположения частиц вещества в кристаллах используют |
|||||||||||||
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
некую геометрическую модель, называемую кристаллической решёткой. |
|||||||||||||
|
|
|
|
|
|
б |
|
|
|
|
|
|
|
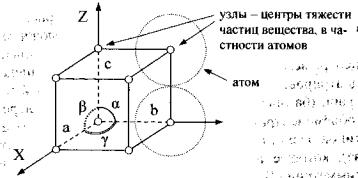
Кристаллическая решётка представляет собой воображаемую |
|
||||||||||||
пространственную координатную сетку, узлы которой отображают |
|||||||||||||
|
|
|
|
|
ая |
|
|
|
|
|
|
|
|
расположение в пространстве центров тяжести атомов, молекул или ионов |
|||||||||||||
кристалла. Поскольку ч стицы в кристаллах располагаются закономерно, нет |
|||||||||||||
|
|
|
|
нн |
|
|
|
|
|
|
|
|
|
необходимости изображать всю пространственную сетку, достаточно |
|||||||||||||
ограничиться изображе ием системы координат и минимальной группы |
|||||||||||||
|
|
|
ро |
|
|
|
|
|
|
|
|
|
|
повторяющихся в ней узлов. Такую минимальную группу узлов, периодически |
|||||||||||||
повторяющихся в пространстве, называют элементарной ячейкой. В общем |
|||||||||||||
случае элемен арная ячейка имеет вид параллелепипеда, частным случаем |
|||||||||||||
|
|
к |
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
куб (рис.1). |
|
|
|
|
|
|
|
|
||
которого являетсят |
|
|
|
|
|
|
|
|
|||||
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
|
|
|
|
|
|
|
|
12
Рис. 1. Простая кубическая элементарная ячейка.
Рёбра элементарного параллелепипеда (а, b, с) и его углы (α, β, γ) называют параметрами элементарной ячейки. Соотношения между этими параметрами определяют форму элементарной ячейки и соответствующую систему
симметрии. Всего существует 7 систем симметрии: |
|
|||
1) триклинная |
а≠ b ≠с , α≠β≠γ≠ 90°; |
АГНИ |
||
2) |
моноклинная |
а≠ b ≠с , α=β=90°, γ≠90°; |
||
|
||||
3) |
ромбическая |
а≠ b ≠с , α=β=γ=90° |
|
|
4) |
ромбоэдрическая а =b=с, α=β=γ≠90°; |
|
||
5) |
гексагональная |
а =b≠с, α=β=90°, γ=120°; |
|
|
6)тетрагональная v а =b≠с, α=β=γ=90°
7)кубическая а=b=с, α=β=γ=90°°.
Данную элементарную ячейку если перемещать (тр нслировать) вдоль |
|
координатных осей OX, OY и OZ с периодами, соотв тственно a, b и с, то |
|
ка |
|
можно воспроизвести всю пространственную крис аллическую решётку. |
|
е |
также периодами |
Параметры элементарной ячейки a, b и с называютт |
|
кристаллической решётки - это расстояния междуоцентрами тяжести соседних |
|
частиц, в частности атомов, сближенных в кр сталлах до соприкосновения. По |
|||
|
|
|
и |
порядку величины a, b и с составляют lÅ (Ангстрем, 1Å =10-10м или 0,1 нм). |
|||
|
|
л |
|
Элементарная ячейка, изображённая на рис. 1, относится к числу простых |
|||
|
б |
|
|
ячеек. Но возможны и сложные ячейки, содержащие дополнительные узлы, |
|||
и |
|
|
|
расположенные либо в центре всех граней элементарного параллелепипеда |
|||
б |
|
|
|
(гранецентрированная ячейка), либо в центре верхней и нижней грани |
|||
(базоцентрированная ячейкаая), либо в центре объёма (объёмоцентрированная ячейка). Всего насчитывается 14 типов элементарных ячеек (трансляционных
решёток Бра-вэ), которые неравномерно распределены по 7 системам |
||||||
симметрии. В частнннсти, триклинной системе симметрии принадлежит только |
||||||
|
|
т |
а кубическая система симметрии |
содержит |
||
одна примитивная ячейка, |
||||||
|
к |
|
|
|
|
|
примитивнуюро, объёмо-центрированную и гранецентрированную ячейки. |
||||||
е |
|
|
|
|
|
|
Н обходимо различать понятия кристаллическая решётка и структура |
||||||
л |
|
|
|
|
|
|
кристалла. |
|
|
|
|
||
Структура кристалла |
- |
это |
физическая реальность, |
конкретное |
||
Эрасположение в пространстве различных атомов. |
|
|||||
Кристаллическая решётка |
- |
это геометрический образ |
структуры, |
|||
отражающий лишь симметрию кристаллического пространства. Для более полного описания структуры кристаллов используют понятие базис. Базисом называют совокупность расположенных в пространстве различных атомов,
13
приходящихся на одну элементарную ячейку. т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. В этом случае, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Трансляцией базиса воспроизводится весь реальный кристалл. Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Такая же ситуация реализуется, в частности, в металлах. Если структуру металла описывает кристаллическая решётка с примитивной
ячейкой, то |
базис |
состоит |
только |
из |
одного |
атома |
этого |
металла. |
|||
|
|
|
|
|
|
|
|
|
ка |
|
|
Действительно, здесь каждый атом, расположенный в узле кристаллическойАГНИ |
|||||||||||
решетки находится |
на пересечении 8 |
аналогичных |
|
ячеек |
и принадлежит |
||||||
рассматриваемой ячейке только на |
|
|
|
т |
|
|
|
||||
5 часть, а поскольку таких узлов в ячейке 8, |
|||||||||||
то полностью |
ей |
принадлежит |
ровно |
о |
|
|
|
объёмно- |
|||
один атоме. В случае |
|||||||||||
|
|
|
|
|
|
и |
|
|
|
|
|
центрированной ячейки базис составляют 2 атома металла, а |
|||||||||||
гранецентрированной - 4. |
|
б |
|
|
|
|
|
|
|||
Сама система симметрии, величина периодов решётки и базис полностью |
|||||||||||
определяют кристаллическую |
|
и |
|
|
|
|
материала. Для более |
||||
структурулконкретного |
|
||||||||||
полного отражения плотности упаковки атомов иногда используют такие
параметры как координационное число и коэффициент компактности. |
||||
|
|
ая |
число ближайших равноудалённых |
|
Координационным числом называютб |
||||
соседей любого атома. |
|
|
|
|
|
нн |
|
|
|
Коэффициент комп ктности (степень компактности) представляет собой |
||||
отношение объёма, за ятого атомами, ко всему объёму элементарной ячейки. |
||||
|
ро |
|
|
|
|
4.Ат мно-кристаллическое строение металлов и сплавов. |
|||
т |
|
|
|
|
к |
|
|
|
элементы, характерными |
Ме аллами называются химические |
||||
призна ами которых являются непрозрачность, |
блеск, хорошая проводимость |
|||
тепла и электрического тока, а для многих металлов также ковкость и |
||
способностье |
свариваться. Металлы состоят из большого количества кристаллов |
|
Э |
|
|
илилзерен. Зерна состоят из отдельных блоков размерами |
||
|
1·10-5 |
… 1·10-3 см. Такое строение зерна носит название мозаичной |
структуры, а составляющие ее блоки называются блоками мозаики. Блоки объединяются в более крупные соединения, называемые фрагментами. Характерные свойства металлов определяются их электронным строением.
Металлы относятся к твердым кристаллическим телам, имеющим упорядоченное взаимное расположение атомов. Если через центры соседних атомов провести три взаимно-перпендикулярные прямые, то они пересекаясь,
14

образуют элементарную геометрическую фигуру, которую называют элементарной ячейкой или кристаллической решеткой (рис.2).
Наиболее часто металлы имеют кристаллические решетки следующих
типов:
кубическую объемно-центрированную (атомы в углах и в центре куба)
имеют натрий, хром, вольфрам, ванадий, железо и др. (а = 0,287÷0,889 нм = 2,87÷8,89 Å), а 1 Å = 10-8 см;
гранецентрированную (атомы по углам куба и в центре каждой грани) имеют алюминий, кальций, никель, медь, серебро (а = 3,6÷4,9 Å); гексагональную (атомы в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы) имеют магний, цинк, титан, бериллий и др. (а = 2,26…3,2 Å); (с = 3,59…5,6 Å).
|
Расположение атомов в кристаллической решетке и ее параметры а и с |
||||||||||
определяют методом рентгеноструктурного анализа с точностью до 3…5 знаков |
|||||||||||
после запятой. |
|
|
|
|
|
|
|
ка |
АГНИ |
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
Рист. 2. Элементарные крис- |
|
|
|
|
|
|
|
|
|
|
оталлллические решетки: |
||
|
|
|
|
|
|
|
|
и |
а – кубическая объемноцен- |
||
|
|
|
|
|
|
|
|
трированная; б – кубическая |
|||
|
|
|
|
|
|
|
л |
|
|||
|
|
|
|
|
|
|
|
гранецентрированная; |
|||
|
|
|
|
|
|
б |
|
|
|||
|
|
|
|
|
|
|
|
в – гексагональная плотно- |
|||
|
|
|
|
|
и |
|
|
|
|||
|
|
|
|
|
|
|
|
упакованная |
|
||
|
|
|
|
ая |
б |
|
|
|
|
|
|
|
|
|
нн |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ро |
|
|
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
Основные характеристики кристаллических решеток представлены в |
||||||||||
|
к |
|
|
|
|
|
|
|
|
|
|
табл. 1. |
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
Плотность различных кристаллических решеток разная и |
||||||||||
характеризуетсял |
координационным числом К, под которым понимают число |
||||||||||
атомов, находящихся на равном и наименьшем расстоянии от данного атома. |
|||||||||||
Э |
Координационное число для |
|
кубической объёмноцентрированной |
||||||||
|
|
||||||||||
решетки равно восьми (К8), коэффициент заполнения (отношение объема, занятого атомами, к объему всей ячейки) равен 68 %.
Для гранецентрированной и гексагональной кристаллических решеток координационное число равно двенадцати (К12), а коэффициент заполнения —
74 %.
15

Координационное число даёт представление о характере распределения сил взаимосвязи между атомами. Оно определяется по числу близлежащих атомов к любому атому кристаллической решётки. Кроме того, чем больше К, тем плотнее решётка. Следующей характеристикой решётки является базис, под которым понимается число атомов формально приходящиеся на одну кристаллическую решётку. На каждую элементарную ячейку ОЦК решётки приходится 1/8 × 8+1= 2 атома. Здесь 8 атомов ОЦК решётки располагаются по
вершинам куба, которые |
принадлежат одновременно восьми элементарным |
ячейкам, и один атом – |
АГНИ |
в центре куба, принадлежит только этой ячейке. |
Аналогично для ГЦК металлов: 1/8 ∙8 +1/2 ∙ 6 = 4, а для ГПУ металлов: 3+1/6
×12+2/2.= 6
|
|
|
|
|
|
|
|
|
|
Таблица 1. |
|
|
Типы кристаллических решеток важнейших металлических элементов |
||||||||||
|
Тип |
Координацио |
Коэффициент |
|
|
|
|
|
ка |
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
решетки |
нное число |
компактности |
|
|
|
т |
Металл |
|
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
ГЦК |
12 |
74 |
|
|
|
о |
|
|
|
|
|
|
|
Аg, Аu, Рt, Сu, А1, РЬ, Ni… |
|
|||||||
|
ОЦК |
8 |
68 |
|
|
и |
|
|
|
|
|
|
|
|
Nа, К, V, NЬ, Сг, Мо, W… |
|
|||||||
|
ГП |
12 |
74 |
|
л |
|
|
|
|
|
|
|
|
|
Ве, Мg, Zn, Cd, Re, Hf, Os… |
|
|||||||
|
|
|
|
б |
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
Атомы в кристаллических решетках в разных направлениях ее находятся |
||||||||||
на разных |
расстояниях |
б |
|
|
|
|
|
|
|
|
|
и, следовательно, в разных плоскостях атомы |
|||||||||||
расположены с различной плотностью. При таком расположении атомов
свойств — механических,аятепловых, электрических, магнитных, оптических от направления испытанния — н зывается анизотропией.
свойства в различных направлениях различны. Зависимость физических
Некоторые металлы (железо, олово, никель и др.) обладают способностью изменять внутре ее строение в твердом состоянии. Они имеют два и более типа кристаллических решеток при неодинаковых температурах. Существование одного и того же металла в различных кристаллических формах
называется аллотропией, а процесс перестройки атомов с одного типа |
|||||
|
|
ро |
|
|
|
кристаллическойт |
решетки в другой — аллотропическим, или полиморфным |
||||
пр вращкнием. Аллотропические формы обычно обозначают буквами α, β, γ, δ |
|||||
и т. д. (рис.3). |
|
|
|
||
|
е |
|
|
плавления |
железа 1539° С. При снижении с этой |
|
Температура |
||||
л |
|
|
|
|
|
Э |
|
|
|
|
|
температуры начинается кристаллизация жидкого железа, в результате которой железо Feα приобретает структуру объемно-центрированного куба.
При температуре 1392 °С кристаллы Feα переходят в Feγ с гранецентрированной решеткой. При температуре 911°С структура гранецентрированного куба переходит вновь в решетку объемно-центри- рованного куба Feα, которая сохраняется до комнатной температуры.
Температура 768 °С называется точкой Кюри: при этой температуре
16
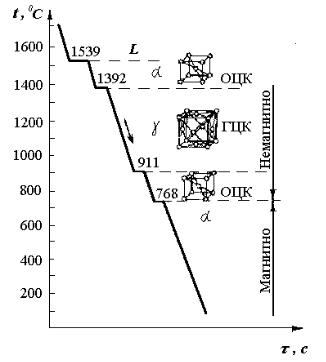
изменяются магнитные свойства железа. Различают две важнейшие модификации: α- и γ-железо; α-железо магнитно, γ-железо немагнитно; γ- железо обладает способностью хорошо растворять углерод (α-Fe растворяет углерода до 0,02 %, а γ-Fe — до 2,14 %). Полиморфизм железа имеет практическое значение при термической обработке стали и чугуна.
|
|
|
|
|
|
|
|
|
|
|
АГНИ |
|
|
|
|
|
|
|
Рис.3. График полиморфных |
||||||
|
|
|
|
|
|
превращений железа |
|
|||||
|
|
|
|
|
|
|
|
|
|
ка |
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
|
|
|
Кроме железа ферромагнитными свойствами, т. е. способностью |
||||||||||||
|
|
ая |
|
|
|
|
|
|
|
|
|
|
хорошо намагничиваться, обладают также кобальт и никель. |
|
|
||||||||||
Магнитное превр щение отличается от аллотропического некоторыми |
||||||||||||
|
|
нн |
|
|
|
|
сопровождается |
|
изменением |
|||
особенностями, в част ости оно не |
|
|||||||||||
кристаллической решетки. |
|
|
|
|
|
|
|
|
|
|
||
Атомы металл в, находящихся в твёрдом стоянии, связаны между собой |
||||||||||||
|
|
т |
|
|
|
|
|
|
|
|
|
|
специфической химической связью, называемой металлической. Такая связь |
||||||||||||
|
к |
|
|
|
|
|
|
|
|
|
|
|
осуществляе рося за счёт обобществления всех валентных электронов атомами |
||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
металла. При этом сами атомы становятся положительно заряженными ионами, |
||||||||||||
л |
|
|
|
|
|
|
в объёме металла |
«газ», или |
||||
а обобщ ствлённые ими электроны образуют |
||||||||||||
Эточнее «жидкость», относительно свободных электронов. Таким образом, на атомарном уровне металлы выглядят как совокупность положительно заряженных ионов, расположенных в узлах кристаллической решётки, которые «омываются электронной жидкостью». Наличием электронной жидкости (газа) объясняются такие характерные свойства металлов как высокая электро- и теплопроводность, а также металлический блеск. Кроме того, металлическая связь позволяет атомным слоям сравнительно легко скользить друг
17
относительно друга при пластическом деформировании, что обеспечивает металлам достаточно высокую пластичность.
В отличие от ковалентной связи металлическая связь не является строго направленной и допускает произвольное число взаимодействующих частиц. В результате атомы металлов, стремясь к состоянию с наименьшей энергией, наиболее компактным образом располагаются в пространстве. Таким плотным атомным упаковкам соответствуют следующие типы кристаллических структур: объёмоцентрированная кубическая структура (ОЦК-структура), гранецентрированная кубическая структура (ГЦК-структура), гексагональная плотноупакованная структура (ГПУ-структура). Именно эти структуры чаще
всего наблюдают у металлов. |
|
|
|
|
|
|
|
|
Встречаются у металлов и другие, менее плотные структуры, но гораздо |
||||||||
реже, чем три вышеназванные. |
|
|
|
|
|
|
ка |
АГНИ |
|
|
|
|
|
е |
|||
|
|
|
|
|
|
т |
|
|
5. Атомные плоскости и кристаллографические направления. |
||||||||
|
|
|
|
|
о |
|
|
|
В металловедении часто возникает |
|
и |
|
|
|
|||
потребн сть выделять то или иное |
||||||||
направление в кристалле, обозначать |
л |
|
иные атомные плоскости, |
|||||
те |
|
|
||||||
|
|
б |
|
|
|
|
|
|
отдельные атомы или узлы кристаллической решётки. При этом необходимо |
||||||||
|
и |
нат. В кристаллическом пространстве |
||||||
прежде всего, выбрать, систему коорд |
||||||||
|
б |
|
|
|
|
|
|
|
система координат органически связана с элементарной ячейкой: начало отсчёта |
||||||||
совмещено с одним из узлов кристаллической решётки, а координатные оси |
||||||||
ая |
|
|
|
|
При выборе системы координат |
|||
направлены вдоль рёбер элементарной ячейки. |
||||||||
каждому узлу (точке крист ллического пространства) может быть поставлен в |
||||||||
|
|
|
|
нн |
|
|
|
|
соответствие радиус-вектор г (рис.4), |
|
|||||||
|
|
|
|
ро |
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
к |
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
|
|
|
|
|
|
|
|
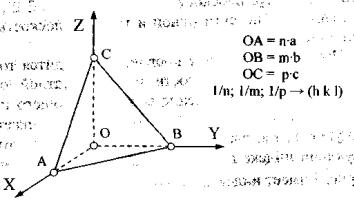
Рис.4.Системакоординатвкристалле |
|
||
|
|
|
|
→ |
→ |
→ |
→ |
(1) |
|
|
|
|
r |
= n a |
+ m b |
+ p c |
|
18
→ → →
где a , b , c - векторы элементарных трансляций, по модулю равные периодам решётки, а n, m, p – числа. Эти числа могут быть целыми, если рассматриваемый узел находится в вершинах элементарного параллелепипеда, или дробными, если узел (точка) расположены на его гранях или внутри объёма. Числа n, m, p называют
координатами (индексами) узла и помещают их в двойные квадратные скобки.
Если индекс получается отрицательным, то знак минус ставится над соответствующим
числом.
Например, узел №1 (на рис. 6) имеет координаты [[0 1 1]], №2 - [[1 ¯1 0]],
№3 - [[1 2 0]], а точка №4, расположенная в середине ребра элементарной ячейки, имеет координаты [[0 2 1/2]].
АГНИ
Любое |
направление |
может |
быть |
|
|
|
|
|
ка |
|
||
задано с помощью вектора или |
||||||||||||
совокупности двух точек, |
|
|
|
|
|
|
|
е |
|
|||
которые являются начальной и онечной точками |
||||||||||||
вектора. |
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
Например: если в качестве начальной точки век ора использовать начало |
||||||||||||
системы координат, |
|
|
|
|
|
и |
|
|
|
|
||
то для описания конкретн го направления в кристалле |
||||||||||||
будет достаточно |
одной |
точки, |
|
|
л |
|
|
|
|
|
||
всегда задающей в кристаллическом |
||||||||||||
|
|
|
|
|
б |
|
|
|
|
|
|
|
пространстве конкретный радиус-вектор (рис.5). Координаты этой точки (узла), |
||||||||||||
помещённые |
в |
|
и |
ско ки, |
|
называют |
индексами |
|||||
квадратные |
|
|
|
|||||||||
|
|
|
б |
|
Тогда если |
координаты |
получаются |
|||||
кристаллографического направлен я. |
||||||||||||
отрицательными, то знак минус ставится над соответствующим индексом. Но |
||||
|
|
ая |
|
|
если радиус-вектор указывает на точку, имеющую дробные координаты, то |
||||
дроби приводят к общему зн менателю, который затем отбрасывается. |
||||
Например: направле ие 1 на рис. 4 имеет индексы [1 |
1 1], а направление, |
|||
определяемое точкой №4, будет иметь индексы |
[0 |
2 1/2] →[0 4 1]. |
||
|
|
ро |
|
|
Координатная сь ОХннимеет индексы [1 0 0], OY-[0 1 0], OZ - [0 0 1]. |
||||
Параллельные векторы в кристаллическом |
пространстве являются |
|||
|
т |
|
|
|
к |
|
|
|
|
эквивален ными и задают фактически одно и тоже направление.Также являются |
||||
е |
|
|
|
|
физичес и э вивалентными все узлы кристаллической решётки. Поэтому, если |
||||
л |
|
|
|
|
вектор, задающий направление, исходит не из начала системы координат, его |
||||
можно параллельным переносом мысленно переместить в начало системы |
|
координат, либо начало отсчёта совместить с начальной точкой вектора. |
|
Э |
Например: на рис. 4, векторы 2 и 3 исходят не из начала системы |
координат. После их параллельного переноса в начало отсчёта не трудно установить, что направление 2 имеет индексы [1 1 0], а на правление 3 - [ 1 0 1].
19
6.Параметры индексов атомных плоскостей
Расположение атомной плоскости в кристалле определяется по длине отрезков ОА, ОВ и ОС, которые плоскость отсекает на координатных осях OX, OY и OZ (рис. 5).
|
|
|
|
|
|
|
|
|
ка |
АГНИ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
Рис. 5. Определение положения атомной плос ости. |
|
||||||||||
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
Длину отрезков ОА, ОВ и ОС указывают в единицах, кратных периодам |
|||||||||||
|
|
|
|
|
и |
|
|
|
|
|
|
кристаллической решётки: ОА = n·а, ОВ= m·b, ОС= р·с. Затем находят числа, |
|||||||||||
|
|
|
|
л |
|
|
|
|
|
|
|
обратные n, m, р и полученные дроби приводят к общему знаменателю, который |
|||||||||||
|
|
|
б |
|
|
|
|
|
|
|
|
затем отбрасывают. В результате получают три целых числа h, k, l, которые |
|||||||||||
называют индексами атомной |
и |
|
|
|
|
|
|
|
и |
||
плоскости или индексами Миллера |
|||||||||||
помещают в круглые скобки. |
б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ая |
|
изображенная на рис. 6, отсекает |
на |
||||||||
Например: если плоскость, |
|||||||||||
координатных осях отрезки ОА =1·а, ОВ — 2·b и ОС = 3·c, то её индексами
|
нн |
будут числа (6 3 2), которые определяются по схеме: 1; 2; 3 →1/1; 1/2; 1/3→6/6; |
|
3/6; 2/6→6 3 2. |
|
ро |
|
Так как все узлы кристаллической решётки эквивалентны и могут с |
|
равным правом выступать в роли центра координат, перемещение центра отсчёта или а омной плоскости на расстояние, кратное периодам решётки, не
приводит изменению индексов плоскости. Таким образом, все параллельные |
||
т |
|
|
атомныекплоскости в кристалле идентичны и имеют одинаковые индексы. Это |
||
находитесвоё |
отражение в том, |
что при вычислении индексов атомной |
п оскости общий множитель выносится за скобки и отбрасывается. |
||
л |
|
|
Например: плоскости типа (IТ Т), (2 2 2), (3 3 3) и т.д., являются по сути |
||
Э |
|
|
одной и той же плоскостью, имеющей индексы (1 1 I). |
||
Отсюда |
следует, чем ближе |
к началу координат находится точка |
пересечения атомной плоскости с координатной осью, тем больше численное значение соответствующего индекса, и наоборот. Если атомная плоскость не пересекает координатную ось, т.е. располагается параллельно ей, то соответ-
20
