
Фишбейн, термодинамика
.pdf
|
Дополнение. При комнатной температуре молекулы H2, N2, O2 являются |
|||||||||||||||||||||||||||
жесткими |
линейными |
с |
набором пост |
|
, |
|
вращ |
|
|
, |
колеб |
|
|
, |
|
|
|
|||||||||||
ких |
. При |
|
( |
|
|
|
= 3, |
|
= 0, |
|
= 0) = 3 + 0 + 0 = 3 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
«вымораживаются» вращательные сте- |
|||||||||||||||||
|
|
низких температурах у них = 3 |
|
= 2 |
|
|
|
|
= 0 = 3 + 2 + |
|||||||||||||||||||
пени свободы |
|
|
|
|
|
|
|
|
вращ = 2 |
|
|
|
, |
|
|
|
|
|
|
|
, |
а |
|
при высо- |
||||
0 = 5 |
Таким образом,( пост = 3, |
|
колеб = 1 |
|
= 3 + 2 + 2 = 7 |
|
||||||||||||||||||||||
|
|
|
пост |
|
|
вращ |
|
|
колеб |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
температурах наоборот«размораживаются» колебательные и молекулы |
|||||||||||||||||||||||||||
становятся упругими |
|
|
|
|
|
|
, |
|
|
|
|
), |
|
|
|
|
|
|
|
|
|
. |
||||||
|
|
|
|
|
i |
|
i |
|
|
|
|
|
i |
|
|
|
|
|
i |
|
|
|
|
|
|
|
||
U = N < e > |
N Av( |
= |
kT ) |
=vRT |
|
vU= M , DU |
|
= |
vRDT , UM |
= |
|
RT – |
|
внутренняя |
||||||||||||||
|
|
2 |
|
|||||||||||||||||||||||||
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
энергия моля. Здесь DU |
=U2 -U1 , DT =T2 -T1 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Теплоемкость |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Теплоемкость вещества |
– величина, численно равная количеству тепла, ко- |
|||||||||||||||||||||||||||
торое нужно сообщить веществу массой |
|
m в некотором процессе, |
чтобы по- |
|||||||||||||||||||||||||
|
= |
, |
= |
|
. |
высить его температуру на 1 градус кельвина [Дж/К]. |
|
||||
в ва |
|
|
|
в ва |
|
Удельная теплоемкость вещества – величина, равная количеству тепла, кото-
рое необходимо сообщить веществу единичной массы (кг) в некотором про-
цессе, чтобы повысить |
его |
температуруна |
|
1 градус |
кельвина |
[Дж/кг·К], |
|||||||
– масса вещества. |
= |
в |
ва |
, |
|
– |
= |
в |
ва |
= |
. |
|
(кг) |
|
|
|
|
|
|
|
|
|
|
|
|||
Удельная теплоемкость |
|
|
и |
|
теплоемкость веществаединичной |
|
|||||||
массы при изобарическом и изохорическом≈ . процессе соответственно. Для жидкости и твердого тела
Молярная теплоемкость вещества – величина, численно равная количеству тепла, которое нужно сообщить одному молю вещества в некотором про-
цессе, чтобы повысить его температуру на1 кельвин |
[Дж/моль·К], – количе- |
||||
ство молей вещества |
=V |
|
, |
= |
. |
|
|
|
|
|
|
|
|
в ва |
|
|
|
Молярная теплоемкость C |
– теплоемкость 1 моля вещества при изохориче- |
||||
ском процессе, i - число степеней свободы молекулы |
|
||||
CV = i R ( для идеального газа).
2
10

Молярная теплоемкость CP – теплоемкость 1 моля вещества при изобариче-
ском процессе
C |
= |
i + 2 |
R > C |
(для идеального газа). |
||||
|
||||||||
P |
2 |
V |
|
|
|
|
|
|
Связь CV и CP |
|
|
|
|
|
|
||
|
|
|
|
CP |
|
i + 2 |
|
|
CP = CV + R – уравнение Майера, g |
|
|
– коэффициент Пуассона. |
|||||
|
= |
|
= |
|||||
|
|
|
|
|
CV |
|
i |
|
II НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ |
||||||||
Энтропия S – функция состояния системы, т. е. одним и тем же пара-
метрам состояния p , T , V соответствует одна и та же S . |
|
Замкнутая (изолированная) система |
|
Для обратимых (равновесных) процессов изолированной системы |
|
2 1 |
2 |
ò |
|
dS = dQ /T = 0 , DS S=- S |
=dQ /T = 0, т. е. S =const. |
1
Для необратимых (неравновесных) процессов изолированной системы
2
dS > dQ /T , DS = S2 - S1 > òdQ / T и dS,DS >0.
1
Таким образом, энтропия замкнутой (изолированной) системы либо остается постоянной для обратимых процессов, либо возрастает для необратимых.
Незамкнутая (неизолированная) система
Для обратимых (равновесных) процессов неизолированной системы
2
dS = dQ /T , DS = S2 - S1= òdQ /T.
1
При поступлении тепла ( dQ >0) энтропия возрастает ( dS,DS >0), а при отдачи тепла ( dQ <0) – убывает ( dS,DS <0). Тогда
dQ= dU + dA ®TdS= dU + dA -неравентство Клаузиуса.
Для необратимых (неравновесных) процессов неизолированной системы
2
dS > dQ /T , DS = S2 - S1 > òdQ /T ,
1
dQ= dU + dA ®TdS > dU + dA -неравенство Клаузиуса.
Невозможны процессы, единственным результатом которых был бы переход тепла от менее нагретого тела к более нагретому.
Невозможны процессы, единственным конечным результатом которых было бы превращение тепла целиком в работу. (Невозможен тепловой двигатель с КПД равным 1).
11
РАБОТА ПРИ ИЗОПРОЦЕССАХ. ЦИКЛЫ
|
V2 |
|
|
p |
|
A < 0 |
|
Работа |
A = ò pdV |
– площадь под кривой |
p от V |
с |
|
|
|
|
|
|
|||||
|
V1 |
|
A > 0, если |
|
|
|
|
учетом |
знака. Если |
V2 >V1 (расширение), то |
|
|
|
||
|
|
|
|||||
V2 <V1 (сжатие), то A < 0. |
|
|
|
|
V |
||
|
|
|
|
|
V2 |
||
|
|
|
|
|
V1 |
||
Круговой процесс (цикл) – процесс, при котором начальное и конечное состояние системы (параметры p , T , V ) одинаково. Работа в цикле равна площади фигуры (в Дж), ограниченной замкнутой кривой «траектории» процесса в переменных p , V .
p |
|
4 |
|
|
p |
2 |
|
|||
|
|
|
3 |
|
|
|
3 |
|
||
1 |
|
|
2 |
|
|
1 |
|
4 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
5 |
|
|
|
6 |
V |
5 |
|
6 |
V |
|
V |
A |
V |
VA |
VB |
||||||
|
|
|||||||||
|
|
B |
|
A12341 = S51236 - S63415 > 0. |
||||||
A12341 = S51236 - S63415 < 0. |
||||||||||
Список основных формул
Q = DU + A– |
I начало термодинамики. |
|
|
|
|
|
|
|||||
pV = vRT – |
Уравнение состояния идеального газа. |
|
|
|
|
|||||||
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
A = ò pdV – |
Определение работы. |
|
|
|
|
|
|
|
||||
V1 |
|
|
|
|
Если расширение |
V > 0, то A > 0; если A > 0, то |
V > 0. |
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
Если сжатие |
V < 0, то A < 0; если A < 0, то |
V < 0. |
|||||
2 |
|
dQ |
|
|
|
|
|
|
|
|
|
|
DS = ò |
– |
Определение приращения энтропии. |
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
1 |
|
T |
Если получение тепла Q > 0, то |
S > 0; если |
S > 0, то Q > 0. |
|||||||
|
|
|
|
|
||||||||
|
i= |
|
|
Если отдача тепла |
Q < 0, то |
S < 0; если |
S < 0, то Q < 0. |
|||||
DU |
vRDT – |
Определение приращения |
внутренней энергии |
идеального |
||||||||
|
2 |
|
|
газа. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если нагревание |
T > 0, то |
U > 0; если |
U > 0, то |
T > 0. |
|||
|
|
|
|
|
Если остывание |
T < 0, то |
U < 0; если |
U < 0, то |
T < 0. |
|||
12
Обратимые |
изопроцессы идеального газа в неизолированной системе |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
Изобарный процесс ( p = const ) |
Изотермический процесс (T = const ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V = |
vR |
T , т. е. V |
|
|
const= ×T , |
|
|
|
|
p = vRT |
1 |
|
, т. е. p = |
const |
. |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
||||
DU |
|
|
|
i= |
vRDT , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DU = 0, |
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = vRT ln |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
A = pDV =vRDT, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
i + 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Q = A = vRT ln |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Q = DU + A |
|
|
= |
vRDT , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
dQ i + 2 |
|
|
|
dT i + 2 |
T |
2 |
|
dQ 1 |
|
2 |
|
|
|
Q |
|
A |
|
|
V |
|
||||||||||||||||||||||||||||||||||||||
DS |
|
|
|
|
|
|
|
|
|
|
|
|
= |
vR |
|
|
|
|
= |
vR ln |
2 |
. |
|
=DS = |
|
= |
|
|
|
|
|
|
|
|
|
|
dQ = |
|
= |
|
|
|
=vR ln |
|
2 |
. |
||||||||||||||
|
|
ò T |
|
|
|
|
ò T |
|
|
|
|
|
|
|
|
|
|
ò |
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
T |
ò |
|
|
T |
|
|
T |
|
|
|
|
T |
T |
|
|
|
V |
|
|||||||||||||||||||||||||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Изохорический процесс (V = const ) |
Адиабатический процесс ( dQ,Q = 0 ) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
p = |
vR |
T , т. е. |
|
=p |
|
|
const ×T , |
|
|
|
|
pV g = const , |
|
|
|
|
|
|
|
|
|
|
|
TV g-1 = const , |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
CP |
= |
i + 2 |
=> 1, |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
DU |
|
|
|
i= |
vRDT , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV |
i= |
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DU |
|
vRDT , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
p1V1 |
|
V1 |
|
|
|
|
||||||||
A = 0, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = -DU - |
=vRDT |
|
|
|
|
|
g-1 |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
[1 - ( |
|
) |
|
], |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q = 0, |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
g -1 |
|
|
|
|
|
|||||||||
Q = DU |
|
i= |
vRDT , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
dQ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
2 |
|
dQ |
2 |
dU i |
2 |
dT i |
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
DS ò |
|
|
|
|
T |
=ò |
|
T |
|
2 |
vR=ò |
T |
|
2 |
vR=ln |
T |
. |
DS= ò1 |
|
=T |
0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
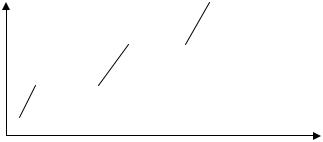
Изменение температуры и энтропии при обратимыхпроцессах нагревания
(остывания) и агрегатного (фазового) превращения вещества в неизоли-
рованной системе.
T |
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
4 |
5 |
|
1-2 |
кристалл |
нагревание (остывание) |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
2-3 |
кристалл + жидкость |
плавление (кристаллизация) |
|||||
2 |
3 |
|
|
|
|
3-4 |
жидкость |
нагревание (остывание) |
||||||
1 |
|
|
|
|
|
|
4-5 жидкость + газ |
кипение (конденсация) |
||||||
|
|
|
|
|
|
5-6газ |
нагревание (остывание) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
Q |
|
|
|
Для твердого тела и жидкости |
cP » cV . Для газа cP ¹ cV . |
|||||||||||||
|
|
Нагревание (остывание) фазы – dQ = cmdT. |
||||||||||||
|
|
|
Для твердого тела и жидкости c = cV . |
|||||||||||
|
|
|
|
|
2 dQ |
2 dT |
|
T |
||||||
|
|
|
|
|
DS ò |
|
|
= mcò |
|
= mc ln |
2 |
=. |
||
|
|
|
|
|
T |
|
T |
|
T |
|||||
|
|
|
|
|
1 |
|
|
1 |
|
|
1 |
|
||
Нагревание твердого тела (1 → 2), жидкости (3 → 4) и газа (5 → 6).
|
|
|
→ DS > 0, т. е. S растет. |
||||||||
Остывание газа |
(6 → 5), |
жидкости (4 → 3) и твердого тела (2 → 1). |
|||||||||
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
< |
→ DS < 0, т. е. S падает. |
||||||||
Агрегатный (фазовый) |
переход – T = const, Q= ±lm . |
||||||||||
|
|
2 |
dQ |
|
|
1 |
2 |
Q |
|
lm |
|
|
DS= =ò |
|
òdQ= = |
± |
. |
||||||
|
T |
T |
T |
|
|||||||
|
|
1 |
1 |
|
T |
||||||
Переход
твердое тело → жидкость (плавление, 2→3), жидкость → газ (кипение, 4→5)
Q = lm > 0 → DS > 0, т. е. S растет.
Переход
газ→жидкость (конденсация,5→4), жидкость→твердое тело (кристаллизация, 3→2)
Q = -lm < 0 → DS < 0, т. е. S падает.
Таким образом, в направлении 1 → 2 → 3 → 4 → 5→ 6 S растет, а в направлении 6 → 5 → 4 → 3 → 2→ 1 S падает.
14

|
|
|
Тепловой двигатель |
|
|
|
|
|||||||
Термический коэффициент |
полезного |
действия(кпд) любого цикличе- |
||||||||||||
ского ( DU = 0 ) процесса |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
T1 |
Q1 |
|
|
Раб. |
Q2 |
|
|
T2 |
|||||
|
Нагреватель |
|
|
|
|
|
Охладитель |
|
||||||
|
|
|
|
тело |
|
|
|
|
||||||
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
Q1 = Q2 + A или |
A = Q1 - Q2 |
||||||||||||
|
|
|
|
A |
|
|
Q - Q |
1 - |
Q |
2 |
. |
|
|
|
|
h |
= |
|
= |
|
=1 |
2 |
|
|
|
||||
|
|
|
||||||||||||
|
|
|
Q1 |
|
|
Q1 |
|
|
Q1 |
|||||
Q1 – количество тепла, полученное рабочим телом (газом) от нагревателя, Q2 – количество тепла, переданное рабочим телом(газом) охладителю (внешней среде), A – работа рабочего тела (газа), h– кпд теплового двигателя.
КПД цикла Карно (процесс с максимальным кпд)
|
A Q1 |
- Q2 |
T1 |
-T2 |
|
|
||
h |
|
= |
= |
. |
= |
|||
Q1 |
||||||||
|
|
Q1 |
|
T1 |
|
|
||
T1 – температура нагревателя, T2 – температура охладителя.
Процессы цикла Карно
|
|
2 |
dQ |
|
|
|
|
|
Q = DU + A, |
DS = ò |
. |
|
|
|
|
|
|
|
|
|
|||
1–2 |
изотермическое расширение: |
1 T |
|
|
> 0. |
||
|
|
|
|
A |
|||
|
DU = 0 (изотерма), |
A > 0(расширение), Q = A , DS = |
|||||
|
T |
||||||
2–3 |
адиабатическое расширение: |
|
|
|
|
||
|
Q = 0 (адиабата), A > 0(расширение), DU= |
-A, S = const . |
|||||
3–4 |
изотермическое сжатие: |
|
|
|
|
A |
< 0. |
|
адиабатическое сжатиеD: U = 0 (изотерма), A < 0(сжатие), Q = A , DS = |
||||||
4–1 |
T |
||||||
|
Q = 0 (адиабата), A < 0(сжатие), DU= |
-A, S = const . |
|||||
|
15 |
|
|
|
|
|
|
Тесты с решениями
Распределение Максвелла и Больцмана
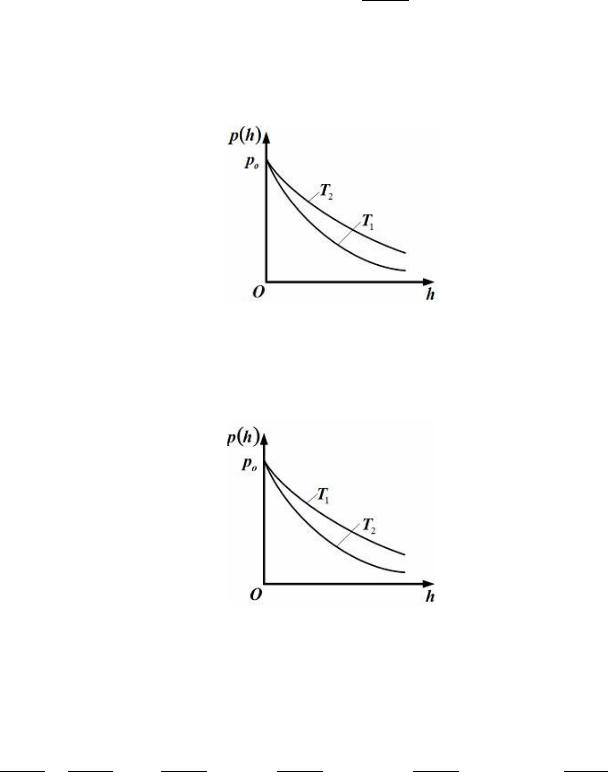
1. Зависимость давления от высоты для изотермической атмосферы описывается |
||||
барометрической формулой ( ) = |
exp − |
|
. |
|
Для этой зависимости справедливы следующие утверждения … |
||||
– зависимость |
давления |
одного |
и того же газа при двух разн |
|
температурах ( |
> ) представлена на рисунке |
|||
– зависимость |
определяется не только температурой газа, но и |
|
массой его молекул; |
|
|
– зависимость давления |
одного и того же газа при двух разных темпе- |
|
ратурах ( > |
) представлена на рисунке |
|
Решение |
|
|
= 0. |
|
|
|
|
|
|
стремится к давле- |
|||
– с понижением температуры давление газа на высоте |
|||||||||||||
нию на высоте |
|
|
|
|
|
|
|
> |
|
|
|||
|
Для одного и того же газа для любых кроме нуля при |
имеем |
|||||||||||
< |
|
, exp |
|
< exp |
|
, exp − |
|
> |
exp − |
|
, |
||
16

т. е. первое утверждение правильно. (Зависимость |
( ) |
|
для бо льших темпе- |
|||||||||||||||
ратур всегда идет выше). |
|
( ) |
|
|
|
|
|
|
|
́ |
|
|
||||||
|
Так как в выражение для |
входит |
, то второе утверждение пра- |
|||||||||||||||
вильно. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Так как правильно первое утверждение, то неправильно третье, противо- |
|||||||||||||||||
положное первому. |
|
|
|
→ exp(− ) = 1/ exp( |
) = |
1 |
|
|
|
|
||||||||
|
Если |
exp ,− |
|
= 0 |
|
|
||||||||||||
|
→ 0, то |
|
|
|
|
|
∞ |
|
|
∞ |
|
|
|
|
|
|
||
|
( ) → 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
, а не к |
|
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
|
||
|
что видно по рисунку. Четвертое утверждение неправильно. |
|||||||||||||||||
2. Формула |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||||
описывает распределение |
одинаковых молекул массой |
|
|
по высоте в изотер- |
||||||||||||||
|
( ) |
= |
exp − |
|
|
|
|
|
|
|
|
|
||||||
мической атмосфере; здесь |
– концентрация молекул при |
|
, |
– их кон- |
||||||||||||||
центрация на высоте |
|
|
|
|
|
|
|
|
|
|
|
|
|
следующие утвер- |
||||
|
. Для этой зависимости справедливы = 0 |
|
|
|||||||||||||||
ждения … |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
– приведенные на рисунке кривые соответствуют распределениям д |
|||||||||||||||||
|
одного и того же газа при разных температурах, причем |
> |
: |
|||||||||||||||
Решение 1 |
exp − |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
( ) |
|
|
|
|
|
|
|
|
|
|
|
||||||
Если газ один и тот же, т. е. |
одинаковы массы молекул, то имеем |
|
|
|||||||||||||||
|
( ) |
= |
exp − |
|
|
= |
|
|
exp |
|
|
( |
− |
) . |
/ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Так как имеет место пересечение, т. е. |
равенство |
|
|
|
, а |
|
|
, |
||||||||||
то второй сомножитель обязательно должен быть |
меньше1, т. е. |
|
и, |
|||||||||||||||
/ |
|
= 1 |
|
> |
> 1 |
|
||||||||||||
следовательно, первое утверждение правильно. |
|
|
|
|
|
|
|
|||||||||||
– приведенные на рисунке кривые соответствуют распределениям д
двух разных газов при одинаковой температуре, причем массы молекул |
||
удовлетворяют соотношению |
> |
: |
17

Решение 2 |
exp − |
|
|
|
|
|
|
|
|
|
|
|
|||
|
( ) |
|
|
|
|
|
|
|
|
|
|||||
Если температура одна и та же, то имеем |
|
|
|
|
|
|
|
||||||||
|
( ) |
= |
|
|
|
= |
|
exp |
|
( |
− |
) . |
|
|
|
|
exp − |
|
|
/ |
|
|
|||||||||
|
|
|
|
|
|
||||||||||
Так как имеет место пересечение, т. е. |
равенство |
|
|
|
, а |
|
, |
||||||||
то второй сомножитель обязательно должен быть |
меньше1, т. е. |
|
и, |
||||||||||||
|
/ |
= 1 |
|
> |
> 1 |
||||||||||
следовательно, второе утверждение правильно; |
|
|
|
|
|
|
|||||||||
– приведенные на рисунке кривые соответствуют распределениям для одно- |
||
го и того же газа при разных температурах, причем |
< |
: |
Решение 3 |
( ) |
|
exp |
− |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||||||||
Если газ один и тот же, т. е. одинаковы массы молекул, то имеем |
||||||||||||||||
|
( ) |
= |
|
|
|
|
|
= |
|
|
exp |
|
( |
|
− ) . |
|
− > 0 |
exp |
− |
|
|
|
|
||||||||||
|
|
|
|
|||||||||||||
|
|
> , |
|
( ))/( |
|
( ) |
растет с ростом |
. Следовательно, |
||||||||
Из рисунка следует, что |
|
|
|
|
|
|
|
|||||||||
|
, т. е. |
|
|
третье утверждение неправильно. |
||||||||||||
Примечание. Правильнее исследовать разность концентраций, а не их отношение.
18

– приведенные на рисунке кривые соответствуют распределениям для дву
разных газов при одинаковой температуре, причем массы молекул удовле- |
|
творяют соотношению |
< . |
Решение 4
Так правильно второе утверждение, то неправильно четвертое, противоположное второму.
3. На рисунке представлены графики функций распределения молекул идеаль-
ного газа во внешнем однородном поле силы тяжести от высоты |
|
для двух |
|||
разных газов, где |
, |
массы молекул газа (распределение |
Больцмана). |
||
|
|
|
|||
Для этих функций верными являются утверждения, что … |
|
|
|||||||
– масса |
) |
больше массы |
|
|
|
|
|||
– ( = |
|
|
|
|
|
|
|
||
– концентрация молекул газа с меньшей массой на «нулевом уровне» |
|||||||||
|
|
|
меньше |
|
|
|
|
|
|
масса |
|
|
меньше массы |
|
|
|
|
|
|
( = 0) |
|
|
|
|
|
|
|
|
|
– концентрация молекул газа с меньшей массой на «нулевом уровне» |
|||||||||
|
|
больше. |
|
|
|
|
|
||
Решение |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Зависимость |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
описывает распределение |
одинаковых молекул массой по высоте в изотер- |
||||||||
|
( ) = exp − |
|
|
= 0 |
|
||||
мической атмосфере; здесь |
– концентрация молекул при |
, – их кон- |
|||||||
центрация на высоте . |
|
|
|
|
|
||||
19
