
Фишбейн, термодинамика
.pdfФедеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения Кафедра «Физика и химия»
Л. А. Фишбейн
ПОДГОТОВКА К ИНТЕРНЕТ-ЭКЗАМЕНУ ПО ФИЗИКЕ В СФЕРЕ ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ Молекулярная (статистическая) физика и термодинамика
Екатеринбург Издательство УрГУПС
2012
Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения Кафедра «Физика и химия»
Л. А. Фишбейн
ПОДГОТОВКА К ИНТЕРНЕТ-ЭКЗАМЕНУ ПО ФИЗИКЕ В СФЕРЕ ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ Молекулярная (статистическая) физика и термодинамика
Сборник задач для студентов очной, заочной форм обучения
и дистанционного образования
Екатеринбург Издательство УрГУПС
2012
УДК 531
Ф 68
Фишбейн, Л. А.
Ф 68 Подготовка к Интернет-экзамену по физике в сфере профессионального образования. Молекулярная (статистическая) физика и термодинамика : сб. задач / Л. А. Фишбейн. – Екатеринбург : Изд-во УрГУПС, 2012.
– 53, [3] с.
Пособие предназначено для самостоятельной подготовки студентов очной, заочной форм обучения и дистанционного образования к Интернет-экзамену по молекулярной (статистической) физике и термодинамике в сфере профессионального образования.
Содержится теоретический материал и тестовые задания с решениями. Все тесты взяты с сайта www.i-exam.ru. Материал разбит на отдельные темы в соответствии с тематической структурой АПИМ (аттестационно-педагогические и измерительные материалы).
УДК 531
Печатается по решению редакционно-издательского совета университета.
Автор: Л. А. Фишбейн, доцент кафедры «Физика и химия», канд. физ.-мат. наук, УрГУПС
Рецензент: В. К. Першин, зав. кафедрой «Физика и химия», д-р физ.-мат. наук, УрГУПС
.
ãУральский государственный университет путей сообщений (УрГУПС), 2012
Оглавление
Требования ГОС к обязательному минимуму содержания основной об- |
|
разовательной программы …………………………………….……………. |
4 |
Тематическая структура АПИМ……………………………………………. |
4 |
Кодификатор ………………………………………………………………... |
4 |
Распределения Максвелла и Больцмана …………………………………... |
6 |
I начало термодинамики…………………………………….......................... |
7 |
Средняя энергия молекул…………………………………………………… |
8 |
II начало термодинамики. Энтропия……………………………………….. |
11 |
Работа при изопроцессах. Циклы………………………............................... |
12 |
Тесты с решениями………………………………………………………….. 16
3

Требования ГОС к обязательному минимуму содержания основной образовательной программы
|
Индекс |
|
Дисциплина и ее основные разделы |
Всего часов |
||||
|
ЕН.Ф |
Федеральный |
компонент |
|
|
|||
|
ЕН.Ф.03 |
Физика: |
|
|
|
|
400 |
|
|
|
|
статистическая физика и термодинамика: молекулярно- |
|
||||
|
|
|
кинетическая теория, свойства статистических ансамблей, |
|
||||
|
|
|
функции распределения частиц по скоростям и координа- |
|
||||
|
|
|
там, законы термодинамики, элементы термодинамики от- |
|
||||
|
|
|
крытых систем, свойства газов, жидкостей и кристаллов; |
|
||||
|
|
|
|
Тематическая структура АПИМ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
N |
|
Наименование |
|
за- |
Тема задания |
|
|
|
ДЕ |
дидактической единицы ГОС |
|
да- |
|
|||
|
|
|
|
|||||
|
|
|
|
|
|
ния |
|
|
|
|
|
|
|
|
7 |
Распределения Максвелла и Больцмана |
|
|
|
Молекулярная (статисти- |
|
8 |
Средняя энергия молекул |
|
||
|
|
|
|
Второе начало термодинамики. Энтропия. |
||||
|
2 |
ческая) физика |
и термо- |
|
9 |
|||
|
|
Циклы |
|
|||||
|
|
динамика |
|
|
|
|
|
|
|
|
|
|
10 |
I начало термодинамики. Работа при изо- |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
процессах |
|
КОДИФИКАТОР
Кодификатор элементов содержания дисциплины «Физика» цикла общих математических и естественнонаучных дисциплин
высшего профессионального образования
В кодификаторе зафиксирована преемственность между содержанием дисциплины «Физика» в государственных образовательных стандартах(ГОС) высшего профессионального образования (ВПО) и аттестационных педагогических измерительных материалах(АПИМ), используемых в рамках Интернетэкзамена в сфере профессионального образования. Кодификатор отражает содержание дисциплины в ГОС и содержит контролируемое содержание дисциплины, перечень контролируемых учебных элементов. Преемственность дидактических единиц, зафиксированных в кодификаторе, положена в основу содержания АПИМ единого Федерального банка заданий, используемого для проведения Интернет-экзамена в сфере профессионального образования.
Контролируемое содержание дисциплины включает код элемента со-
держания и наименование элемента содержания (темы задания). Первый разряд в записи кода элемента содержанияуказывает на номер группы заданий, связанный с объемом часов в ГОС, выделяемых на изучение дисциплины. В дисциплине «Физика» предложено выделить три группы (1 группа – от 100 до 279 часов, 2 группа – от 280 до 699 часов, 3 группа – от 700 до 1000 часов). Второй разряд в записи кода элемента содержания указывает на номер дидактической
4
единицы (раздела) дисциплины, а третий разряд в записи кода элемента со-
держания идентифицирует номер темы задания. Все коды элементов содержания и их наименование распределяются в предложенном порядке для каждой дидактической единицы.
Перечень контролируемых учебных элементов отражает требования к знаниям, которые студент должен приобрести в результате освоения дисциплины или отдельных ее разделов. При этом уровень сложности заданий должен быть БАЗОВЫМ, то есть, все предлагаемые задания должны контролировать обязательную подготовку студентов на уровне требований, задаваемом государственными образовательными стандартами.
Ниже приведен кодификатор для 2 группы заданий (от 280 до 699 часов).
Контролируемое |
|
|
содержание дисциплины |
Перечень контролируемых учебных элементов |
|
Код |
Элементы |
|
элемента |
содержания |
Студент должен… |
содержа- |
дисциплины |
|
ния |
(тема) |
|
2. МОЛЕКУЛЯРНАЯ (СТАТИСТИЧЕСКАЯ) ФИЗИКА И ТЕРМОДИНАМИКА
2.1.1Распределения знать: распределение молекул идеального газа по
|
Максвелла |
скоростям и компонентам скорости (распределения |
|||
|
и Больцмана |
Максвелла); характеристические скорости; зависи- |
|||
|
|
мость распределения Максвелла от температуры. |
|||
|
|
уметь: анализировать |
представленную |
информа- |
|
|
|
цию, делать выводы на основе данных, представ- |
|||
|
|
ленных графиком, диаграммой, рисунком, схемой |
|||
2.1.2 |
Средняя энер- |
знать: степени свободы молекул (поступательные, |
|
||
|
гия молекул |
вращательные, колебательные); число |
степеней |
||
|
|
свободы одно-, двух-, |
и многоатомных |
молекул; |
|
|
|
закон о равномерном распределении энергии по |
|||
|
|
степеням свободы; теплоемкость газов; |
|
|
|
|
|
уметь: вычислять среднюю кинетическую энергию |
|||
|
|
молекул, теплоемкости Cv и Cp и их отношения. |
|||
2.1.3.Второе начало знать: энтропия; характер изменения энтропии в термодинамиразличных процессах; цикл Карно в координатах
|
ки. Энтропия. |
(T,S). |
|
|
Циклы |
уметь: анализировать информацию, |
представлен- |
|
|
ную в виде графика |
|
2.1.4. |
I начало тер- |
знать: I начало термодинамики . |
Изопроцессы |
|
модинамики. |
(изотермический, изобарный, изохорный, адиабат- |
|
|
Работа |
приный). Работа при изопроцессах; |
|
|
изопроцессах |
уметь: анализировать информацию, |
представлен- |
|
|
ную в виде графика, диаграммы; вычислять работу |
|
|
|
в изопроцессах. |
|
5

|
|
|
|
|
|
РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА И БОЛЬЦМАНА |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
Распределение |
Больцмана |
|
|
(распределение |
|
частиц |
|
в |
силовом |
|
поле, |
||||||||||||||||||||||||||||||||||||||
в однородном поле силы тяжести) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
n(h) = n exp(- |
W |
) |
|
n= exp(- |
m0 gh |
) = n exp(- |
Mgh |
). |
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
kT |
|
|
|
0 |
|
|
|
|
|
|
|
|
kT |
|
0 |
|
|
|
|
|
RT |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
n – концентрация частиц, W – их потенциальная энергия (W = m0 gh ), |
n0 – кон- |
|||||||||||||||||||||||||||||||||||||||||||||||||||
центрация частиц в точках поля, где W = 0( h = 0), m0 – масса частицы, |
|
k – |
по- |
|||||||||||||||||||||||||||||||||||||||||||||||||
стоянная Больцмана, |
M = m0 N A - молярная масса, R = kN A – газовая постоянная. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Барометрическая формула (распределение |
давления |
|
в |
силовом поле, |
|||||||||||||||||||||||||||||||||||||||||||||
в однородном поле силы тяжести) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
p(h) = p exp(- |
W |
) |
|
p=exp(- |
m0 gh |
) =p exp(- |
Mgh |
). |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
kT |
|
|
|
0 |
|
|
|
|
|
|
|
|
kT |
|
|
|
0 |
|
|
|
|
RT |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
Распределение Максвелла (молекул по скоростям в газе, находящемся в |
|||||||||||||||||||||||||||||||||||||||||||||||||
равновесном состоянии) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Вероятность |
|
того, что скорость молекулы, заключена в интервале от |
|||||||||||||||||||||||||||||||||||||||||||||||
от додо |
+ |
+ или доля молекул |
dN |
, |
|
скорость |
которых заключена в интервале |
|||||||||||||||||||||||||||||||||||||||||||||
N |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
( |
) = |
|
∞ = |
( |
)∞ |
|
= |
4 |
( |
|
|
) |
|
⁄ exp |
|
|
|
|
|
|
|
|
, |
( |
) = |
|
= |
|
|
|
, |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
∫ |
|
|
= ∫ |
( |
)√ |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
от |
. |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
= 1 − |
площадь под кривой |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(до) |
|
|
|
|
|
|||||||||||||||||||
|
|
|
Здесь |
N – полное |
число молекул, |
|
|
|
|
– масса |
молекулы, |
– вероят- |
||||||||||||||||||||||||||||||||||||||||
ность того, что скорость молекулы заключена в интервале |
от |
|
|
|
|
в |
||||||||||||||||||||||||||||||||||||||||||||||
ростям ( |
|
|
|
( |
/ |
|
), |
( |
|
) |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скорости |
||||||||||||
расчете на единицу интервала |
|
|
скорости ( |
/ |
|
), или доля молекул, |
|
+ |
|
|
||||||||||||||||||||||||||||||||||||||||||
которых заключены в интервале от |
|
|
|
|
до |
|
в расчете на единицу интер- |
|||||||||||||||||||||||||||||||||||||||||||||
вала |
|
скорости |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
распределения молекул по ско- |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
функция + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
+ ( |
|
|
плотность вероятности). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
Число молекул |
|
, |
скорость |
|
|
которых |
|
заключена |
|
в интервале |
от |
|
до |
|||||||||||||||||||||||||||||||||||||
|
|
) = |
|
|
|
( |
) = |
( |
) |
|
|
|
|
|
|
= |
|
|
4 |
( |
|
|
|
|
|
) ⁄ |
|
exp |
|
|
|
|
|
|
|
|
|
= |
( |
) |
, |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
√ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Здесь |
|
|
|
|
( ) |
|
|
|
|
( |
|
( |
) = |
|
|
|
|
= |
|
|
|
|
|
( |
). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
= ∫ |
|
|
= |
∫ |
|
|
) |
|
|
|
= · 1 = − |
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|||||||||||||||||||||||||||
∫ |
∞ |
|
∞ |
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
+ |
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
площадь под кривой |
|
от |
|
|
|||||||||||||
до |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
/ |
) |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
– число молекул, скорости которых заключены в интервале от |
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
в расчете на единицу интервала скорости |
|
|
|
|
|
. |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
6
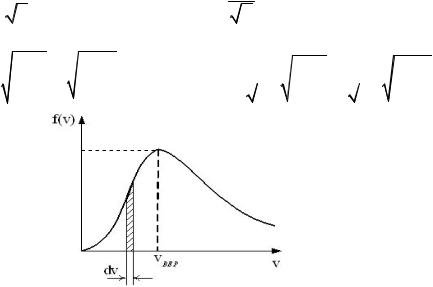
Свойства функции плотности вероятности ( )
|
4 |
|
|
m |
|
|
|
|
|
m u2 |
4 |
|
|
|
|
M |
|
|
|
|
|
|
M u2 |
||||||||||||||||
f (u) |
|
|
|
|
=( |
0 |
)3 / 2 exp(- |
0 |
|
)u2 |
|
|
|
|
=( |
|
|
|
|
)3 / 2 exp(- |
|
|
|
|
)u2 , |
||||||||||||||
|
|
|
|
2kT |
|
|
|
|
|
|
2RT |
|
|
|
|
||||||||||||||||||||||||
|
|
|
p |
|
|
|
|
|
2kT |
|
p |
|
|
|
|
|
|
|
|
2RT |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
2kT |
|
|
2RT |
|
|
|
|
|
4 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
. |
||||||||||||||
υВЕР = |
|
= |
|
|
|
, |
|
f ( υВЕР ) = |
|
|
|
|
|
m0 |
= |
|
M |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
m0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
pe 2kT |
|
pe 2RT |
||||||||||||||||||||
f ( υВЕР
)
Р
При росте T - максимум сместится вправо (значение υВЕР увеличится), а его высота (значение f ( υВЕР )) уменьшится и наоборот.
При росте M или m0 -максимум сместится влево (значение υВЕР
уменьшится), а его высота (значение f ( υВЕР )) увеличится и наоборот.
I НАЧАЛО ТЕРМОДИНАМИКИ
(закон сохранения энергии для тепловых явлений)
dQ= dU + dA, Q = DU + A.
dQ и Q – бесконечно малое и конечное количество тепла, подводимое к системе. dU и DU – бесконечно малое и конечное приращение внутренней энергии системы. dA и A – бесконечно малая и конечная работа, совершаемая системой против внешних сил, т. е. над внешними телами. Все переменные могут быть как положительными, так отрицательными и нулевыми.
U – внутренняя энергия системы [Дж]: сумма кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии. Система, находящаяся в одном и том же состоянии (набор p , T , V для идеального газа), имеет одну и ту же внутреннюю энергию U , т. е. U – функция состояния системы. Q – тепло [Дж],
A – работа [Дж].
7

Моль – количество вещества, в котором содержится 6, 022 ×1023 частиц. Идеальный газ – система не взаимодействующих друг с другом частиц. Параметры состояния системы – давление p , температура T , объем V и т. д. Равновесное состояние – все параметры системы имеют определенные значения, не меняющиеся при неизменных внешних условиях.
Равновесный (квазиравновесный) процесс – бесконечно медленный процесс, состоящий из последовательности равновесных состояний. Такой процесс – об-
ратимый. Неравновесный процесс – необратимый.
N A = 6, 022 ×1023 моль-1 – число Авогадро, k – |
постоянная Больцмана |
[Дж/K], |
R = kN A – газовая постоянная [Дж/К ×моль], |
m0 – масса молекулы [кг], |
N – чис- |
ло частиц вещества, m = m0 N – масса вещества [кг], M = m0 N A – молярная масса
[кг·моль-1], v = m = N – число молей вещества [моль].
M N A
Уравнение равновесного состояния идеального газа
(уравнение Менделеева-Клайперона)
|
|
|
|
|
|
pV = |
m |
RT = vRT , |
|
p = |
r |
RT , |
p = nkT, |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
m |
|
|
|
M |
|
|
N |
|
|
|
M |
|
|
|
|
||||
где |
r = |
– плотность, n = |
– концентрация частиц, |
T = t° + 273 - температура |
||||||||||||||||||
|
V |
|||||||||||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
в К, t° - температура в С. |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
СРЕДНЯЯ ЭНЕРГИЯ МОЛЕКУЛ |
|
|
||||||||||
|
|
Статистическое определение температуры |
|
= |
|
. |
||||||||||||||||
|
|
< |
> = |
2 |
< >= |
3 |
2 < >= |
3 |
3 |
|||||||||||||
|
|
|
|
|
ε |
пост |
|
|
|
|
|
|
|
|
|
|
|
|||||
< |
ε |
> , √< |
>, |
|
, |
|
|
− |
средняя кинетическая |
|
энергия |
поступательного |
||||||||||
|
пост |
|
|
|
|
|
|
|
|
|
||||||||||||
движения, среднеквадратичная скорость, масса и молярная молекулы. |
||||||||||||||||||||||
|
|
Внутренняя энергия идеального газа U (только кинетическая энергия) |
||||||||||||||||||||
|
|
|
|
|
|
= |
|
|
< ε >= |
< ε >пост+< ε >вращ+< ε >колеб . |
||||||||||||
|
|
Число |
|
степеней |
свободы i |
молекулы есть количество |
независимых |
|||||||||||||||
величин, с помощью которых можно задать ее положение в пространстве.
8
|
|
= пост + |
вращ + 2 |
колеб. |
|
|
|
|
|
|
|
|
|
|
|||||
Теорема о равнораспределении энергии: каждой степени свободы моле- |
|||||||||||||||||||
кулы соответствует один и тот же вклад в ее среднюю энергию, равный |
. |
. |
|||||||||||||||||
< ε >=< ε >пост+< ε >вращ+< ε >колеб = |
|
|
пост + |
|
вращ + 2 колеб = |
|
|||||||||||||
Тогда |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица |
|
|||||||
|
Молекула |
Связь пост |
|
вращ |
|
колеб |
|
|
|
C |
|
C |
P |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
||
|
Одноатомная |
|
3 |
|
|
0 |
|
0 |
|
3 |
|
2 |
2 |
|
|
|
|
|
|
|
Двухатомная |
жесткая |
3 |
|
|
2 |
|
0 |
|
5 |
|
|
|
|
|
|
|||
|
Трехатомная |
жесткая |
3 |
|
|
2 |
|
0 |
|
5 |
|
2 |
2 |
|
|
|
|
|
|
|
(линейная) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Двухатомная |
упругая |
3 |
|
|
2 |
|
1 |
|
7 |
|
2 |
2 |
|
|
|
|
|
|
|
Трехатомная |
упругая |
3 |
|
|
2 |
|
1 |
|
7 |
|
2 |
2 |
|
|
|
|
|
|
|
(линейная) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Трехатомная |
жесткая |
3 |
|
|
3 |
|
0 |
|
6 |
|
2 |
2 |
|
|
|
|
|
|
|
(нелинейная) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Трехатомная |
упругая |
3 |
|
|
3 |
|
1 |
|
8 |
|
2 |
|
2 |
|
|
|
|
|
|
(нелинейная) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CV |
– |
теплоемкость 1 моля вещества при изохорическом процессе, |
CP – тепло- |
||||||||||||
|
|
|
|
|
|
|
2 |
|
2 |
|
|
||||
емкость 1 моля вещества при изобарическом процессе. |
|
|
|
|
|
|
|
||||||||
|
|
|
|
= 3, |
Выводы из таблицы, примеры и дополнение |
|
|
|
|
||||||
|
|
У |
|
≥ 3. |
|
|
|
|
|
пост |
|
|
|||
т. е. |
|
У всех молекул есть как минимумтри поступательные степени свободы, |
|||||||||||||
|
пост |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
одноатомных – только три поступательные, т. е. |
трех |
|
и |
более атомных |
||||||||
|
|
У линейных (всех |
двух атомных и некоторых |
|
|||||||||||
|
|
= |
|
|
|
= 3. |
|||||||||
(HCN, CO2)) – есть две вращательные степени свободы, т. е. |
|
|
вращ |
|
|||||||||||
|
|
У нелинейных (трех и более атомных) есть три |
вращательные степени |
||||||||||||
|
|
|
|
|
|
|
|
= 2. |
|||||||
Примеры |
|
|
|
|
|
|
|
|
|
|
= 0. = 1. |
||||
свободы, т. е. |
вращ |
|
|
|
|
|
|
|
|
|
|||||
|
|
У жестких – |
нет колебательных степеней свободы, т. е. |
|
|
колеб |
|
||||||||
|
|
|
= 3. |
|
|
|
|
|
|
||||||
|
|
У упругих – есть одна колебательная степень свободы, |
т. е. |
|
колеб |
||||||||||
|
|
= 3 + 2 = 5; |
|
2 |
|
|
|
|
|
|
|
|
|||
|
|
гелий He, атомарный водород H – одноатомные молекулы, |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
линейные) молеку- |
|||||
лы, |
|
водород H2, азот N2, кислород O2 – жесткие двухатомные ( |
|
|
= 3; |
||||||||||
= 3 + 3 = 6. |
пар H O |
– жесткая трехатомная (нелинейная) |
|
молекула, |
|||||||||||
|
|
водяной |
|
||||||||||||
9
