
Стадии облитерирующего атеросклероза
Исходя из дистанции безболевой ходьбы, выделяют 4 стадии облитерирующего атеросклероза артерий нижних конечностей.
1 стадия. Боли появляются при тяжелой физической нагрузке. Дистанция безболевой ходьбы более 1000 м.
2а стадия. Дистанция безболевой ходьбы 250-1000 м.
2б стадия. Дистанция безболевой ходьбы 50-250 м.
3 стадия (критическая ишемия). Дистанция безболевой ходьбы менее 50 м. На этой стадии появляются боли в мышцах нижних конечностей в покое, преимущественно по ночам. Больные, как правило, опускают ногу с кровати для улучшения кровонаполнения тканей. Часто это действительно приводит к ослаблению болей.
4 стадия. На этой стадии появляются трофические расстройства. Как правило, участки почернения кожи (некрозы) появляются на пальцах или пяточных областях. В дальнейшем это может привести к гангрене.
Диагностика заболевания вызывает затруднения только в начальных стадиях, когда не удается распознать характерных болей по типу перемежающейся хромоты. При подозрении на данное заболевание врач обязан определить интенсивность пульсации на артериях нижних конечностей. Для облитерирующего атеросклероза артерий нижних конечностей характерно ослабление или отсутствие пульсации артерий ниже места расположения атеросклеротической бляшки, вызывающей стеноз, который изменяет гемодинамику. При выявлении дефицита пульсации на артериях нижних конечностей врач должен обследовать и другие артерии, в частности аорту, артерии верхних конечностей, сонные артерии, так как атеросклероз является системным заболеванием, и при продолжении обследования высока вероятность выявления дефицита пульсации или систолических шумов при аускультации других отделов сердечно-сосудистой системы.
Следует отметить, что заболевание часто носит несимметричный характер, то есть на одной конечности изменения более выражены, чем на другой. Однако также на начальных стадиях заболевания возможно сохранение четкой пульсации артерий нижних конечностей на всех уровнях. Тогда расставить все точки над «и» поможет только ультразвуковая допплерография (УЗДГ) или дуплексное сканирование (ДС) артерий нижних конечностей.
Синдром Лериша — совокупность клинических проявлений, обусловленных хронической окклюзией в области бифуркации брюшной части аорты и подвздошных артерий. Наиболее часто встречается у мужчин в возрасте 40—60 лет.
При синдроме Лериша, обусловленном атеросклерозом, максимальные изменения наблюдаются в области бифуркации аорты и в месте отхождения внутренней подвздошной артерии. Часто имеется выраженный кальциноз стенки аорты и артерии, во многих случаях — пристеночный тромбоз
Первым симптомом синдрома Лериша обычно являются боли, которые возникают в икроножных мышцах при ходьбе. При средних и высоких окклюзиях аорты боли локализуются в ягодичных мышцах, в пояснице и по заднелатеральной поверхности бедер (высокая перемежающаяся хромота). Кроме того, больные отмечают похолодание, онемение нижних конечностей, выпадение на них волос и медленный рост ногтей. Иногда наблюдается и атрофия нижних конечностей. У 20—50% больных мужчин наступает импотенция. Течение прогрессирующее. У больных до 50 лет синдром Лериша развивается более быстрыми темпами, чем у больных старше 60 лет.
Диагноз синдрома Лериша в большинстве случаев устанавливают на основании осмотра, пальпации и аускультации, а также результатов инструментальных методов исследования. Отмечаются изменение окраски кожи нижних конечностей, гипотрофия мышц, снижение кожной температуры. При IV степени ишемии появляются язвы и очаги некроза в области пальцев и стоп. При пальпации отсутствует пульсация бедренной артерии. В случаях окклюзии брюшной части аорты не определяется ее пульсация на уровне пупка. При аускультации выслушивается систолический шум над бедренной артерией в паховом сгибе, по ходу подвздошной артерии с одной или с обеих сторон и над брюшной частью аорты. Отсутствие пульсации артерий конечности и систолический шум над сосудами являются основными признаками синдрома Лериша на нижних конечностях АД аускультативно не определяется
. Ультразвуковая допплерография позволяет оценить характер кровотока по бедренным и подколенным артериям. Важным показателем является лодыжечный индекс (отношение АД на стопе к АД на лучевой артерии), который в норме равен 1,1—1,2. При индексе менее 0,8 появляются признаки перемежающейся хромоты, а менее 0,3 — язвенно-некротические изменения.
Топическую картину поражения можно установить с помощью ангиографии радионуклидной, дигитальной субтракционной и рентгеноконтрастной ангиографии. Из методов рентгеноконтрастного исследования предпочтение отдают транслюмбальной пункционной аортографии, при которой можно получить изображение не только аорты, но и дистального сосудистого русла конечностей. С помощью аортографии выявляют локализацию и протяженность поражения.
Лечение больных с облитерирующим атеросклерозом артерий нижних конечностей заключатеся в следующем:
Коррекция артериальной гипертензии, дислипидемии, гипергликемии у больных сахарным диабетом и пр. Следует подчеркнуть безусловную необходимость прекращения курения.
У больных с ишемией нижних конечностей нежелательно применять бета-адреноблокаторы, так как они ухудшают периферическое кровоснабжение.
При наличии у больных с перемежающейся хромотой АГ артериальное давление надо снижать постепенно (чтобы не вызвать ухудшения перфузии нижних конечностей) и стараться поддерживать его на уровне, который не вызывает нарастания ишемии, т. е. появления болей и понижения толерантности к физической нагрузке.
Первостепенное значение придается физической активности. Больные с перемежающейся хромотой должны ежедневно ходить в продолжение 30—45 мин — это способствует развитию коллатералей, приводит к нарастанию мышечной силы и увеличению пройденного без боли расстояния. При появлении боли и сжатия в мышцах ноги пациент долхсен остановиться, а после исчезновения этих ощущений — продолжить ходьбу. Нередко езда на велосипеде или плавание переносятся значительно лучше, чем ходьба (однако не заменяют ее).
Улучшение микроциркуляции и гемореологии. С этой целью назначают пентоксифиллин по 300 мг 3 раза в день и аспирин по 0,1 г/сут на длительное время.
Реваскуляризация нижних конечностей может осуществляться с помощью эндоваскулярных методов (баллонная ангиопластика со стентированием сосудов, эндартерэктомия, лазерная ангиопластика) и хирургическим путем — аорто-бедренное, бедренно-подколенное и другие виды шунтирования. Вопрос о реваскуляризации встает, когда перемежающаяся хромота нарастает и препятствует повседневной физической активности и/или выполнению работы. Выбор того или иного метода реваскуляризации проводится специалистом по эндоваскулярным методам лечения совместно с сосудистым хирургом. Эндоваскулярные методы получили достаточно большое распространение и весьма эффективны. Однако поражение сосуда на большом протяжении обычно требует шунтирования. При наличии болей в покое, трофических язв, сахарном диабете, когда велик риск потери ноги, также проводится хирургическое лечение.
Поясничная симпатэктомия
Она выполняется как дополнение к операции шунтирования или для ускорения заживления язв, когда другие виды вмешательств невозможны.
Прогноз при облитерирующем атеросклерозе артерий нижних конечностей определяется не только степенью окклюзии сосудов конечностей, но и наличием других клинических проявлений атеросклероза — ИБС и/или церебрального атеросклероза. У больных с сахарным диабетом прогноз значительно хуже.
Облитерирующий эндартериит периферических артерий. Клиническая картина по стадиям. Диагностика. Дифференциальный диагноз. Лечение. Консервативное лечение. Показания к оперативному лечению Виды операций. Показания к ампутациям. Болезнь Бюргера (облитерирующий тромбангиит).
Облитерирующий эндартериит – это заболевание, поражающее сосуды преимущественно нижних конечностей, приводящее к прогрессирующему нарушению кровообращения, заканчивающееся нередко гангреной. Заболевание это поражает в большей степени мужчин среднего и молодого возраста. Основным специфическим симптомом, позволяющим заподозрить и выявить облитерирующий эндартериит, является перемежающаяся хромота: сильная боль в икроножных мышцах, вынуждающая больного замедлять шаг и останавливаться через определённые промежутки пути. После небольшого отдыха боль исчезает и больной двигается дальше. Появление этого симптома связано с недостаточным поступлением кислорода и питательных веществ к мышцам ног, вследствие поражения сосудов.
Выделяют 5 фаз заболевания, последовательно сменяющие одна другую:
Пациент способен пройти 1 и более км до появления боли в ногах;
Боль возникает при движении на расстояние около 200м;
Боль возникает при ходьбе на расстояние 25 м, появляются боли в покое.
Наряду с болью появляются язвенно-некротические изменения на кожных покровах конечности.
Гангрена.
Помимо перемежающейся хромоты больные жалуются на тяжесть в ногах, быструю утомляемость, ощущение ползания мурашек, потливость. Внешне заболевание проявляется бледностью и похолоданием поражённого участка конечности, на начальных этапах, и появлением незаживающих трофических язв в запущенных случаях. Ослабляется или вовсе пропадает пульсация на магистральных артериях нижней конечности.
Болезнь иногда прогрессирует медленно, обострения сменяются ремиссиями, что позволяет больному длительное время не обращаться к врачу. Но нередко болезнь стремительно развивается, быстро приводя к необратимым изменениям в сосудах и тканях конечности. Поэтому, при первых признаках нарушения кровообращения в ногах следует немедленно обратиться за медицинской помощью.
Реовазография — регистрация пульсовых колебаний стенок сосудов, позволяет оценить состояние кровотока на поражённом участке.
Капиллярография — микрофотографирование капилляров, которое даёт возможность определить состояние микроциркуляторного русла.
Ультразвуковая допплерография — исследование скорости кровотока с помощью ультразвуковых импульсов.
Артериальная ангиография – исследование кровеносных сосудов с использованием рентгенконтрастных веществ.
На ранних стадиях заболевания лечение преимущественно консервативное. Приём лекарственных препаратов, физиотерапевтические процедуры призваны снять спазм сосудистой стенки, предотвратить тромбообразование в просвете сосуда, улучшить микроциркуляцию. Для этой цели применяются несколько групп препаратов:
Спазмолитики
Антиагреганты
Витамины (В, Е, С, РР)
Антигистаминные препараты
Из физиотерапевтических процедур хороший терапевтический эффект на ранних стадиях оказывают диадинамические токи, диатермия, баротерапия. При позднем выявлении заболевания, а также при неэффективности медикаментозного лечения прибегают к хирургической операции.
Если поражён небольшой участок артерии (до 15 см), то его удаляют. Если же патологический процесс затронул участок больше 15 см, то прибегают к шунтированию или протезированию артерии. Наиболее частой операцией при облитерирующем эндартериите является аортобедренное шунтирование: от брюшной части аорты к бедренной артерии в обход поражённого участка вшивается искусственный сосуд.
Хороший эффект даёт операция симпатэктомии: пересечение симпатических нервных стволов, приводящее к купированию сосудистого спазма. При развитии гангрены прибегают к ампутации поражённого сегмента или всей конечности.
Облитерирующий тромбангиит (болезнь Бюргера) — системное иммунопатологическое воспалительное заболевание артерий и вен, преимущественно мелкого и среднего диаметра, с вторичными элементами аутоиммунной агрессии.
В зависимости от того в каком участке артериального русла происходит затруднение кровотока, выделяют 3 типа:
Дистальный тип (60-65% от общего числа), характеризуется облитерацией артерий малого диаметра (стопа, голень, кисти, предплечье).
Проксимальный тип (15-20%), поражение артерий среднего и крупного диаметра (бедренная, подвздошная, аорта).
Смешанный тип (15-20%), сочетание двух первых типов поражения.
Заболевание развивается в основном у молодых мужчин (редко у женщин) в возрасте до сорока лет, хотя может встречаться и в более позднем возрасте, а также у подростков. Всегда наблюдается поражение двух нижних и/или двух верхних конечностей — начиная с дистальных отделов с распространением проксимально. Весьма характерна триада: перемежающаяся хромота, синдром Рейно и мигрирующий поверхностный тромбофлебит в дистальных частях конечностей. Перемежающаяся хромота проявляется болями при ходьбе в подъеме стопы и нижней части икроножных мышц; в случае поражения верхних конечностей при работе руками возникают боли в мышцах кисти и предплечья («перемежающаяся хромота» верхних конечностей).
Наблюдается повышенная чувствительность кистей и стоп к холоду, резкое побледнение пальцев стоп и кистей при охлаждении; пальцы могут быть цианотичными, появляются болезненные узелки и кровоизлияния на подушечках пальцев. Не все пальцы поражаются в одинаковой степени, что связано с неравномерностью поражения артериального русла. Могут быть бледными и холодными не только пальцы, но и стопы и кисти. При тяжелой ишемии появляются боли в дистальных отделах конечностей в покое, трофические поражения ногтей, болезненные изъязвления и даже гангрена кончиков пальцев; возможна самопроизвольная ампутация некротизированных участков. Тяжелые поражения пальцев могут провоцироваться травмой.
Часто определяется отсутствие пульса (или значительное снижение пульсации) на артериях ног — a. dorsalis pedis,a. tibialis posterior и на артериях рук — a. radialis, a. ulnaris, при этом пульс на плечевых и подколенных артериях нормальный.
У больных нередко наблюдаются вторичные инфекции кожи и подкожной клетчатки в дистальных отделах конечностей. Болезнь довольно быстро прогрессирует и характеризуется частыми обострениями, которые нередко провоцируются воздействием холода или интенсивным курением. Боли в покое, язвы и гангрена могут появляться в срок от нескольких месяцев до нескольких лет — считая от первых проявлений заболевания.
Лечение облитерирующего тромбангиита в первую очередь состоит в отказе от курения. Так же, как и при атеросклерозе артерий нижних конечностей, рекомендуют дозированную ходьбу с целью развития коллатералей, прием трентала по 300 мг 3 раза в день, аспирина по 0,1 г/сут. Имеются сообщения о благоприятном эффекте антагонистов кальция.
Симпатэктомия в ряде случаев позволяет уменьшить боли и другие проявления вазоспазма. Реваскуляризация неприменима, так как имеется множественное поражение мелких сосудов. Сообщается также о положительном действии плазмафереза и гипербарической оксигенации, но эти методы не являются общепринятыми.
При появлении некрозов проводится ампутация пораженных пальцев рук (при правильном ведении больных это, к счастью, требуется не часто); при гангрене пальцев стопы или самой стопы проводится экономная (низкая) ампутация — обычно по границе некротизированных тканей. У больных с проявлением вторичной инфекции назначаются антибиотики. Прогноз у пациентов, прекративших курение и не имеющих частых обострений, достаточно благоприятный. У больных, продолжающих курить, с частыми обострениями заболевания — прогноз в отношении сохранения стопы значительно хуже.
Ампутация и экзартикуляция. Принципы ампутации и протезирования верхних и нижних конечностей.
Ампутация (лат. amputatio) — усечение дистально расположенной части органа в результате травмы или хирургической операции. Наиболее часто термин употребляется в значении «ампутация конечности» — усечение её на протяжении кости (или нескольких костей) в отличие от экзартикуляции (вычленения на уровне сустава).
Классификация ампутаций
1. По времени выполнения (по П. А. Куприянову — Н. Н. Бурденко)
Первичные (в порядке первичной хирургической обработки)
Ранние
Поздние
Вторичные (по поводу осложнений)
Повторные (реампутации)
2. По способу усечения мягких тканей
Круговые — применяются на тех отделах конечностей, где кость равномерно окружена мягкими тканями. Различают следующие виды круговых ампутаций:
Гильотинные: все мягкие ткани и кость отсекаются в одной плоскости без оттягивания кожи. Обычно применяются при анаэробной инфекции, особенно при газовой гангрене, так как при таком способе культя хорошо аэрируется. Однако при таком способе удаления пораженных тканей образуется порочная культя, требующая реампутации.
Одномоментные: кожа и подкожная жировая клетчатка оттягивается проксимально, затем весь слой мягких тканей пересекается ампутационным ножом, а кость перепиливается. Единственное преимущество заключается в быстроте исполнения — такая операция проводится в том случае, если ослабленный больной не может перенести более сложный способ ампутации.
Двухмоментные: сначала рассекается оттянутая проксимально кожа, подкожная жировая клетчатка и поверхностная фасция (1-й момент), затем по краю кожи рассекаются мышцы (2-й момент) и перепиливается кость.
Трехмоментная конусо-круговая ампутация бедра по Н. И. Пирогову: вначале рассекается оттянутая проксимально кожа, подкожная жировая клетчатка и поверхностная фасция (1-й момент), затем по краю кожи рассекаются поверхностные мышцы (2-й момент), далее по краю сократившихся поверхностных мышц рассекаются глубокие мышцы (3-й момент), после чего мягкие ткани сдвигают проксимально ретрактором и перепиливают кость. Два последних способа ампутации позволяют укрыть опил кости мягкими тканями, образующими «конус».
Эллипсовидные
Лоскутные — обычно производятся на голени и предплечье.
Однолоскутные
Двухлоскутные (с передне-задними и кособоковыми лоскутами)
3. По отношению к надкостнице
Субпериостальные — пластический способ, при котором опил кости покрывается лоскутами надкостницы с удаляемой части;
Апериостальные — способ ампутации у взрослых, при котором на протяжении 4 см остается оголенная кость. При этом способе надкостницу пересекают скальпелем и сдвигают распатором Фарабефа дистально на расстояние не менее 0.5 см, а распиливание кости ведут на расстоянии 2-3 мм дистальнее от ровного проксимального края надкостницы;
Периостальные — надкостницу рассекают дистальнее уровня распила кости и оттягивают проксимально, чтобы далее укрыть ею опил кости. Метод применим только в детской хирургии вследствие хорошей эластичности надкостницы у детей; подобная операция у взрослых приводит к повреждению надкостницы, ведущему к её окостенению с образованием остеофитов, которые становятся причиной формирования порочной культи.
4. По способу закрытия костного опила
Костно-пластическая ампутация по методу Пирогова (1867)
(применяются обычно при ампутации нижних конечностей — например, ампутация голени по Пирогову, по Биру, ампутация бедра по Гритти-Шимановскому-Альбрехту). При этом способе опил укрывают костным лоскутом (например, при удалении голени по Пирогову — лоскутом пяточной кости), что позволяет сформировать полноценную опорную культю благодаря отсутствию травматизации мягких тканей опилом кости.
Периостопластические
Тенопластические (напр., ампутация бедра по Каллендеру)
Миопластические (над опилом кости мышцы сшиваются практически всегда, кроме тяжелых огнестрельных ранений, анаэробной инфекции, сосудистой патологии)
С пластикой кожно-подкожно-фасциальными лоскутами
Без закрытия культи
Показания:
Осложнения заболеваний сосудов при невозможности реконструктивного лечения (сухая гангрена конечности, хроническая критическая ишемия конечности — стадии III—IV по классификации Fontain-Покровского — при невозможности её купирования, острая необратимая ишемия конечности, синяя флегмазия — тотальный тромбоз всех венозных стволов, белая флегмазия — тотальный тромбоз артерий и вен конечности). Решение об ампутации принимается только совместно с сосудистым хирургом. Реконструктивная сосудистая операция менее травматична для больного, чем ампутация. Однако в случае необратимой ишемии конечности выполнение ампутации является единственно возможным методом спасения пациента, так как восстановление кровотока в конечности может привести к гибели на фоне тяжелейшего реперфузионного синдрома.
Тяжелая гнойная патология, угрожающая жизни (анаэробная инфекция, в том числе газовая гангрена, влажная гангрена). Чаще, чем при других формах хирургической инфекции конечностей, к ампутациям прибегают у больных с синдромом диабетической стопы, так как у них имеются нарушения местной сосудистой воспалительной реакции (отграничение) и иммунитета. Однако более, чем у половины больных с диабетической стопой ампутации можно избежать при полноценном лечении. В современных условиях показания к ампутации при хирургической инфекции должны быть значительно сокращены за счёт применения активной хирургической тактики, современных антибиотиков и средств местного лечения.
Тяжелая травма (синдром длительного сдавления, конечность, висящая на лоскуте мягких тканей и т. п.) В настоящее время показания к первичной ампутации при травме резко ограничены, так как имеются возможности реплантации конечности, имеются современные способы лечения ран и раневой инфекции.
Злокачественные новообразования:
Ортопедические заболевания, нарушающие функцию конечности и не подлежащие ортопедической коррекции. К таковым относят различные варианты порочной культи, требующие реампутации.
Приступая к ампутации необходимо помнить о последующем протезировании, т.к. образующаяся культя не просто остаток конечности, а орган с новыми анатомо-физиологическими особенностями, предназначенный служить человеку всю его жизнь и, притом, в сочетании с протезом. Учитывая опорную функцию нижней конечности, культя должна отвечать определенным требованиям.
Общие принципы ампутаций и экзаркуляций.
I. Целью всякой ампутации является:
предотвратить распространение инфекции и поступление продуктов метаболизма из очага поражения в организм пострадавшего и, тем самым, спасти жизнь больного.
Создать работоспособную культю пригодную для протезирования
II. Обезболивание
III. Положение больного на спине, хирург стоит справа от больного.
IV. Обезболивание конечности
V. Определение уровня ампутации.
VI. Этапы ампутации
Общим принципом ампутаций и экзаркуляций является то, что все они без исключения проводятся в три этапа:
I этап – рассечение мягких тканей
II этап – обработка надкостницы и перепиливание кости
III этап – туалет культи
Критерии годности культи к протезированию
длина культи от вышерасположенного сустава должна быть достаточной (не короче диаметра), чтобы больной мог владеть протезом;
форма культи должна быть цилиндрической, слегка суживающейся книзу (жесткая тотально-контактная приемная полость протеза);
кожный рубец должен быть линейным, подвижным и неспаянным с костью;
культя должна быть безболезненной;
оставшиеся суставы должны быть подвижными.
Экзартикуляция - это ампутация на уровне сустава.
Болезнь Рейно. Клиника. Диагностика. Лечение.
Болезнь Рейно — относится к вазоспастическим заболеваниям, представляет собой ангиотрофоневроз с преимущественным поражением мелких концевых артерий и артериол. Заболевание поражает верхние конечности, как правило, симметрично и двусторонне.
Выделяют 3 основные стадии заболевания:
ангиоспастическую (кратковременные спазмы сосудов концевых фаланг 2-3 пальцев кисти или 1-3 пальцев стопы; спазм быстро сменяется расширением сосудов с покраснением кожи, потеплением пальцев);
ангиопаралитическую (кисть и пальцы приобретают цианотичную окраску, отечность и пастозность пальцев);
трофопаралитическую (склонность к развитию панарициев и язв, очаги поверхностного некроза мягких тканей концевых фаланг, после отторжения — длительно незаживающие язвы).
Дифференциальный диагноз проводится с облитерирующим эндартериитом и нарушениями кровообращения в конечности, обусловленными сдавлением подключичной артерии; в качестве заболеваний для дифференциальной диагностики также рассматриваются другие вазоспастические патологии.
Для больных данным синдромом характерно специфическое нарушение микроциркуляции, проявляющееся в виде зябкости пальцев и реакции на холод в виде болей и побледнения. Иногда, по определенным рисункам капилляров кровеносных сосудов, которые прилегают к ногтевым пластинам, можно определить феномен Рейно. Однако следует отметить, что не существует какого-либо однозначного клинического синдрома, свидетельствующего о наличии данного синдрома. Врач может также провести определенные исследования конечностей пациента, чтобы исключить сжатие кровеносных сосудов, имитирующее феномен Рейно, как, например, синдром лестничной мышцы.
Обычно у людей с феноменом Рейно, который рассматривается как одно из проявлений ревматических заболеваний, повышена скорость оседания эритроцитов, отмечается повышенный уровень антинуклеарных антител
Методы лечения болезни Рейно можно разделить на две группы — консервативные и хирургические.
Консервативные методы включают применение сосудорасширяющих лекарственных средств (например, фентоламин). Лекарственная терапия при болезни Рейно продолжается в течение жизни больного. Следует отметить, что при длительном приеме данных препаратов неизбежно происходит развитие осложнений.
Хирургическим методом лечения является симпатэктомия. Суть лечения заключается в «выключении» нервных волокон, по которым идут патологические импульсы, заставляющие кровеносные сосуды спазмироваться. Существуют несколько видов симпатэктомии. Наименее травматичной является эндоскопическая симпатэктомия.
Варикозное расширение вен нижних конечностей (Варикоз). Первичный и вторичный варикоз. Клиника. Функциональные пробы. Диагностика. Дифференциальный диагноз. Показания и противопоказания к традиционным и эндохирургическим операциям. Виды операций. Склерозируюитя терапия.
Варикозное расширение вен нижних конечностей (варикозная болезнь) — расширение поверхностных вен нижних конечностей, сопровождающееся несостоятельностью клапанов и нарушением кровотока. Варикозное изменение вен может быть первичным или вторичным. Разделить заболевания по этому признаку чрезвычайно важно. Первичное варикозное расширение вен развивается при отсутствии поражения глубоких вен и в целом протекает доброкачественно. Варикозное изменение вен вследствие обструкции или недостаточности клапанов глубокой венозной системы представляет собой значительно более серьезное заболевание. Клинические признаки варикозного расширения вен. Ведущим признаком варикозной болезни является расширение подкожных вен, из-за которого болезнь и получила своё название. Варикозное расширение вен, как правило, появляется в молодом возрасте, у женщин – во время или после беременности. В начальных стадиях заболевания появляются немногочисленные и весьма неспецифичные симптомы. Больных беспокоят чувство тяжести и повышенной утомляемости, распирание и ночные судороги в икроножных мышцах. Одним из частых симптомов, появляющихся уже в самом начале заболевания, бывают преходящие отеки и боль по ходу вен (зачастую ещё не расширенных). Весь этот симптомокомплекс настолько отличается от пациента к пациенту, что практически единственным удачным его названием следует признать «синдром беспокойных ног». Не обязательно наличие данного синдрома предрасполагает к последующей варикозной трансформации вен. Однако большинство больных с варикозным расширением вен нижних конечностей в начале заболевания отмечали какие-либо из перечисленных симптомов. Заболевание развивается медленно – годами, а порой и десятилетиями. В дальнейшем к перечисленным субъективным симптомам присоединяются регулярно возникающие к вечеру и исчезающие к утру отеки. При появлении таких отеков следует говорить о развившейся хронической венозной недостаточности. Если пациенты на этой стадии не получают необходимого лечения, у определенной их части возникает гиперпигментация кожи голеней и липодерматосклероз. В более запущенных случаях возникают трофические язвы. Диагностика первичного варикозного расширения вен основана на осмотре нижних конечностей больного, находящегося в вертикальном положении. При варикозном расширении вен диаметр сосудов увеличивается, они становятся извитыми; в патологический процесс чаще всего вовлекаются сосуды систем большой и малой подкожных вен. Если изолированный клубок вен находится в нетипичном месте, то можно думать об имеющейся недостаточности перфорирующих вен или артериовенозных свищей. Для подтверждения диагноза недостаточности клапанов глубоких и перфорирующих вен можно использовать допплеровское измерение скорости кровотока. Клапанная недостаточность проявляется развитием рефлюкса (обратного кровотока) в венах при выполнении пробы Вальсальвы. Функциональные пробы состояния клапанов вен нижних конечностей.
О состоянии клапанного аппарата поверхностных вен позволяют судить проба Троянова —Тренделенбурга и проба Гаккенбруха.
Проба Троянова —Тренделенбурга.Больной,находясь в горизонтальном положении,поднимает ногу вверх под углом 45 °.Врач,поглаживая конечность от стопы к паху,опорожняет варикозно-расширенные поверхностные вены.После этого на верхнюю треть бедра накладывают мягкий резиновый жгут или сдавливают пальцами большую подкожную вену в овальной ямке у места ее впадения в бедренную.Больного просят встать.В норме наполнение вен голени не происходит в течение 15 с.Быстрое наполнение вен голени снизу вверх свидетельствует о поступлении крови из коммуникантных вен вследствие недостаточности их клапанов.Затем быстро снимают жгут (или прекращают сдавление вены).Быстрое наполнение вен бедра и голени сверху вниз свидетельствует о недостаточности остиального клапана и клапанов ствола большой подкожной вены,характерного для первичного варикозного расширения вен.
Проба Гаккенбруха.Врач нащупывает на бедре овальную ямку — место впадения большой подкожной вены в бедренную и просит больного покашлять.При недостаточности остиального клапана пальцы воспринимают толчок крови (положительный симптом кашлевого толчка).
Для оценки состоятельности клапанов коммуникантных вен используют пробу Пратта-2,трехжгутовую пробу Шейниса или пробу Тальмана.
Проба Пратта-2.В положении больного лежа после опорожнения подкожных вен на ногу,начиная со стопы,накладывают резиновый бинт,сдавливающий поверхностные вены.На бедре под паховой складкой накладывают жгут.После того как больной встанет на ноги,под самым жгутом начинают накладывать второй резиновый бинт.Затем первый (нижний)бинт снимают виток за витком,а верхним обвивают конечность книзу так,чтобы между бинтами оставался промежуток 5 —6 см.Быстрое наполнение варикозных узлов на свободном от бинтов участке указывает на наличие здесь коммуникантных вен с несостоятельными клапанами.
Трехжгутовая проба Шейниса по существу является модификацией предыдущей пробы.Больного укладывают на спину и просят приподнять ногу,как при пробе Троянова —Тренделенбурга.После того как подкожные вены спадутся,накладывают три жгута в верхней трети бедра (вблизи паховой складки),на середине бедра и тотчас ниже колена.Больному предлагают встать на ноги.Быстрое наполнение вен на каком-либо участке конечности, ограниченном жгутами,указывает на наличие в этом сегменте коммуникантных вен с несостоятельными клапанами.Быстрое наполнение варикозных узлов на голени свидетельствует о наличии таких вен ниже жгута.Перемещая жгут вниз по голени (при повторении пробы),можно более точно локализовать их расположение.
Проба Тальмана — модификация пробы Шейниса.Вместо трех жгутов используют один длинный (2 —3 м)жгут из мягкой резиновой трубки,который накладывают на ногу по спирали снизу вверх;расстояние между витками жгута — 5 —6 см.Наполнение вен на каком-либо участке между витками свидетельствует об имеющейся в этом пространстве коммуникантной вены с несостоятельными клапанами.
Представление о проходимости глубоких вен дают маршевая проба Дельбе —Пертеса и проба Пратта-1.
Маршевая проба Дельбе —Пертеса.Больному в положении стоя,когда максимально наполняются подкожные вены,ниже коленного сустава накладывают жгут,сдавливающий только поверхностные вены.Затем просят больного походить или промаршировать на месте в течение 5 —10 мин.Если при этом подкожные вены и варикозные узлы на голени спадаются,значит, глубокие вены проходимы.Если вены после ходьбы не запустевают,напряжение их на ощупь не уменьшается,то результат пробы надо оценивать осторожно,так как он не всегда указывает на непроходимость глубоких вен,а может зависеть от неправильного проведения пробы (сдавление глубоких вен чрезмерно туго наложенным жгутом),от наличия резкого склероза поверхностных вен,препятствующего спадению их стенок.Пробу следует повторить.
Проба Пратта-1.После измерения окружности голени (уровень следует отметить,чтобы повторное измерение провести на этом же уровне)больного укладывают на спину и поглаживанием по ходу вен опорожняют их от крови.На ногу (начиная снизу)туго накладывают эластичный бинт,чтобы надежно сдавить подкожные вены.Затем больному предлагают походить в течение 10 мин.Появление боли в икроножных мышцах указывает на непроходимость глубоких вен.Увеличение окружности голени после ходьбы при повторном измерении подтверждает это предположение.
Локализацию перфорантных вен с несостоятельными клапанами можно определить иногда путем пальпации дефектов в апоневрозе,через которые они перфорируют фасцию.Инструментальная оценка несостоятельности клапанов точнее перечисленных выше проб.
Варикозное расширение вен нижних конечностей — заболевание хирургическое, поэтому радикальное его лечение возможно только хирургическими методами. Людям, имеющим факторы риска и наследственную предрасположенность к варикозной болезни необходимо один раз в 2 года консультироваться у флеболога с обязательным ультразвуковым исследованием вен.
Флебэктомия. Хирургическое лечение варикозных вен предполагает их удаление. Данный вид оперативного вмешательства длится 1—2 часа. Удаления вен, находящихся под кожей, не оказывает нагрузку на более глубокие слои вен. По ним, как правило, проходит не более 10% крови. Процедура атравматична, рубцы достигают 4—5 мм.
Показания
обширный варикоз
расширенные подкожные вены
нарушение оттока крови
трофические язвы, сопровождающие варикоз
тромбофлебит
Противопоказания
поздняя стадия варикозного расширения вен
ишемическая болезнь сердца
тяжелые инфекционные заболевания
вторая половина беременности
пожилой возраст
Эндовазальная (эндовенозная) лазерная коагуляция (облитерация) варикозных вен (ЭВЛК, ЭВЛО) — современный метод, призванный устранить рефлюкс крови в поверхностных и перфорантных венах с помощью тепловой энергии лазерного излучения. ЭВЛО позволяет отказаться от выполнения разрезов и не требует госпитализации пациента в стационар.
Методика проведения ЭВЛО складывается из пяти последовательно выполняемых шагов:
Шаг 1. Пункция магистральной подкожной вены и проведение световода.
Шаг 2. Позиционирование рабочей части световода.
Шаг 3. Создание тумесцентной анестезии.
Шаг 4. Проведение эндовазальной лазерной облитерации.
Шаг 5. Наложение компрессионного бандажа.
Радиочастотная коагуляция варикозных вен
Радиочастотная коагуляция (абляция) варикозных вен (РЧК, РЧА) - метод эндовенозного лечения варикозного расширения подкожных вен нижних конечностей, целью которого является устранение рефлюкса по большой и/или малой подкожной вене. Процедура радиочастотной коагуляции варикозных вен выполняется под ультразвуковым контролем, под местной анестезией, без разрезов и без госпитализации.
Под непосредственным визуальным контролем или под контролем специального оборудования производится пункция вены. Выполняется аспирационная проба для подтверждения нахождения кончика иглы в просвете вены. После этого вводится склерозирующий препарат. Дозировка препарата, а также форма введения определяется специалистом- флебологом. Осуществляется экспозиция препарата и накладывается эластичная компрессия. Микроскле-ротерапия не требует эластичной компрессии. Введение препарата в просвет вены безболезненно. После сеанса склеротерапии необходима 40- 60 минутная прогулка. В настоящее время эффективна склеротерапия магистральных вен (большой и (или) малой подкожных) под ультразвуковым контролем. Использование разнообразного инструментального контроля за введением препарата, а также специального оборудования для введения позволяет выполнять прецизионную (точную) склеротерапию, что обеспечивает отличные результаты лечения.
Консервативное лечение варикозной болезни не следует противопоставлять лечению хирургическому. Оно используется в комплексе с ним, дополняя его. Как основное лечение оно используется при невозможности выполнить хирургическое вмешательство. Консервативное лечение не приводит к излечению от варикозной болезни, однако способствуют улучшению самочувствия и может замедлить скорость прогрессирования заболевания.
Ведущим компонентом в программе консервативного лечения является компрессионное лечение. Его эффективность подтверждена многочисленными исследованиями. Действие компрессионного лечения многокомпонентное и заключается в следующем:
уменьшение диаметра поверхностных вен
уменьшение или исчезновение рефлюкса в них
возрастание скорости движения крови по глубоким венам
повышение эффективности работы мышечной венозной помпы
уменьшение объема «балластной» крови в нижних конечностях
уменьшение капиллярной фильтрации и увеличение резорбции
увеличение лимфатического дренажа
В зависимости от характера патологии и преследуемых целей, компрессионное лечение может применяться ограниченный или длительный срок. В клинической практике для компрессионного лечения чаще всего используют эластичные бинты и компрессионный трикотаж. Несмотря на широкое распространения последнего, эластичные бинты не потеряли своего значения.
Лекарственные препараты для лечения варикозной болезни должны удовлетворять следующим критериям:
Повышать тонус вен
Уменьшать проницаемость капилляров и улучшать лимфодренаж
Улучшать микроциркуляцию и устранять реологические расстройства
Ингибировать адгезию лейкоцитов к венозной стенке и купировать воспаление
Хорошо переноситься больными
Варикозное расширение вен нижних конечностей. Течение заболевания. Осложнения, их клиника и лечение. Правила, Эластического бинтования нижних конечностей. Причины рецидива варикозной болезни.
|
Осложнения варикозной болезни. К осложнениям варикозной болезни относят тромбофлебит, кровотечение и образование трофических язв. Кровотечение из варикозных вен бывает спонтанным и травматическим, наружным и подкожным. Наибольший риск представляет наружное кровотечение, обусловленное травматическим разрывом или изъязвлением истонченной кожи над варикозной веной. Кровотечение, обычно, развивается из варикозных вен, расположенных в нижней трети голени и области лодыжек. Неотложные мероприятия включают в себя немедленный перевод пациента в горизонтальное положение, подъем пораженной конечности под максимальным углом и тугое эластическое бинтование (ни в коем случае не наложение жгута!!!). В последующем – пациента необходимо госпитализировать в хирургический стационар, где производится окончательная остановка кровотечения путем прошивания сосуда или его склерооблитерация. Трофическая язва представляет собой дефект кожи, возникающий, как правило, в нижней трети медиальной поверхности голени – в зоне максимально выраженных трофических расстройств. Лечение варикозных трофических язв строится на принципе этапности: первоочередной задачей является закрытие язвы, в последующем – выполняется хирургическое вмешательство, направленное на профилактику рецидива. Помимо этого лечение трофической язвы определяется фазой течения язвенного процесса. Фаза экссудации характеризуется обильным раневым отделяемым, выраженной перифокальной воспалительной реакцией мягких тканей и частой бактериальной обсемененностью язвы. В связи с этим главной задачей лечения в этих условиях является санация трофической язвы от патогенной микрофлоры и некротических тканей, а также подавление системного и местного воспаления. Для этого всем пациентам на 10-14 дней рекомендуют полупостельный режим. Основными компонентами терапии являются антибиотики широкого спектра действия (полусинтетические пенициллины или цефалоспорины), которые назначают парентерально или перорально. При длительно существующих трофических язвах у пациентов с признаками микотического поражения ногтевых пластинок, межпальцевых промежутков и стопы в антибактериальную терапию целесообразно включать противогрибковые препараты и производные нитроимидазола (Флагил, Мератин и др.). При выраженном воспалении мягких тканей, сопровождающимся сильным болевым синдромом, применяют нестероидные противовоспалительные средства (Диклофенак, Кетопрофен и др.) в виде внутримышечных инъекций или свечей. Дополнительно назначают инфузии гемореологически-активных препаратов (Рефортан, Реополиглюкин, Трентал, Аспизол и др.) Важное место занимает местное лечение трофической язвы. Оно включает в себя ежедневный двух-трехкратный туалет язвенной поверхности с помощью мягкой губки и антисептического раствора (Димексид, Эплан, Диоксидин, Хлоргексидин, Цитеал, раствор перманганата калия, отвары ромашки или череды). После этого накладывают повязку с водорастворимой мазью, обладающей осмотической активностью (Левосин, Левомеколь, Диоксиколь и др.), специальные сорбирующие повязки (карбонет) и эластический бандаж. Для предотвращения мацерации мягких тканей по периферии трофической язвы целесообразно нанести цинкооксидную мазь или обработать кожу слабым раствором нитрата серебра. Переход язвы в фазу репарации характеризуется очищением раневой поверхности, появлением грануляций, стиханием перифокального воспаления и уменьшением экссудации. Основной задачей лечения становится стимуляция роста и созревания соединительной ткани. Для этого назначают поливалентные флеботонические препараты (Венорутон, Гинкор-форт, Гливенол, Детралекс и др.), антиоксиданты (Аевит, Токоферол и др.), депротеинизированные дериваты крови телят (Актовегин, Солкосерил). Для улучшения реологических свойств крови целесообразно включать в комплекс лечения ультрафиолетовое или лазерное облучение аутокрови. Для ускорения роста соединительной ткани целесообразно применять Куриозин (гиалуронат цинка). Гиалуроновая кислота является основным структурным компонентом соединительной ткани, ионизированный цинк – активное антисептическое средство. Очень хорошо себя зарекомендовали биодеградирующие раневые покрытия (Аллевин, Альгипор, Альгимаф, Гешиспон, Свидерм и др.). Обязательным компонентом остается адекватная эластическая компрессия. В фазу эпителизаиии, характеризующуюся началом эпителизации трофической язвы и созреванием соединительнотканного рубца, необходимо надежно защитить последний от возможного внешнего механического повреждения. Это достигается постоянным ношением эластического бандажа или компрессионного трикотажа. Необходимо продолжить прием поливалентных флеботоников. После закрытия трофической язвы целесообразно выполнение комбинированной хирургической операции. При наличии серьезных противопоказаний к хирургическому вмешательству пациентам рекомендуют пожизненную эластическую компрессию и прием веноактивных препаратов. Копрессионная терапия подразумевает использование медицинских эластических компрессионных изделий (МЭКИ). Сведения о них хорошо представлены А. В. Покровским и С. В. Сапелкиным. Основная задача использования МЭКИ - ослабление проявления признаков хронической венозной недостаточности при варикозной болезни и варикозеПри назначении компрессионной терапии необходимо обучить пациентов пользоваться эластическими бинтами или чулками. Обычно утром бинтование начинают со стопы. При этом наибольшее натяжение на стопе. По мере наложения витков давление следует уменьшать. Последний виток на бедре фиксируется специальными застежками. Такой же принцип приемлем и для чулок, у которых такое ослабление предусмотрено производителем. Вечером перед сном эластические изделия снимаются. Показания к использованию компрессионной терапии относительны при всех группах варикозной болезни и варикоза. |
В 1986 году Г.И. Лукомский с соавт. разделили причины рецидива варикозного расширения вен нижних конечностей на две группы:
Диагностические ошибки в результате неправильной диагностики локализации перфорантных вен с клапанной недостаточностью, невыявленного варикоза в системе малой подкожной вены;
Тактические ошибки в результате низкой перевязки большой подкожной вены с оставлением латеральной ветви, нерадикального удаления малой подкожной вены, неполной перевязки коммуникантныхвен
Считаем наиболее приемлемым в настоящее время среди причин рецидива варикозной болезни выделять следующие:
Рецидивы, возникшие в результате ошибки при выполнении флебэктомии (оставление длинной культи большой или малой подкожных вен, плохая обработка приустьевых притоков основных стволов, неудаление магистрального ствола подкожной вены, неустраненный стопный варикоз, реканализация вен после склеротерапии);
Рецидивы, возникшие из-за дальнейшего развития заболевания, развитие варикозной болезни в ранее неизмененных отделах венозной системы.
На основании всего вышеизложенного, на современном этапе развития диагностической техники и лечебных возможностей во флебологии причинами развития истинного рецидива варикозного расширения вен можно считать следующие: '
Неадекватное использование возможностей цветного ангиосканирования, невыявленные особенности ангиоархитектоники венозной системы, неполный диагноз — неполная хирургическая коррекция;
Неполноценное хирургическое устранение патологических вертикальных и горизонтальных вено-венозных сбросов крови (оставление длинной культи большой или малой подкожных вен в приустьевом отделе с сохраненными боковыми притоками);
Гиподиагностика и неадекватная интраоперационная обработка несостоятельных перфорантных вен;
Неустраненный стопный варикоз как фактор, поддерживающий венозную гипертензию в поверхностной венозной системе после флебэктомии;
Недиагностированная в предоперационном периоде клапанная недостаточность глубоких вен, приводящая в послеоперационном периоде к нарастанию венозной гипертензии в дистальных отделах нижних конечностей и способствующая развитию рецидива.
Флеботромбозы и тромбофлебиты глубоких вен нижних конечностей. Клиника в зависимости от локализации и протяженности тромбоза. Диагностика. Консервативное и оперативное лечение. Виды операций.
Флеботромбоз- образование в просвете вены тромба, фиксированного к стенке вены, полностью или частично («флотирующий тромб») обтуриру-ющего сосуд с присоединением воспалительных изменений в венозной стенке. Тромбофлебитом называют воспалительные изменения венозной стенки с последующим образованием тромба в просвете вены. С точки зрения современной флебологии нет принципиальных отличий патогенеза тромбофлебита и флеботромбоза. При тромбозе вены всегда есть воспалительные изменения венозной стенки, а воспаление стенки вены (флебит) сопровождается ее тромбозом. Однако фле-бологи, понимая условность подобного деления, пользуются термином тромбофлебит при поражении подкожных, а флеботромбоз - глубоких вен. Исключение составляют лишь крайне редкие в наши дни случаи гнойного расплавления тромботических масс, которое может возникнуть как в поверхностной, так и в глубокой венозной системах.
По течению различают:
Острый тромбофлебит (продолжительность патологического процесса до 1 месяца);
Подострый тромбофлебит (продолжительность клинических проявлений от 1 до 2 месяцев);
Хронический тромбофлебит, или посттромбофлебитический синдром (длительный патологический процесс в венозной системе вследствие перенесенного тромбофлебита, который развиваются в сроки более 2-3 месяцев).
По характеру воспаления тромбофлебит различают на:
Гнойный;
Не гнойный.
По локализации патологического процесса различают:
Тромбофлебит поверхностных вен;
Тромбофлебит глубоких вен.
Тромбофлебит глубоких вен является самостоятельным или осложнением поверхностного тромбофлебита. Чаще всего поражаются глубокие вены голени, затем подколенная и вышележащие вены бедра. Тромбоз глубоких вен всегда тяжелая по своим последствиям и потенциально опасная болезнь. Симптомы: внезапное начало, боли и уплотнения по ходу глубоких вен (икроножные мышцы). Боли усиливаются при давлении. Развивается отечность, ощущение налитости, распирания, жара и судорог в икроножных мышцах. Боли, тяжесть и только что названные ощущения резко усиливаются при опускании ноги. Увеличивается объем соответствующей части конечности. Невозможно встать на ногу. Кожа на стопе, пальцах, голени делается слегка блестящей из-за отека и бледной. Рисунок кожных и подкожных вен резко усиливается, иногда они заметно расширяются.
При тромбофлебите глубоких (и в меньшей степени поверхностных) вен развивается рефлекторный спазм артерий и вен пораженной конечности. Вследствие этого изменяется пульсация на задней и передней артериях стопы, подколенной, а при тромбозе бедренных вен и бедренной артерии. Ухудшается общее состояние. Повышается температура тела, изменяются реакции крови. Тромбоз глубоких вен склонен к обострениям (часто сезонным) и вовлечению других вышерасположенных вен.
Поражение подколенной и особенно бедренной вены протекает значительно тяжелее, чем тромбофлебит голени. Быстро нарастает отек ноги. Кожа делается горячей, синюшной. Развивается спазм сосудов, что определяется по состоянию пульса и изменениям температуры кожи. Появляются сильные боли по ходу пораженных вен голени и бедра. Отекает и ограничиваются движения в коленном суставе. Ткани напряжены по ходу тромбированной вены, кожа горяча на ощупь, отечна. Отмечается резкая болезненность по ходу сосудисто-нервного пучка. Подкожные вены расширены и четко вырисовываются на фоне синюшной и слегка покрасневшей кожи. При тазово-бедренной форме тромбофлебита, т. е. при вовлечении в процесс подвздошных вен, нижней полой вены особенно сильные боли локализуются в голени, бедре и ягодице, нижней половине брюшной стенки. Нарушаются функции кишечника, мочевого пузыря. Развивается тяжелая общая реакция организма с высокой температурой тела, лейкоцитозом, повышением РОЭ, ознобом и т. п. Наступает отек ноги, а иногда и половых органов, промежности, нижней части передней брюшной стенки.
Заболевание глубоких вен нижних конечностей после окончания острого периода переходит в подострую и хроническую стадии развития. Прогрессируют характерные симптомы нарушения венозного артериоло-капиллярного и артериального кровообращения, лимфообращения, обмена, трофизма тканей. Развиваются боли в связи с воспалением нервов, сосудов, подкожной жировой клетчатки.
Диагностика тромбофлебита в большинстве случаев не вызывает существенных затруднений. Применяются инструментальные методы исследования - реовазография или ультразвуковая допплерография. Наиболее точную диагностическую информацию предоставляет ультразвуковое дуплексное ангиосканирование с цветовым кодированием кровотока. Это исследование позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба и даже ориентировочно судить о его «возрасте», т.е. степени организации. Ультразвуковое сканирование подкожных вен дает возможность с абсолютной точностью выявить истинную протяженность тромбоза.
Роль лабораторной диагностики невелика. Общий анализ крови выявляет умеренно выраженные признаки воспаления.
Большинство пациентов с тромбофлебитом могут лечиться консервативно в амбулаторных условиях. Неотложная госпитализация в хирургические стационары (желательно в специализированные сосудистые или флебологические отделения) необходима при восходящих формах тромбофлебита стволов большой и малой подкожных вен, когда возникает угроза перехода тромбоза на глубокие вены. Такие больные должны быть оперированы в экстренном порядке после ультразвукового сканирования.
Хирургическое лечение включает в себя перевязку подкожных вен или удаление всех варикозно расширенных (тромбированных и нетромбированных) вен.
Консервативное лечение тромбофлебита должно быть направлено на устранение воспалительного и локального тромботического процессов. Режим, который предписывается больным, должен быть активным. Ошибкой следует признать назначение постельного режима, поскольку деятельность мышечно-венозной помпы голени обеспечивает интенсивный кровоток в глубоких венах, препятствуя развитию в них тромбоза. В первые дни заболевания, когда максимально выражены воспалительные явления и требуется активное местное лечение, целесообразно формировать бандаж с помощью эластических бинтов средней степени растяжимости. По мере стихания воспалительных явлений для компрессионного лечения может быть с успехом использован медицинский трикотаж - гольфы, чулки или колготы 2-3 компрессионного класса.
Простой, но действенной мерой является местное охлаждение, дающее хороший обезболивающий эффект.
При тромбофлебите оправдано использование различных форм нескольких классов фармацевтических препаратов:
нестероидных противовоспалительных средств (НПВС);
производных рутина;
дезагрегантов;
полиэнзимных смесей;
флеботоников растительного происхождения
антикоагулянтов.
Из группы НПВС наиболее эффективными при данном заболевании являются диклофенак и кетопрофен. Эти препараты оказывают не только мощное противовоспалительное, но и хорошее обезболивающее действие. Гель кетопрофена наносят 2-3 раза в день в количестве 3-5 г (1 см мази, выдавленной из тюбика) непосредственно на пораженный участок конечности и легкими круговыми движениями пальцев рук втирают в кожу. Быстрый эффект дают внутримышечные инъекции НПВС, а также использование их в ректальных свечах. Эти способы применения указанных средств уменьшают частоту и выраженность осложнений.
Эффективным средством лечения тромбофлебита являются производные рутина (рутозид, троксевазин, троксерутин), представляющие собой универсальные протекторы венозной стенки и оказывающие выраженное противовоспалительное действие. Суточная доза различных троксерутинов обычно составляет 1200 мг.
В комплекс консервативных мероприятий целесообразно включать дезагрегантные средства: внутривенное введение реополиглюкина (400 мл) и трентала (10 мл). Вливания проводят капельно 1 раз в сутки в течение 3-5 дней. В таблетках трентал назначают в суточной дозе 800-1200 мг. В профилактических целях могут быть использованы малые дозы аспирина.
Эффект системной энзимотерапии обусловлен способностью ферментов угнетать процесс воспаления, оказывать противоотечное и иммуномодулирующее действие, удалять фиксированные в тканях иммунные комплексы и активизировать фибринолиз. Вобэнзим (смесь панкреатина, папаина, бромелаина, трипсина, химотрипсина, амилазы, липазы и рутина) принимают по 5-10 таблеток 3 раза в день; флогэнзим (смесь бромелаина, трипсина и рутозида) - по 2 таблетки 3 раза в день, запивая большим количеством воды. Сдерживающим фактором для широкого применения системной энзимотерапии является необходимость приема большого числа таблеток в строго определенное время и ее достаточно высокая стоимость.
Гепарин оказывает мощное противотромботическое и противовоспалительное действие. Дозировка и частота применения гепаринсодержащих гелей аналогичны таковым при использовании НПВС. В то же время хорошо зарекомендовало себя чередование этих препаратов, т.е. гелевые аппликации проводят 4 раза в день по схеме: гепарин - НПВС - гепарин - НПВС.
При проведении консервативных мероприятий необходимо помнить о возможности прогрессирования тромбофлебита, несмотря на проводимое лечение. Поэтому в процессе терапии должен проводиться динамический контроль (клинический и ультрасонографический) за течением заболевания.
Тромбоэмболия легочной артерии (ТЭЛА). Причины. Клиника. Диагностика. Дифференциальный диагноз. Консервативное и оперативное лечение. Профилактика.
Тромбоэмболи́я лёгочной арте́рии (ТЭЛА) — закупорка лёгочной артерии или её ветвей тромбами, которые образуются чаще в крупных венах нижних конечностей или таза (эмболия).
В основе заболевания лежит тромбообразование, которому способствуют три фактора (триада Вирхова): нарушение кровотока, повреждение эндотелия сосудистой стенки, гиперкоагуляция и угнетение фибринолиза.
Нарушение кровотока обусловлено варикозным расширением вен, сдавлением сосудов извне (опухолью, кистой, костными отломками, увеличенной маткой), разрушением клапанов вен после перенесённого флеботромбоза, а также иммобилизация, которая нарушает функцию мышечно-венозной помпы нижних конечностей. Полицитемия, эритроцитоз, дегидратация, диспротеинемия, повышенное содержание фибриногена повышают вязкость крови, что замедляет кровоток.
При повреждении эндотелия обнажается субэндотелиальная зона, что запускает каскад реакций свёртывания крови. Причины этого — прямое повреждение стенки сосуда при установке внутрисосудистых катетеров, фильтров, стентов, протезировании вен, травме, операции. Также к повреждению эндотелия приводят гипоксия, вирусы, эндотоксины. При системной воспалительной реакции активируются лейкоциты, которые прикрепляясь к эндотелию повреждают его.
Источником тромбов при ТЭЛА чаще служат вены нижних конечностей (тромбоз вен нижних конечностей), намного реже — вены верхних конечностей и правые отделы сердца. У больных тромбофилией увеличивается вероятность венозного тромбоза.
Диагноз острой массивной ТЭЛА обычно бывает очевиден (при отсутствии других заболеваний и наличии факторов риска).
Малые или повторяющиеся ТЭЛА.
Проявляющиеся только одышкой, часто не замечают, и правильный диагноз устанавливают поздно. У пожилых больных с тяжёлой сердечно-лёгочной патологией может быстро развиться декомпенсация даже при тромбоэмболии мелких ветвей лёгочной артерии. Признаки ТЭЛА часто принимают за обострение основного заболевания, и правильный диагноз ставят поздно.
Наиболее типичные клинические признаки (в порядке убывания по частоте встречаемости: от 70% до10%) - одышка, тахипноэ, боли, напоминающие плеврит, страх смерти, тахикардия, кашель, кровохарканье и явные признаки ,тромбоза глубоких вен нижних конечностей.
К сожалению, признаки с высокой специфичностью имеют низкую чувствительность, и наоборот.
Клинические проявления, даже в сочетании, имеют ограниченное значение для постановки правильного диагноза. Однако ТЭЛА маловероятна при отсутствии трёх следующих симптомов: одышки, тахипноэ (свыше 20 в минуту) и болей, напоминающих плеврит. Если дополнительные признаки (изменения на рентгенограммах органов грудной клетки и РО2 крови) не выявляются, диагноз ТЭЛА фактически можно исключить.
Одышка - наиболее важный признак. Она может возникать в покое либо только при физических нагрузках. Одышка часто связана с тахипноэ и тахикардией. При одышке у больных, из группы риска необходимо всегда исключать ТЭЛА.
Боль в груди может быть спровоцирована инфарктом миокарда, перикардитом, пневмотораксом или пневмонией. Однако при ТЭЛА боль может быть малоинтенсивной и даже отсутствовать.
Кашель и субфебрильная температура тела провоцируются инфекциями лёгких.
Кровохарканье отмечают очень редко.
Клинические признаки тромбоза глубоких вен нижних конечностей нередко отсутствуют, особенно у больных, прикованных к постели.
У 30% больных с ТЭЛА при флебографии не выявляют какой-либо патологии
При аускультации лёгких патологии обычно не выявляют, Возможно тахипноэ. набухание яремных вен бывает связано с массивной ТЭЛА. Характерна артериальная гипотензия; в положении сидя У больного может случиться обморок.
Утяжеление течения основного сердечно-лёгочного заболевания может
быть единственным проявлением ТЭЛА. В этом случае правилый диагноз становить трудно.
Диагностика трудна, так как симптомы ТЭЛА не специфичны, а диагностические тесты несовершенны. Стандартные методы обследования (обычные лабораторные тесты, электрокардиография (ЭКГ), рентгенография органов грудной клетки) полезны только для исключения другой патологии (например, пневмонии, пневмоторакса, переломов рёбер, инфаркта миокарда, отёка лёгких). К чувствительным и специфичным методам диагностики ТЭЛА относят определение d-димера, эхокардиография, компьютерная томография (КТ), вентиляционно-перфузионная сцинтиграфия, ангиография сосудов лёгких, а также методы диагностики тромбоза глубоких вен нижних конечностей (ультрасонография, КТ-венография)
Лечение больных с ТЭЛА должно осуществляться в отделениях реанимации и интенсивной терапии.
Коррекция гемодинамики и гипоксии
При остановке сердца выполняют сердечно-лёгочную реанимацию. В случае возникновения гипоксии у пациента с ТЭЛА проводят оксигенотерапию (маски, носовые катетеры); реже требуется искусственная вентиляция лёгких. Для устранения гипотензии внутривенно вводят солевые растворы или вазопрессоры (адреналин, добутамин, допамин).
Антикоагулянтная терапия
Своевременная антикоагулянтная терапия снижает риск смерти и рецидивов тромбоэмболий, поэтому её рекомендуют начинать не только при подтверждённом диагнозе, но ещё в процессе диагностики при высокой вероятности ТЭЛА. Для этого применяют нефракционированный гепарин (внутривенно), низкомолекулярный гепарин (подкожно) или фондапаринукс (подкожно).
Дозировку нефракционированного гепарина подбирают, учитывая массу пациента и активированное частичное тромбопластиновое время. Для этого готовят раствор гепарина натрия — 20 000 МЕ/кг на 500 мл физиологичесого раствора. Вначале вводят внутривенно струйно 80 МЕ/кг, а затем проводят инфузию со скоростью 18 МЕ/кг/ч. Через 6 часов после струйного введения проверяют АЧТВ и корректирую скорость введения гепарина как указано в таблице. АЧТВ определяют через 3 часа после каждого изменения скорости; при достижении желаемого уровня (46—70 с, в 1,5—2,5 раза выше контроля) этот показатель контролируют ежедневно. В большинстве случаев применяют низкомолекулярные гепарины, так как они эффективнее, безопаснее и удобнее в применении, чем нефракционированный. Однако с осторожностью их следует назначать при дисфункции почек (уменьшение клиренса креатинина <30 мл/мин) и при высоком риске геморрагических осложнений (длительность действия нефракционированного гепарина более короткая и поэтому его можно быстрее отменить в случае развития кровотечения). Из низкомолекулярных гепаринов рекомендованы: эноксапарин. (1 мг/кг каждые 12 ч или 1,5 мг/кг 1 раз в сутки), тинзапарин (англ.)русск. (175 МЕ/кг 1 раз в сутки). У больных с онкологическими заболеваниями можно использовать дальтепарин . (200 МЕ/кг 1 раз в сутки).
Также желательно уже в первый день введения антикоагулянтов прямого действия (гепарины или фондапаринукс) назначить варфарин. При достижении уровня международного нормализованного отношения (МНО) 2—3 и удержании его на таком уровне не менее 2 суток прямые антикоагулянты отменяют (но не ранее, чем через 5 суток от начала их применения). Начальная доза варфарина — 5 или 7,5 мг 1 раз в сутки. Пациентам моложе 60 лет и без серьёзной сопутствующей патологии допустима начальная доза 10 мг. Приём варфарина продолжают не менее 3 месяцев.
Цель реперфузионной терапии — удаление тромба и восстановление нормального лёгочного кровотока. Чаще всего для этого применяют тромболитическую терапию. Её рекомендуют проводить больным высокого риска. Некоторые авторы допускают применение тромболизиса при умеренном риске, однако польза такой терапии в этой группе больных в настоящее время не ясна. Применяют следующие препараты:
Стрептокиназа — нагрузочная доза 250 000 МЕ в течение 30 минут, затем 100 000 МЕ в час в течение 12-24 ч или ускоренная схема 1,5 млн МЕ в течение 2 ч
Урокиназа — нагрузочная доза 4400 МЕ/кг массы тела в течение 10 мин, затем 4400 МЕ/кг массы тела в час в течение 12—24 ч или ускоренная схема 3 млн МЕ в течение 2 ч
Альтеплаза — 100 мг на протяжении 2 ч или ускоренная схема 0,6 мг/кг массы тела на протяжении 15 мин (максимальная доза 50 мг)
Кровотечение — основная проблема тромболитической терапии. Массивное кровотечение развивается в 13% случаев, в 1,8% — внутримозговое кровоизлияние.
Хирургические методы
Хирургическое удаление тромба (тромбэктомия) рассматривают как альтернативный метод лечения ТЭЛА высокого риска, когда тромболитическая терапия противопоказана. Больным с высоким риском рецидива и при абсолютных противопоказаниях к антикоагулянтной терапии возможна установка кава-фильтров[22]. Они представляют собой сетчатые фильтры, которые улавливают отрывающиеся от стенки тромбы и предотвращают их попадание в лёгочную артерию. Кава-фильтр вводят чрескожно, чаще через внутреннюю яремную или бедренную вену, и устанавливают ниже почечных вен (выше — при наличии тромбов в почечных венах)
Синдром Педжета - Шреттера. Определение понятия. Причины острого тромбоза подключичной вены. Клиника. Диагностика. Лечение.
Синдромом Педжета-Шреттера называют острый тромбоз проксимальных отделов подключичной вены с распространением его на подмышечную вену и вены плеча и нарушением венозного оттока в верхней конечности. Развитию заболевания способствуют топографоанатомические особенности подключичной вены,- расположенной в окружности костных и сухожильно-мышечных образований. При сильных напряжениях мускулатуры плечевого пояса, сочетающихся с движениями в плечевом суставе, уменьшаются размеры подключичного пространства и вена оказывается сдавленной между ключицей и I ребром. Особенно благоприятные условия для нарушения оттока по подключичной вене, а следовательно, и тромбообразования возникают при высоком стоянии I ребра, гипертрофиях подключичной мышцы и мышечно-сухожильной части малой грудной мышцы. Клиника и диагностика: синдром Педжета - Шреттера-Кристелли наблюдается преимущественно у людей в возрасте 20-40 лет с хорошо развитой мускулатурой, занимающихся спортом или тяжелым физическим трудом. Основными клиническими признаками острого тромбоза подключичной вены являются выраженный отек, цианоз, напряжение и расширение подкожных вен верхней конечности и плечевого пояса соответствующей стороны (чаще справа), боли. Появлению этих симптомов обычно предшествует значительная физическая нагрузка.
Отек характеризуется плотностью и отсутствием ямок при надавливании. Нередко он захватывает не только руку и плечевой пояс, но и переходит на верхнюю половину грудной клетки. Расширение и напряжение подкожных вен в ранние сроки заболевания заметно лишь в области локтевой ямки. Впоследствии локализация расширенных вен соответствует границам распространения отека. Цианоз кожных покровов наиболее выражен в области кисти и предплечья.
При распространении тромбоза на подкрыльцовую и плечевую вены течение заболевания становится тяжелым. Нарастающий отек тканей в ряде случаев ведет к сдавливанию артериальных стволов, вследствие чего ослабевает пульс на лучевой -артерии и снижается температура конечности. Нарушения артериального кровообращения иногда настолько значительны, что возникает опасность развития гангрены.
После стихания острых явлений наступает обратное развитие клинической картины.
Однако у некоторых больных полного регресса симптомов заболевания не происходит, что позволяет выделить хроническую стадию синдрома.
Диагностика острого тромбоза подключичной вены в большинстве случаев не представляет трудностей. Она основывается на указанных выше симптомах и на частой связи заболевания с физической нагрузкой. Ценным методом исследования, позволяющим судить о локализации и распространенности тромбоза, о степени развития коллатеральных сосудов, является флебография, при которой контрастное вещество вводят в кубитальную вену или в одну из поверхностных вен тыльной поверхности кисти.
В острой стадии заболевания проводится преимущественно консервативное лечение с применением фибринолитических и антикоагулянтных препаратов, ангиопротекторов, спазмолитиков, аналгетиков, компрессионной терапии. Показания к хирургическому лечению определяются в зависимости от тяжести клинических проявлений и обычно возникают при угрозе развития венозной гангрены, выраженных регионарных гемодинамических нарушениях. При острых тромбозах подмышечной и подключичной вен, не поддающихся консервативной терапии, выполняется тромбэктомия, оптимальными сроками для которой являются первые дни от момента развития клинической картины заболевания. Вопрос о реконструктивных вмешательствах решается в первые два месяца от начала заболевания, так как венозная гипертензия является важным фактором для обеспечения функции шунта, поэтому более оправдано раннее применение реконструктивных операций, когда пути коллатерального оттока крови еще недостаточно развиты.
Грыжи живота. Определение. Элементы грыжи живота. Классификация грыж живота по происхождению и локализации. Общая симптоматика грыж. Редкие формы грыж живота.
ГРЫЖИ ЖИВОТА — выпячивание из брюшной полости внутренностей вместе с покрывающим их пристеночным листком брюшины через "слабые» места брюшной стенки под кожу (наружные грыжи) или в различные карманы и сумки брюшины (внутренние грыжи). Различают наружные и внутренние грыжи.
Наружные грыжи. Грыжами называется выхождение брюшных органов, покрытых пристеночной брюшиной, через дефекты в брюшной стенке под кожу (в отличие от ложных грыж, не имеющих брюшинного покрытия, например, так называемые грыжи пупочного канатика, или выпадения внутренностей наружу – эвентерации).
Внутренние грыжи – выхождение брюшных внутренностей в различные карманы брюшины или брыжейки, или через отверстия диафрагмы – в грудную полость (при этом органы покрыты брюшиной).
I/ по происхождению – врожденные и приобретенные (травматические и после операционные);
2/ по локализации – паховые, бедренные, пупочные, белой линии (чаще), поясничные, промежностные, спигелиевой линии (реже).
3/ по течению – полные и неполные, неосложненные и осложненные.
В грыже различают – грыжевые ворота, грыжевой мешок, грыжевое содержимое и грыжевые оболочки.
Грыжевые ворота – дефект (отверстие) в брюшной стенке, через которое выходит грыжа. Чаще всего это врожденные "слабые места": место выхода семенного канатика, пупочного канатика, сосудов, нервов; при приобретенных – образованные в результате травм и операций. Форма их различна – округлая, овальная, щелевидная, треугольная. По размерам различают малые (до 2 см в диаметре), средние (2-4 см) и большие (свыше 4 см в диаметре). Они могут быть в виде каналов или кольца.
Грыжевой мешок – выпячивание париетальной брюшины (в виде дивертикулов) через грыжевые ворота. По форме бывают грушевидные, цилиндрические, шаровидные, в виде "песочных часов", многокамерные. Различают устье, шейку, тело и дно. Грыжевой мешок в недавно образованных грыжах – тонкий, полупрозрач-ный, гладкий – неизмененная брюшина; в застарелых – плотный, со сращениями, рубцово изменен, снаружи часто покрыт предбрюшинным жиром.
Грыжевое содержимое – любой орган брюшной полости, чаще всего тонкий кишечник и сальник, реже отделы толстого кишеч-ника, снабженного брыжейкой (слепая, поперечно-ободочная, сигма), червеобразный отросток, жировые подвески, трубы матки и яичник. Грыжевым содержимым при разной локализации грыж могут быть практические любые органы брюшной полости. Если в грыжевой мешок опускается орган, частично покрытый брюшиной (слепая кишка, мочевой пузырь), он может составлять одну из стеной грыжевого мешка- это, так называемая, скользящая грыжа .
Оболочки грыжевого мешка – неодинаковы в разных грыжах: это могут быть предбрюшинная клетчатка, фасции (поверхностная, поперечная), волокна мышц (m. cremaster), элементы семенного канатика
Заболевание развивается постепенно, редко сразу после физического перенапряжении, кашля.
Субъективные ощущения: а/ боли разной интенсивности и иррадиации, усиливаются в вертикальном положении, при физическом напряжении. Боли более выражены в начальном периоде, иногда могут отсутствовать, б) диспепсические явления – тошнота, рвота, отрыжки, запоры; в/ дизурия (при скользящих грыжах) – наблюдаются не всегда.
Объективные данные: I/ Наличие грыжевого выпячивания – припухлости шаровидной или овальной формы, с неизмененной кожей, в характерном месте, появляющаяся в вертикальном положении или при натуживании; 2/ вправимость ее (в лежачем положении), самопроизволь-но или рукой – классический признак грыжи; 3/ наличие грыжевых ворот 4/ феномен кашлевого толчка; 5/ данные перкуссии (тимпанит при наличии в грыжевом мешке кишки, тупость при наличии сальника); 6/ данные аускультации – урчание, особенно в момент вправления кишки; 7/ "Шприц-феномен" – при вправлении сальника.
Наиболее трудна диагностика грыж в начальном периоде, когда они не контурируются или с трудом выходят. Необходимо тщательное исследование в поисках грыжевых ворот и канала в положении лежа при расслабленной брюшной стенке, определение "феномена кашлевого толчка".
Запирательные грыжи выходят из брюшной полости через запирательное отверстие таза. Canalis obturatorius имеет внутреннее и наружное отверстия. Его ширина 1 см, длина 2,5–3 см. Грыжевой мешок формируется со стороны таза в области запирательной ямки, затем внедряется в расширенное внутреннее отверстие запирательного канала, проходит его и выходит через внутреннее отверстие на медиальную поверхность бедра под приводящими мышцами.
Поясничные грыжи (herniae lumbales) Выходят из брюшной полости через заднюю её стенку, чаще в области пространства Грюнфельда-Лесгафта и треугольника Пети. Они встречаются исключительно редко.
Промежностные грыжи (herniae perineales) Выходят из брюшной полости на промежность через дефекты диафрагмы таза. Встречаются исключительно редко. Различают врождённые и приобретенные промежностные грыжи. Врождённые грыжи являются следствием аномалий в развитии мускулатуры тазового дна, приобретенные – возникают под влиянием причин, среди которых выделяют: а) слабость тазового дна; б) нарушение целостности тазового дна после оперативных вмешательств или травм; в) наличие внутритазовой, субперитонеальной опухоли . По анатомическому расположению бывают передние и задние промежностные грыжи. Граница их деления – межседалищная линия или глубокая поперечная мышца промежности. Грыжи, выходящие впереди этой мышцы, называют передними, а выходящие сзади – задними. Передняя промежностная грыжа у женщин развивается из пузырно-маточного углубления брюшины и проходит в щель между m. constrictor ani и m. ischiocavernosus. Далее она расслаивает ткани, проходит в большую половую губу, выпячивая центральную её часть. У мужчин передние промежностные грыжи практически не наблюдаются. Этому препятствует плотная мочеполовая перегородка с отверстием только для мочеиспускательного канала. Задняя промежностная грыжа у мужчин начинается из пузырно-прямокишечного углубления брюшины, у женщин – из маточно-прямокишечного. Далее грыжа проходит кзади от межседалищной линии и через межкишечные щели выходит в клеточное пространство седалищно-прямокишечной впадины. Наиболее частым местом прохождения грыжи через диафрагму таза являются щели между подвздошно-копчиковой мышцей и мышцей, поднимающей задний проход, между подвздошно-копчиковой и копчиковой мышцами, а также щели в мышце, поднимающей задний проход.
Седалищные грыжи (hernia ischiadicae). Грыжевое выпячивание выходит из брюшной полости через большое или малое седалищные отверстия. В связи с этим, выделяют три формы: а) седалищная грыжа, выходящая над грушевидной мышцей (hernia suprapiriformis); б) седалищная грыжа, выходящая под грушевидной мышцей (hernia infrapiriformis); в) седалищная грыжа, выходящая через малое седалищное отверстие (hernia spinotuberosa
Показания и противопоказания к грыжесечению. Основные этапы операции грыжесечепия. Принципы надежной пластики грыжевых ворот.
В основном все грыжи должны быть устранены, если местный или системный статус больного предвещает надежный исход. Возможным исключением из этого правила является грыжа, имеющая широкую шейку и мелкий мешок, т. е. признаки, указывающие на возможность медленного увеличения грыжи. Грыжевые бандажи и хирургические ремни успешно используют при лечении небольших грыж в ситуации, когда операция противопоказана, но применение грыжевых бандажей не рекомендуется больным, обладающим бедренными грыжами.
Противопоказания к операции: абсолютные – острая инфекция, тяжелые заболевания – туберкулез, злокачественные опухоли, выраженная дыхательная и сердечная недостаточность и пр. Относительные – ранний возраст (до полугода), состояние одряхления, последние 2-3 месяца беременности, стриктуры уретры, аденома предстательной железы (грыжесечение производится после их устранения).
Операция во всех случаях складывается из двух этапов: I/ собственно грыжесечение – выделение грыжевого мешка, вскрытие его, вправление внутренностей, прошивание и перевязка мешка в области шейки и отсечение его – производится одинаково при всех формах грыж; 2/ пластика (ушивание) грыжевых ворот – производится различно даже при одной и той же форме грыж, в зависимости от этого различают разные методы грыжесечения.
Обезболивание – традиционно местное (новокаин или лидокаин) – при небольших грыжах у взрослых, наркоз применяется при всех других грыжах у взрослых, в том числе осложненных больших послеоперационных грыжах и у невропатов, а также у детей.
Предоперационная подготовка- гигиеническая ванна и бритьё операционного поля, очистительная клизма накануне операции. В послеоперационном периоде – профилактика легочных осложнений, борьба с метеоризмом. Сроки вставания варьируют в зависимости от особенностей больного и операции.
Последний наиболее важный этап операции - пластику грыжевых ворот производят различными способами: 1) путем сшивания местных однородных тканей (аутопластические методы); 2) с использованием дополнительных биологических или синтетических материалов (аллопластические методы).
Косая паховая грыжа. Клиническая картина. Диагностика. Дифференциальный диагноз. Методы операций. Врожденная паховая грыжа.
Косые паховые грыжи образуются в результате выпячивания грыжевого мешка через внутреннее паховое кольцо, соответствующее латеральной паховой ямке. Грыжевой мешок при этом покрыт общей влагалищной оболочкой семенного канатика и повторяет его ход.
В зависимости от стадии развития принято различать следующие формы косых паховых грыж (по А.П. Крымову): 1) начальная грыжа, при которой мешок определяется только в паховом канале; 2) канальная форма - дно мешка доходит до наружного отверстия пахового канала; 3) канатиковая форма - грыжа выходит через наружное от верстие пахового канала и располагается на различной высоте семенного канатика; 4) паховомошоночная грыжа - грыжевой мешок с содержимым опускается в мошонку (у женщин - в клетчатку большой половой губы).
Врожденные паховые грыжи всегда являются косыми. Они развиваются в случае незаращения влагалищного отростка брюшины. Последний, сообщаясь с полостью брюшины, образует грыжевой мешок. На дне грыжевого мешка лежит яичко, поскольку собственная его оболочка является одновременно внутренней стенкой грыжевого мешка. Врожденные паховые грыжи нередко сочетаются с водянкой яичка или семенного канатика.
Диагноз паховой грыжи обычно не представляет затруднений. Характерным объективным признаком является выпячивание перед¬ней брюшной стенки в паховой области, увеличивающееся при нату живании и кашле. При косой паховой грыже оно имеет продолговатую форму, располагается по ходу пахового канала, часто опускается в мошонку.
Пальцевое исследование грыжевого канала позволяет определить его направление и дифференцировать вид грыжи. При косой паховой грыже палец не опре¬ деляет наличия кости при продвижении его по паховому каналу, так как этому мешают мышечно-апоневротические элементы пахового треугольника. Не извлекая пальца из грыжевого канала, больного просят потужиться или покашлять - определяют симптом кашлевого толчка. Дифференциальная диагностика. Паховую грыжу следует дифференцировать от бедренной грыжи, водянки оболочек яичка, кисты семенного канатика и нукова канала, крипторхизма, варикоцеле, пахового лимфаденита, опухолей в зоне пахового канала. При дифференцировании грыжи, водянки, опухоли яичка целесообразно применять метод трансиллюминации. Источник света (фонарик) устанавливают с одной стороны мошонки, а с другой стороны с помощью какой-либо трубочки определяют свечение. При грыже и опухоли яичка свечения нет, а при водянке оно определяется. Для крипторхизма характерны высокое расположение «опухоли» у корня мошонки, несмещаемость ее и невозможность вправления в брюшную полость.
Наличие паховой грыжи является показанием к оперативному лечению. Способов восстановления и реконструкции брюшной стенки при паховых грыжах предложено более 200. Условно их можно разделить на три группы:
• Методы укрепления передней стенки пахового канала без рассечения апоневроза наружной косой мышцы живота. В эту группу входят способы Ру, Ру-Оппеля, Краснобаева. Применяются они при неосложненных паховых грыжах в детском возрасте.
• Методы, направленные на укрепление передней стенки пахового канала после рассечения апоневроза наружной косой мышцы живота (способы операции Мартынова, Жирара, Спасокукоцкого, Кимбаровского и др.).
3. Методы герниопластики, связанные с укреплением задней стенки пахового канала и перемещением семенного канатика. В эту группу входят способы Бассини, Кукуджанова, Мак-Вея, Шулдайса, Постемпского и др.
При выборе метода герниопластики необходимо помнить, что в генезе формирования паховых грыж ведущую роль играют не слабость апоневроза наружной косой мышцы живота и расширение наружного пахового кольца, а ослабление задней стенки пахового канала и увеличение диаметра его глубокого отверстия. Исходя из этой предпосылки, при всех прямых, большинстве косых грыж и рецидивных грыжах следует пользоваться методами пластики задней стенки пахового канала. Укрепление передней его стенки может быть при менено у детей и молодых мужчин при небольших косых паховых грыжах. Целесообразность такой хирургической тактики подтверждена статистикой отдаленных результатов грыжесечения.
Особенность операции при врожденной паховой грыже заключается в методике обработки грыжевого мешка. Последний выделяют у шейки, перевязывают и пересекают. Дистальную часть мешка не удаляют, а рассекают ее по всей длине вдоль, затем выворачивают и сшивают позади семенного канатика и яичка (аналогично операции Винкельмана при водянке яичка). Пластику пахового канала производят по одному из перечисленных выше методов.
Последовательность операции по поводу паховой грыжи однотипна при различных методах и состоит из следующих этапов:
Первый этап - формирование доступа к паховому каналу. Обнажение пахового канала достигается разрезом кожи, производимой параллельно паховой связке и выше ее на 2 см длиной около 10-12 см. Соответственно ране рассекается апоневроз наружной косой мышцы живота и обнажается пупартова связка.
Второй этап - выделение из окружающих тканей и удаление грыжевого мешка. Прошивание шейки мешка перед его отсечением производят или снаружи, или изнутри кисетным швом, но обязательно под контролем глаза.
Третий этап - ушивание глубокого пахового отверстия до нор мальных размеров (0,6-0,8 см) при его расширении или разрушении.
Четвертый этап операции - пластика пахового канала.
Большое количество операций, предложенных для лечения паховых грыж, отличается друг от друга лишь завершающим этапом -способом пластики пахового канала.
Прямая и косая паховые грыжи (анатомические и клинические различия).. Причины рецидива грыж. Методы операций.
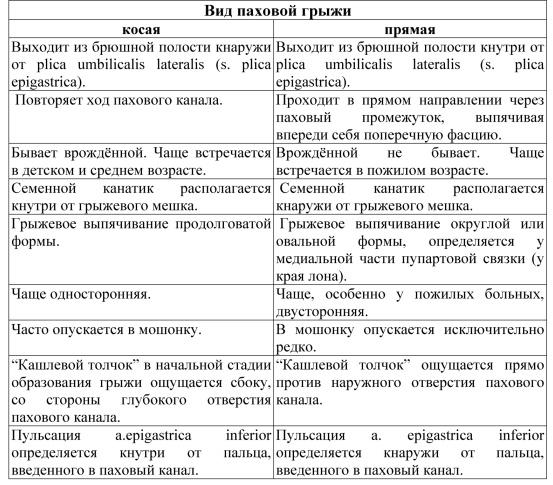
Причины рецидивирования паховых грыж многообразны. Их можно систематизировать следующим образом: 1) причины, существующие до операции; 2) причины, зависящие от вида произведенной операции и её технического исполнения; 3) причины, возникшие в послеоперационном периоде.
К первой группе причин рецидивов относятся: 1) поздняя операция при наличии значительных изменений тканей паховой области (давно замечено [А.И. Барышников, 1965], что чем дольше существует грыжа, тем более глубокие морфологические изменения она вызывает в паховом канале, тем чаще возникают рецидивы в послеоперационном периоде); 2) пожилой возраст больного (у этого контингента больных рецидивные грыжи наблюдаются наиболее часто, что связано, прежде всего, с прогрессирующими дегенеративными изменениями в тканях паховой области: особенно демонстративны в этом отношении результаты исследований Ю.Н. Нестеренко и Ю.Б. Салова (1980), которые представлены в табл. 13); 3) наличие сопутствующих хронических заболеваний, вызывающих резкие колебания внутрибрюшного давления (гипертрофия предстательной железы, стриктура уретры, хронические запоры, хронический бронхит, эмфизема лёгких и т.д.); 4) недостаточное обследование и санация больного перед операцией с оставлением в организме очагов инфекции, которые могут привести к осложнениям послеоперационного периода (хронический тонзиллит, гнойничковые и инфекционные заболевания).
Ко второй группе причин рецидивов относятся: 1) неправильный выбор метода операции, без учёта патогенетических условий образования грыжи и тех изменений в паховом канале, которые возникают у больных с паховыми грыжами (например, укрепление при прямых и рецидивных грыжах только передней стенки пахового канала, оставление расширенного глубокого отверстия пахового канала и высокого пахового промежутка); 2) грубые дефекты оперативной техники (недостаточный гемостаз, недостаточно высокое выделение грыжевого мешка, просмотр второго грыжевого мешка, соскальзывание лигатуры с культи грыжевого мешка, оставление неушитой поперечной фасции или разрушение её во время операции, сшивание тканей с большим натяжением, подшивание к паховой связке поверхностной фасции вместо апоневроза наружной косой мышцы, подшивание к паховой связке не всей толщи мышц, а лишь поверхностного слоя, недостаточное отделение сшиваемых тканей от жировой клетчатки, повреждение сосудов и нервов). При аллопластических способах операций наиболее частой причиной осложнений является применение пластических материалов, вызывающих высокую тканевую реакцию.
К третьей группе причин рецидивов относятся: 1) воспалительные осложнения со стороны операционной раны (нагноение, инфильтраты, лигатурные свищи); 2) ранняя нагрузка на ещё не сформировавшийся рубец; 3) тяжёлая физическая работа в позднем послеоперационном периоде.
Способ Жирара. Пластика пахового канала производится путем подшивания внутренней косой и поперечной мышц живота к пупартовой связке поверх семенного канатика. Затем к пупартовой же связке подшивают внутренний листок рассеченного апоневроза наружной косой мышцы живота. Поверх него пришивают наружный листок апоневроза, создавая таким образом апоневротическую дупликатуру. Формируют наружное отверстие пахового канала так, что бы оно пропускало кончик пальца (семенной канатик). Накладывают швы на кожу.
Способ Спасокукоцкого. Отличается от способа Жирара тем, что к паховой связке подшиваются одновременно (одним швом) внутренняя косая и поперечная мышцы вместе с внутренним листком апоневроза наружной косой мышцы живота. Затем так же создается дугошкатура из листков апоневроза.
Способ Кимбаровского (швы Кимбаровского) является наи более часто применяемой в клинической практике модификацией операции Жирара-Спасокукоцкого . Суть модификации в использовании при пластике оригинальных швов, обеспечивающих сопоставление однородных тканей. Для этого первый вкол иглы делают, отступя 1 см от края верхнего листка апоневроза. Игла проходит через всю толщу подлежащих мышц и возвращается на переднюю поверхность апоневроза у самого его края. Затем этой же иглой захватывают паховую связку. Остальные швы накладывают таким же образом. При затягивании нитей верхний листок апоневроза подворачивается и прикрывает мышцы. В результате спереди от семенного канатика к паховой связке подшиваются края мышц, окутанных апоневрозом.
Способ Мартынова. Этапы операции такие же, как при способе Жирара. Пластику производят путем подшивания внутреннего листка апоневроза косой мышцы живота к пупартовой связке с последующим формированием дупликатуры из апоневроза.
Прямая паховая грыжа. Клиническая картина. Диагностика. Дифференциальный диагноз. Методы операций. Скользящая грыжа: особенности строения и хирургической техники.
Важной анатомо-физиологической предпосылкой для образования прямых паховых грыж являются возрастные атрофические процессы в мышцах, апоневрозах, связочном аппарате и нервных волокнах. Паховый промежуток при этом увеличивается, и клапанная функция мышц отсутствует, что объясняет факт довольно частого образования двусторонних паховых грыж у стариков.
Грыжевой мешок при прямой паховой грыже округлой формы покрыт слоем предбрюшинной клетчатки и резко растянутой поперечной фасцией. По отношению к семенному канатику он располагается кнутри, легко отделяется от него во время операции. Паховый промежуток всегда высокий. Передняя стенка канала растягивается грыжевым выпячиванием. Постепенно расширяется и наружное паховое отверстие. Прямая паховая грыжа редко достигает больших размеров, этому препятствуют поперечная фасция и апоневроз наружной косой мышцы живота.
Таким образом, при прямой паховой грыже наблюдается, прежде всего, недостаточность задней стенки пахового канала, которая может касаться или всей стенки, или её части.
Прямая паховая грыжа начинается с выпячивания в апоневрозе поперечной мышцы живота в задней стенке пахового канала - в треугольнике Гессельбаха. После начала выпячивания постепенно начинает изгибаться апоневротическая дуга. Грыжевые ворота начинают увеличиваться прежде всего вверх, так как снизу и медиально они ограничены плотными апоневротическими структурами.
Способ Бассини. Это классический способ укрепления задней стенки пахового канала, имеющий множество модификаций. Восстановление ослабленной задней стенки при этом способе достигается путем подшивания под семенным канатиком внутренней косой и поперечной мышц вместе с поперечной фасцией живота к паховой связке. Семенной канатик укладывается на образованную мышечную стенку. Края апоневроза наружной косой мышцы живота сшиваются над семенным канатиком край в край). Метод Бассини в клас сическом варианте редко применяется в клинической практике. Слабым местом этой операции считается сопоставление швами разнородных тканей: захваченные в шов мышцы со временем могут атрофиро ваться и рубцово перерождаться.
Способ Кукуджанова . При этом способе операции укрепление задней стенки пахового канала производится: а) в медиальном отделе пахового промежутка путем подшивания наружного края влагалища прямой мышцы живота к верхней лобковой (Куперовой) связке 3-4 швами; б) в латеральном отделе к паховой связке подшивают соединенное сухожилие внутренней косой и поперечной мышц живота вместе с краями рассеченной поперечной фасции. Апоневроз наружной косой мышцы живота сшивают дупликатурой над семенным канатиком. Достоинством этой операции является не только механическое укрепление задней стенки пахового канала, но и уменьшение пахового промежутка с восстановлением клапанной функции пахового канала.
Способ Постемпского. Этот способ герниопластики заключается в полной ликвидации пахового канала, пахового промежутка и в создании пахового канала с совершенно новым направлением. К лобково-подвздошному тяжу и пупартовой связке подшивают четыре анатомических слоя: апоневроз наружной косой мышцы живота, внутреннюю и поперечную мышцы, поперечную фасцию, захватывая их в один шов. В первые медиальные швы захватывают край влагалища прямой мышцы живота, подшивая его к верхней лоб ковой связке. Под семенным канатиком формируется и дупликатура из листков апоневроза наружной косой мышцы живота. Вновь созданный «паховый канал» с семенным канатиком должен проходить через мышечно-апоневротический слой в косом направлении так, чтобы его наружное отверстие находилось несколько латеральное по отношению к внутреннему отверстию. Семенной канатик укладывают на апоневроз и над ним сшивают подкожную клетчатку и кожу.
Скользящие грыжи. Скользящими грыжами называются грыжи, в которых одной из стенок грыжевого мешка является орган, частично покрытый брюшиной. Скользящие грыжи составляют около 1,5% всех паховых грыж. По механизму возникновения они могут быть врожденными и приобретенными. Больные при скользящих грыжах могут жаловаться на запоры, боли в животе во время дефекации, дизурические расстройства. Наличие этих симптомов требует дополнительного обследования с проведением ирриго скопии, цистографии, бимануального гинекологического исследования у женщин
Диагностика скользящих паховых грыж до операции очень важна, так как определяет действия хирурга во время операции, исключая случайное ранение органов. Наличие скользящей грыжи следует предполагать в следующих случаях: 1) при длительно существующих грыжах больших размеров с широкими грыжевыми воротами; 2) при многократно рецидивирующих грыжах, когда нередко происходит разрушение задней стенки пахового канала; 3) при наличии жалоб больного, характерных для соскальзывания того или иного органа; 4) при частичной или полной невправимости грыжи; 5) когда при пальпации грыжевого мешка (после вправления содержимого) определяется тестоватость консистенции; иногда грыжевое выпячивание состоит как бы из двух частей, одна из которых более утолщена; 6) когда наблюдается мочеиспускание в два приёма (при скользящих грыжах мочевого пузыря вначале больной опорожняет мочевой пузырь, а затем, после вправления грыжи, у него появляется новый позыв к мочеиспусканию).
При подозрении на наличие скользящей грыжи целесообразно применить дополнительные методы исследования: ирригоскопию, цистографию, цистоскопию, бимануальное гинекологическое исследование. Если возникла мысль о вовлечении в процесс мочеточника или почки, то необходимо произвести инфузионную урографию.
Важные дополнительные сведения о грыже даёт УЗИ. И.В. Бобковой и В.В. Божко (1999) разработана методика УЗИ, позволяющая визуализировать основные анатомические структуры паховой области: отличить косую грыжу от прямой, высоту пахового промежутка, размеры поверхностного и глубокого отверстий, характер содержимого грыжевого мешка при невправимой грыже.
В.В. Кисляковым (2002) разработана методика УЗИ диагностики скользящих грыж, а также определения характера предыдущей операции при рецидивных и многократно рецидивировавших грыжах.
Паховые грыжи, Грыжесечение по Кукуджанову. Отношение связки Купера к пупартовой . Грыжесечение по Мартынову.
Последовательность операции по поводу паховой грыжи однотипна при различных методах и состоит из следующих этапов:
Первый этап - формирование доступа к паховому каналу. Обнажение пахового канала достигается разрезом кожи, производимой параллельно паховой связке и выше ее на 2 см длиной около 10-12 см. Соответственно ране рассекается апоневроз наружной косой мышцы живота и обнажается пупартова связка.
Второй этап - выделение из окружающих тканей и удаление грыжевого мешка. Прошивание шейки мешка перед его отсечением производят или снаружи, или изнутри кисетным швом, но обязательно под контролем глаза.
Третий этап - ушивание глубокого пахового отверстия до нор мальных размеров (0,6-0,8 см) при его расширении или разрушении.
Четвертый этап операции - пластика пахового канала.
Способ Кукуджанова . При этом способе операции укрепление задней стенки пахового канала производится: а) в медиальном отделе пахового промежутка путем подшивания наружного края влагалища прямой мышцы живота к верхней лобковой (Куперовой) связке 3-4 швами; б) в латеральном отделе к паховой связке подшивают соединенное сухожилие внутренней косой и поперечной мышц живота вместе с краями рассеченной поперечной фасции. Апоневроз наружной косой мышцы живота сшивают дупликатурой над семенным канатиком. Достоинством этой операции является не только механическое укрепление задней стенки пахового канала, но и уменьшение пахового промежутка с восстановлением клапанной функции пахового канала.
Способ Мартынова. Этапы операции такие же, как при способе Жирара. Пластику производят путем подшивания внутреннего листка апоневроза косой мышцы живота к пупартовой связке с последующим формированием дупликатуры из апоневроза.
Бедренные грыжи. Анатомия бедренного канала. Клиника. Диагностика. Дифференциальный диагноз. Методы операций.
Бедренными называют грыжи, которые выходят через бедренный канал. По частоте образования они составля ют 5-8% от всех грыж живота. Бедренные грыжи чаще наблюдаются у женщин (5:1), что обусловлено анатомическими особенностями строения таза у них. Врожденных бедренных грыж не бывает, так как бедренного канала как анатомического образования, в отличие от пахового канала, не существует.
По расположению бедренной грыжи различают следующие ее разновидности: мышечно-лакунарную, предсосудистую, сосудисто- лакунарную, гребешковую. Наиболее частой, типичной, является сосудисто-лакунарная ее разновидность, при которой грыжа выходит из брюшной полости между жимбернатовой связкой и бедренными сосудами. Грыжевой мешок, выйдя из-под пупартовой связки, располагается в овальной ямке кнутри от бедренной вены и кпереди от горизонтальной ветви лобковой кости.
Клиника и диагностика. Бедренные грыжи чаще, чем паховые, представляют трудности для диагностики, чаще ущемляются и имеют более коварное течение. Грыжи этой локализации характеризуются небольшой (размерами с орех) припухлостью, расположенной ниже пупартовой связки в зоне овальной ямки бедра. Больные обычно жалуются на боли в паху с иррадиацией в ногу, диспептические расстройства. При скользящих грыжах мочевого пузыря могут отмечаться дизурические расстройства. Нередко первым клиническим проявлением бедренной грыжи является ее ущемление.
Дифференциальная диагностика. Бедренную грыжу дифференцируют с паховой грыжей, липомой, располагающейся под пупартовой связкой, лимфаденитом, метастазами опухоли в лимфатические узлы, натечным абсцессом при туберкулезе позвоночника, варикозным узлом большой подкожной вены в овальной ямке, аневризмой бедренных сосудов.
Лечение. Склонность бедренной грыжи к ущемлению диктует необходимость ее оперативного лечения возможно раньше. Предложено более 100 способов операций для устранения бедренных грыж, которые в зависимости от доступа к грыжевым воротам делят на две группы: бедренные и паховые.
Бедренные способы. Эти способы характеризуются подходом к бедренному каналу со стороны его наружного отверстия. Преимуществом этого доступа является наименьшая травматичность и быстрота выполнения операции, недостатком - наибольшее число рецидивов.
Способ Локвуда. Разрез делают над грыжевым выпя чиванием параллельно и ниже паховой связки. После удаления грыжевого мешка грыжевые ворота закрывают путем подшивания 3-4 швами пупартовой связки в области внутреннего бедренного кольца к надкостнице лонной кости.
Способ Бассини. Пластику осуществляют, как и при предыдущем способе, сшивая пупартову связку с надкостницей лонной кости. Первый шов накладывают рядом с лонным бугорком, последний - на 1 см кнутри от бедренной вены. Затем накладывают дополнительный ряд швов между серповидным краем широкой фасции бедра и гребешковой фасцией, с тем чтобы укрепить наружное отверстие бедренного канала.
Паховые способы. Преимуществами паховых способов являются возможность максимально высокой перевязки и отсечения грыжевого мешка, а также удобное и надежное ушивание внутреннего отверстия бедренного канала. Операции паховым доступом дают меньше рецидивов. К недостаткам их можно отнести большую длительность и техническую сложность выполнения.
Способ Руджи. Разрез делают, как при паховой грыже. Вскрывают паховый канал, поперечную фасцию и в забрюшинной клетчатке, у внутреннего отверстия бедренного канала, тупо выделяют шейку грыжевого мешка. Последний выводят из бедренного канала в рану, вскрывают, прошивают у шейки и удаляют. Грыжевые ворота закрывают путем подшивания паховой связки к куперовской связке. Операция заканчивается восстановлением пахового канала.
Способ Парлавеччио. Этапы операции, как и при способе Руджи. Пластика грыжевых ворот производится путем наложения швов между лонной и паховой связками. Вторым рядом швов подшивают внутреннюю косую и поперечную мышцы к паховой связке.
Пупочные грыжи. Клиника. Диагностика. Дифференциальный диагноз. Методы операций. Особенности лечения пупочных грыж в детском возрасте.
Пупочные и околопупочные грыжи. Пупочными и околопупочными называют такие грыжи, при которых грыжевыми воротами являются дефекты брюшной стенки в области пупка. По происхождению, анатомическим и клиническим признакам, принято различать: 1) эмбриональные пупочные грыжи; 2) пупочные грыжи у детей; 3) пупочные грыжи у взрослых.
Эмбриональные пупочные грыжи относятся к врожденным порокам развития, являясь следствием задержки формирования передней брюшной стенки плода. Грыжевой мешок при этом представляет собой амниотическую оболочку пуповины с покрывающей ее изнутри недоразвитой внутренней оболочкой (предшественницей брюшины).
Пупочные грыжи у детей являются дефектом развития передней брюшной стенки. Возникают они в первые месяцы жизни, чаще у девочек. Расширению пупочного кольца и образованию грыжи способствуют все факторы, вызывающие резкое повышение внутрибрюшного давления. Грыжи у детей обычно небольших размеров.
Пупочные грыжи у взрослых. Пупочные грыжи у взрос лых составляют 3-5% от всех наружных грыж живота. Они возникают преимущественно у женщин старше 40 лет, особенно у многорожав ших и страдающих ожирением. У тучных пациенток образование и постепенное увеличение околопупочных грыж часто сочетается возникновением отвислого живота.
Величина грыжи может быть самой различной - от нескольких сантиметров в диаметре до гигантских. Следует помнить об одной особенности грыж этой локализации: даже при очень больших грыжах грыжевые ворота обычно небольшие и редко достигают более 10 см в диаметре. Это облегчает пластику грыжевых ворот, но вместе с тем предрасполагает к возникновению таких осложнений, как каловые завалы, хроническая непроходимость кишечника, ущемление грыжи.
Диагностика. Небольшие пупочные грыжи могут протекать бессимптомно. При больших грыжах возникают болевые ощущения в области пупка, которые усиливаются после еды и физической нагрузки, появляется запор. Диагностика пупочных грыж несложна и обычно не представляет затруднений. И только при невправимых грыжах небольших размеров существуют определенные трудности в постановке диагноза.
Лечение. Лечение пупочных грыж оперативное. У детей возможно самоизлечение в период 3-6 лет. Если в течение этого срока заращения пупочного кольца не произошло им также показано хирургическое лечение.
При операциях по поводу околопупочных грыж больших размеров необходимо помнить, что быстрое перемещение содержимого грыжевого мешка в брюшную полость может вызвать расстройства дыхания и сердечнососудистой деятельности вследствие значительного повышения внутрибрюшного давления. Таким больным необходима специальная подготовка к операции в виде постепенных нагрузок, связанных с увеличением внутрибрюшного давления (бинтование живота и т.д.).
Основными операциями, которые применяют для лечения пупочных и околопупочных грыж, являются аутопластические методы Лексера, Сапежко и Мейо.
Способ Лексера. Применяется этот способ в основном у детей при небольших грыжах. После удаления грыжевого мешка дефект в апоневрозе ушивается кисетным швом.
Способ Сапежко. Разрез над грыжевым выпячиванием продольный. Грыжевые ворота рассекают вверх и вниз до мест, где белая линия живота суживается и выглядит неизмененной. Брюшину отслаивают ножницами на 2-4 см от задней поверхности влагалища одной из прямых мышц. Затем края рассеченного апоневроза накладывают один на другой и сшивают, создавая дупликатуру из мышечно-апоневротических лоскутов шириной 2-4 см.
Способ Мейо. Двумя поперечными разрезами иссекают кожу вместе с пупком (об удалении пупка больного следует поставить в известность заранее). После иссечения грыжевого мешка грыжевые ворота расширяют в поперечном направлении до внутренних краев прямых мышц живота. Нижний лоскут апоневроза несколькими П-образными швами подшивают под верхний. Край верхнего лоскута затем фиксируется узловыми швами к нижнему в виде дупликатуры
Диастаз прямых мышц живота. Определение понятия. Клиника. Диагностика. Дифференциальный диагноз. Лечение.
Расхождение прямых мышц живота развивается преимущественно в верхнем отделе белой линии, которая от мечевидного отростка до пупка имеет наибольшую ширину по сравнению с участком ее ниже пупка. Благоприятствуют расхождению прямых мышц живота врожденная слабость брюшной стенки, растяжение и истончение белой линии в связи с перенапряжением ее. Особо выделяются диастазы, развивающиеся одновременно с грыжами белой линии и большими пупочными, а также после операций, проведенных с рассечением белой линии в продольном направлении как выше пупка, так и ниже. Размеры выпячивания при диастазе и края его хорошо определяются при осмотре больного в положении лежа. Приподнятие головы и туловища сопровождается характерным для диастаза выпячиванием, которое обычно не сопровождается болевыми ощущениями. При ощупывании хорошо определяются края влагалищ прямых мышц. При значительном расхождении прямых мышц живота одновременно наблюдаются и функциональные изменения всей брюшной стенки с ослаблением брюшного пресса, атрофическими процессами в мышцах, истончением апоневрозов.
Нарушение внутрибрюшного равновесия сопровождается опущением органов брюшной полости, в связи с чем при значительном расхождении прямых мышц выявляется клиника спланхоптоза. Ширина расхождения прямых мышц больше выражена на середине расстояния между мечевидным отростком и пупком.
В основном больные жалуются на боли в животе, диспепсические явления, ощущение тяжести в животе, метеоризм, запоры, затрудненную ходьбу.
По данным Б. А. Баркова (1958), обследовавшего 81 больную с так называемыми чистыми диастазами без сопутствующих грыж белой линии, 54 больные предъявляли жалобы на отрыжку, изжогу, тошноту, рвоту, ощущения тяжести в животе, метеоризм, запоры. При рентгенологическом обследовании 150 больных с диастазами прямых мышц живота было обнаружено, что у 84,7 % желудок располагался на уровне гребешковой линии и ниже. Понижение кислотности желудочного сока наблюдалось у 56,2 % больных.
В связи с отсутствием типичных грыжевых ворот при расхождении прямых мышц ущемления органов брюшной полости не наблюдается.
Показания к операции по поводу расхождения прямых мышц должны ставиться весьма ограниченно после всестороннего обследования больного и перспективной оценки ближайших и отдаленных результатов операции. Из операций, проводящихся без вскрытия влагалища прямых мышц, анатомически обоснована методика А. В. Мартынова. Эллипсовидным разрезом иссекают избыток кожи. Апоневроз наружной косой мышцы обнажают в обе стороны. На всем протяжении диастаза рассекают апоневроз на 1 см от края влагалища левой прямой мышцы живота и вскрывают брюшную полость. Образуются два неодинаковых брюшинно-апоневротических лоскута; края их захватывают несколькими зажимами, оттягивают в стороны. Края влагалищ прямых мышц выступают; начиная сверху, на края влагалищ накладывают ряд швов. Таким образом, прямые мышцы сближают до соприкосновения без вскрытия их влагалищ. Свободный край апоневроза у влагалища правой прямой мышцы накладывают спереди и пришивают на всем протяжении разреза к апоневрозу влагалища левой прямой мышцы
При диастазе прямых мышц применима операция Н. И. Напалкова без вскрытия брюшины со сшиванием в два этажа рассеченных краев влагалища прямых мышц живота . Целесообразно в некоторых случаях при диастазе применить метод наложения швов по Кунцу (1962), при котором тесно сближаются края растянутой белой линии и натяжение после операции распределяется равномерно .
Грыжи белой линии живота: клиника, диагностика, дифференциальный диагноз, методы операций.
В белой линии живота имеются щелевидные промежутки, через которые проходят сосуды и нервы, связующие предбрюшинную клетчатку с подкожной. Эти щели и являются местами выхода грыж. Типичным местом локализации грыж является верхняя часть белой линии, поэтому эти грыжи называют еще эпигастральными. Реже встречаются грыжи околопупочные и подчревные. Грыжи белой линии составляют 3-4% от всех наружных грыж живота.
Формирование грыжи белой линии живота начинается с проникновения предбрюшинной клетчатки в щели апоневроза с образованием так называемой «предбрюшинной липомы». Сдавление этого образования может обусловливать возникновение выраженного болевого синдрома, напоминающего клиническую картину некоторых заболеваний органов брюшной полости - язвенной болезни, холецистита, панкреатита и др. С течением времени вслед за жировой клетчаткой в апоневротическую щель выпячивается брюшина и формируется истинная грыжа. Содержимым грыж белой линии чаще всего бывает сальник, реже - петли тонкой и стенка поперечноободочной кишок.
Клиника и диагностика. Грыжи белой линии живота могут протекать бессимптомно. Чаще больные отмечают боли в эпигастральной области, усиливающиеся при пальпации, натуживании или после еды. Нередки диспептические расстройства (тошнота, изжога, запоры), что вызывает необходимость комплексного обследования иольных.
Наличие вправимого или невправимого выпячивания по белой линии, увеличивающегося при натуживании, позволяет обычно правильно поставить диагноз. У лиц с выраженной подкожно-жировой клетчаткой возникают определенные трудности в обнаружении грыжевого выпячивания.
Эпигастральным грыжам часто сопутствует расхождение (дчастаз) прямых мышц живота. Определение величины этого расхождения производят на середине расстояния между мечевидным отростком и пупком. Различают три стадии диастаза прямых мышц живота: I ст. - до 5-7 см, II ст. - более 7 см, III ст. - большой диастаз в сочетании с отвислым животом.
Дифференциальный диагноз грыж белой линии живота следует проводить с язвенной болезнью желудка и двенадцатиперстной кишки, гастритом, холециститом, панкреатитом, аппендицитом. Для исключения упомянутых заболеваний необходимо детальное лабораторное и рентгенологическое исследование желудочно- кишечного тракта. Лечение оперативное. Для устранения грыж белой линии живота применяются те же методы операций, что и для лечения пупочных и околопупочных грыж (способы Сапежко и Мейо). При сопутствующем грыже расхождении прямых мышц живота производят дупликатурную перестройку белой линии от мечевидного отростка до пупка (способы апоневротической пластики Напалкова или Мартынова).
Способ Напалкова. После удаления грыжевого мешка края апоневроза сшиваются край в край. Затем рассекают влагалища прямых мышц живота вдоль по внутреннему краю и сшивают сначала внутренние, а затем наружные края разрезов апоневротиче ского влагалища.
Послеоперационные грыжи живота (вентральные). Причины, клиника, диагностика. Осложнения. Методы операций. Ущемление в грыжевом мешке.
Грыжа послеоперационная (hernia postoperative) является грыжей живота, выходящей через дефект послеоперационного рубца.
В группу послеоперационных грыж объединены выпячивания брюшной стенки после произведенных рассечений ее в связи с заболеваниями или повреждениями органов брюшной полости, травмы или ранения брюшной стенки. Послеоперационной грыже присущи все элементы грыжи: грыжевые ворота, грыжевой мешок, грыжевое содержимое (выпадающие внутренности) и покрывающие мешок наружные ткани. Основной особенностью является образование ее в области послеоперационного рубца. С этой точки зрения термин «вентральная грыжа» менее точно определяет существо патологии.
Послеоперационные грыжи наблюдаются в тех анатомических областях, где обычно проводятся разрезы для доступа к органам брюшной полости. При огнестрельных ранениях и других проникающих повреждениях живота они могут локализоваться на любом участке брюшной стенки.
Частота образования послеоперационных грыж разными авторами указывается неодинаковая и приводимые ими цифры существенно отличаются. Важно иметь в виду, что наиболее часто грыжа появляется после косых и поперечных разрезов брюшной стенки, когда значительно нарушается целостность мышечно-апоневроти-ческих структур.
Формирование послеоперационной грыжи обусловлено многими факторами. Основными из них являются неадекватный выбор хирургического доступа, нагноение послеоперационной раны, эвентрация и наличие предрасполагающих причин.
Неадекватность выбора операционного доступа состоит в том, что лапаротомия производится без учета анатомо-физиологических условий. Разрез передней брюшной сТенки в этих случаях вызывает существенные нарушения кровообращения и иннервации тканей с последующими стойкими изменениями в них. Причинами, предрасполагающими к развитию послеоперационных грыж, служат истощение, авитаминоз, гипопротеинемия, сопутствующие заболевания (сахарный диабет, ожирение и др.), повышение внутрибрюшного давления в результате пареза кишечника, кашля, ранних физических нагрузок и т. д.
Классификация. В практической деятельности наиболее приемлемым является деление послеоперационных грыж по локализации, величине дефекта брюшной стенки и выпячивания. В особую группу выделяются послеоперационные рецидивные грыжи.
В зависимости от локализации различают срединные (верхние и нижние) и боковые (верхние, нижние, лево- и правосторонние). По величине выделяют малые, большие и громадные. К рецидивным относят повторные (многократные) рецидивы.
Основным симптомом заболевания является наличие выпячивания (деформации) в области послеоперационного рубца. Наиболее часто оно возникает в первые 6 месяцев после операции. Болевые ощущения не являются характерными признаками, хотя они могут сопровождать формирование грыжи. Боль, как правило, не бывает сильной. Чаще больные испытывают неприятное чувство в виде «выпирания» внутренностей или тяжести, особенно при физической нагрузке. В зависимости от органа, входящего в грыжевой мешок, они могут отмечать диспептические явления (отрыжка, тошнота, запор). При послеоперационной грыже, располагающейся над лобком, больные иногда жалуются на расстройство мочеиспускания.
Грыжевое выпячивание на ранних стадиях развития является вправимым и практически не ограничивает трудовую активность больного. С развитием заболевания выпячивание не только увеличивается, но и может стать частично или полностью невправимым. В грыжевом мешке могут находиться почти все органы брюшной полости. Эти изменения способствуют увеличивающемуся ослаблению всей брюшной стенки. Происходит растяжение прямых мыщц живота. Растянутый рубец истончается, развиваются воспалительные изменения вплоть до образования эрозии и язв, через брюшную стенку можно увидеть перистальтику петель кишечника. Резко снижается активность больных, развиваются явления спланхоптоза. Постепенно заболевание отягощается не только значительными нарушениями функции желудочно-кишечного тракта, но и развитием существенных изменении в сердечно-сосудистой системы. Выпячивание особенно хорошо заметное при натуживании, кашле и в положении стоя. Небольшие выпячивания лучше определяются в лежачем положении больного при активном поднимании им головы и верхней части туловища без опоры на локти
Лечение послеоперационных грыж может быть только оперативным При определении показании к операции и сроках ее проведения следует учесть те обстоятельства, что грыжи имеют тенденцию к постоянному увеличению. Хирургическое лечение послеоперационных грыж брюшной стенки производят различными способами.
При небольших грыжах в ранние сроки благоприятные результаты обеспечивает простое восстановление анатомических соотношений. При этом необходимо иметь в виду, что, независимо от размера грыжи, следует тщательно выделить края грыжевого отверстия, а брюшину ушить после удаления грыжевого мешка. Для закрытия дефекта брюшной стенки лучшим пластическим материалом являются собственные ткани, а оптимальным способом их использования — метод создания дупликатуры за счет фасциально-апоневротических образований в области грыжевых ворот.
Небольшие послеоперационные грыжи можно оперировать под местным обезболиванием по А. В. Вишневскому.
Операция при больших длительно существующих грыжах представляет особые трудности, во-первых, из-за возможной необходимости проведения дополнительных вмешательств по ликвидации сращений содержимого грыжи с грыжевым мешком и, во-вторых, из-за необходимости особых восстановительных манипуляций по устранению больших дефектов брюшной стенки.
Техника операции при этих грыжах сложна и требует специального опыта их проведения. Даже иссечение кожного рубца при истонченных грыжевых оболочках требует самых осторожных действий хирурга, чтобы случайно не повредить внутренние органы. Не меньшие трудности в этом отношении возникают и при высвобождении сальника, петель кишечника из грыжевого мешка. Выраженный спаечный процесс, фиксирующий органы между собой и брюшной стенкой, может значительно изменить топографо-анатомические взаимоотношения. Эти трудности существенно возрастают при наличии многокамерного грыжевого мешка.
Для закрытия больших грыжевых дефектов применяют методы аутопластики, аллопластики и методы комбинированной (сочетанной) пластики. Такие операции по восстановлению целостности брюшной стенки - особый раздел в хирургии послеоперационных грыж, который, несмотря на достижение заметных успехов, все еще находится на стадии поисков.
В восстановительной хирургии основным методом остается аутопластическии -использование тканей самого больного. Наиболее широкое Распространение получила Фасциально-апоневротическая пластика. В трудных ситуациях, прежде всего при атрофически измененных тканях, когда даже формирование дупликатуры не ведет к сколько-нибудь существенному укреплению стенки живота или ее (дупликатуру) невозможно создать, для закрытия дефекта брюшной стенки используется лоскут широкой фасции бедра.
В последние годы достаточно широкое распространение нашел метод аллопласти-ческого закрытия больших грыжевых дефектов. Для этой цели используют различные материалы (лавсан, тефлон, капрон, тантал и др.). Применение сеток из синтетической ткани или танталовых нитей упрощает оперативное вмешательство, делает его менее травматичным и продолжительным и, тем самым, более безопасным.
Основное достоинство аллопластики в том, что этот метод почти незаменим в случаях, когда имеется обширный дефект в мышечно-апоневротических структурах, а ткани почти не дифференцируются, и закрыть дефект ими не удается. Аллопластика является также методом выбора при повторных рецидивах послеоперационных грыж.
По мнению многих хирургов, наиболее целесообразным представляется метод комбинированной (сочетанной) пластики с максимальным использованием тканей больного, вплоть до рубцово-измененных. Имплантированный между слоями рубцово-измененных тканей аллопластический материал может быть применен как каркас. При этом уменьшается натяжение сшиваемых тканей и, следовательно, улучшаются условия для их срастания. Этому в немалой степени способствует общее обезболивание и релаксация мышц передней брюшной стенки.
Осложнения грыж живота: воспаление, невправимость, копростаз, ущемление, травма. Определение понятия. Клиника, диагностика, дифференциальный диагноз, лечение.
Ущемление - это опасное осложнение грыжи. Развитие его может быть внезапным или постепенным. Под ущемлением грыжи понимают сдавление содержимого грыжи в ее воротах.
Возникает при повышении давления в брюшной полости вследствие необычных физических нагру. зок во время работы, спортивных упражнений и даже при кашле, чихании и т. д. Однако оно может развиться вследствие перекрута, перегиба петли тонкой кишки или другого органа в грыжевом мешке, при переполнении участка кишки, находящегося в грыжевом мешке, каловыми массами.
Невправимая грыжа. Невправимой называют грыжу, содержимое которой невозможно вправить в брюшную полость. Невправимой грыжа становится в результате образования сращений внутренних органов между собой и с грыжевым мешком. Невправимость может быть полной или частичной. Довольно часто невправимые грыжи бывают многокамерными. В отличие от ущемления грыжевое выпячивание при невправимости обычно остается неизмененным по величине и форме, но при натуживании может увеличиваться в объеме. При пальпации невправимая грыжа безболезненна или слабо болезненна, при перкуссии дает тупой звук. Общее состояние больного удовлетворительное.
Копростаз. Копростаз (каловый застой) в грыжевом мешке наблюдается обычно у пожилых и старых больных, склонных к запорам. Способствующими факторами являются ожирение, малоподвижный образ жизни, обильная еда. Явления копростаза развиваются медленно и сопровождаются упорными запорами, болями, тошнотой, общим недомоганием. Грыжевое выпячивание медленно увеличивается, оно почти безболезненно (в отличие от ущемленной грыжи), тестообразной консистенции. Симптом кашлевого толчка определяется, что также свидетельствует об отсутствии ущемления грыжи.
Лечение при копростазе консервативное. Оно заключается в освобождении толстой кишки от содержимого. Это достигается с помощью легкого массажа грыжевого выпячивания, повторных клизм с вазелиновым маслом или с глицерином, опорожнения желудка с помощью зонда. Применение слабительных средств противопоказано, так как возникающее при этом переполнение приводящей петли способствует переходу копростаза в каловую форму ущемления.
Воспаление грыжи. Это осложнение возникает вследствие инфицирования грыжевого мешка. Воспалительный процесс, как правило, начинается со стороны грыжевого содержимого. Однако проникновение инфекции в грыжевой мешок возможно и с кожных покровов, и из брюшной полости. Воспаление грыжи протекает обычно в острой форме и может быть серозным, серозно-фибринозным, гнойным и гнилостным. Реже наблюдается хроническое воспаление (туберкулез грыжи).
Клиническая картина воспаления грыжи характеризуется тем, что процесс возникает остро, сопровождается резкими болями, рвотой, повышением температуры, напряжением и болезненностью в области грыжевого выпячивания, чем напоминает клинику ущемления грыжи. При дифференциальной диагностике этих осложнений грыжи, необходимо иметь в виду, что ущемлению обычно предшествует внезапное повышение внутрибрюшного давления с последующим быстрым нарастанием клинических проявлений острой кишечной непроходимости. При воспалении же грыжи имеются более выраженные воспалительные изменения со стороны крови и в области грыжевого выпячивания.
Лечение воспаления грыжи, если оно вызвано инфицированием со стороны грыжевого содержимого, заключается в срочной операции с удалением источника инфицирования. Если причиной инфицирования грыжи являются воспалительные процессы на кожных покровах, то проводится консервативное лечение.
Ущемленная грыжа. Определение понятия. Виды ущемления. Патологоанатомические и патофизиологические изменения в различных участках (отделах) ущемленного органа. Клиника ущемления. Дифференциальный диагноз.
Под ущемлением грыжи понимают внезапно возникающее сдавление грыжевого содержимого в грыжевых воротах с последующим ишемическим некрозом находящихся в грыжевом мешке органов и тканей. Ущемление - наиболее частое и опасное осложнение грыжи. Оно возникает у 10-15% больных с грыжами. В структуре острых хирургических заболеваний органов брюшной полости ущемленные грыжи занимают 3-4 место и составляют около 4,5%. Среди больных с ущемленными грыжами преобладают лица пожилого и старческого возраста.
С точки зрения механизма возникновения ущемленной грыжи различают два принципиально различных типа ущемления: эластическое и каловое . Возможно также сочетание того и другого
Эластическое ущемление возникает при резком повышении внутрибрюшного давления и внезапном выхождении большего, чем обычно, количества внутренних органов через грыжевые ворота. Вследствие узости грыжевых ворот и возникающего спазма окружающих мышц вышедшие органы не могут вправиться в брюшную полость. Происходит их сдавление (странгуляция), приводящее к ишемии ущемленных органов и нарушению венозного оттока. Возникающий отек грыжевого содержимого способствует еще большему усилению странгуляции.
Каловое ущемление развивается в результате переполнения каловыми массами кишечной петли, находящейся в грыжевом мешке. Ее приводящий отдел растягивается и, увеличиваясь в размерах, начинает сдавливать в грыжевых воротах отводящий отдел этой кишки вместе с прилежащей брыжейкой. В конечном итоге развивается картина странгуляции, подобная той, которая наблюдается при эластическом ущемлении. Для возникновения калового ущемления основное значение имеет не физическое усилие, а нарушение кишечной моторики, замедление перистальтики, что чаще бывает в пожилом и старческом возрасте. Кроме того каловому ущемлению способствуют широкие грыжевые ворота, перегибы и сращения кишки со стенкой грыжевого мешка. В ряде случаев переполнение приводящего отдела кишечной петли, находящейся в грыжевом мешке, сочетается с эластическим давлением со стороны грыжевых ворот, в результате чего развивается смешанное (комбинированное) ущемление.
При ущемлении в грыжевых воротах кишечной петли в ней следует различать 3 отдела: приводящее колено; центральный отдел, находящийся в грыжевом мешке; отводящее колено. Наибольшие патологоанатомические изменения возникают в центральном отделе ущемленной кишечной петли и странгуляционной борозде, образующейся на месте сжатия кишки ущемляющим кольцом.
Вследствие нарушений крово- и лимфообращения в ущемленном органе, длительного венозного стаза происходит пропотевание плазмы в стенку и просвет кишки. Последующая транссудация жидкости из ущемленной кишки в замкнутую полость грыжевого мешка ведет к появлению так называемой «грыжевой воды», которая вначале бывает прозрачной, а затем вследствие пропотевания эритроцитов и инфицирования становится мутно-геморрагической. Постепенно в грыжевом мешке развивается гнойно-гнилостное воспаление, выходящее (при отсутствии своевременного лечения) за пределы грыжевого мешка. Подобное гнойное воспаление грыжевого мешка и окружающих его тканей, развивающееся в поздних стадиях ущемления, получило название флегмоны грыжевого мешка.
При быстром и одновременном сдавлении ущемляющим кольцом и вен, и артерий брыжейки кишки «грыжевая вода» не образуется. Развивается так называемая «сухая гангрена» ущемленной кишки.
При ущемлении страдает не только часть кишки, находящаяся в грыжевом мешке, но и приводящий ее отдел, находящийся в брюшной полости. В нем происходят все те изменения, которые характерны для острой кишечной непроходимости: переполнение содержимым и перерастяжение стенки кишки, развитие гнилостных процессов в ее просвете, транссудация жидкости, пропотевание токсинов и микроорганизмов в свободную брюшную полость, развитие перитонита.
При ущемлении любой грыжи наиболее характерны 4 следующих клинических признака: 1) резкая боль в области грыжевых ворот; 2) невправимость грыжи; 3) напряжение и болезненность грыжевого выпячивания; 4) отсутствие передачи кашлевого толчка.
Боль является главным симптомом ущемления. Она настолько сильна, что больные не могут удержаться от стонов и крика. Нередко наблюдаются явления настоящего болевого шока. Боль возникает в момент физического напряжения и не стихает в течение нескольких часов: до того момента, когда происходит некроз ущемленного органа с гибелью интрамуральных нервных элементов.
Второй признак - невправимость грыжи - имеет большое диагностическое значение при ущемлении свободной грыжи. В этом случае больные отмечают, что ранее вправляемое грыжевое выпячивание перестало вправляться в брюшную полость с момента появления болей.
Напряжение грыжевого выпячивания и некоторое увеличение его размеров сопутствуют ущемлению как вправимой, так и невправимой грыжи. Поэтому данный признак имеет гораздо большее значение для распознавания ущемления, чем сама по себе невправимость грыжи. Диагностическое значение имеет не только напряжение грыжевого выпячивания, но и резкая его болезненность при ощупывании.
Отрицательный симптом кашлевого толчка обусловлен тем, что в момент ущемления грыжевой мешок разобщается со свободной брюшной полостью и становится изолированным образованием. В связи с этим повышение внутрибрюшного давления в момент кашля не передается в полость грыжевого мешка.
Кроме указанных четырех признаков при ущемлении грыжи могут наблюдаться симптомы, обусловленные развитием непроходимости кишечника: рвота, вздутие живота, неотхождение газов и др. При ущемлении мочевого пузыря возникают боли над лобком, дизурические расстройства, микрогематурия.
Дифференциальный диагноз. Дифференцировать ущемление грыжи необходимо: 1) с патологическими состояниями самого грыжевого выпячивания (невправимость, копростаз, воспаление грыжи, «ложное ущемление»); 2) с заболеваниями, не имеющими непосредственного отношения к грыже (паховый лимфаденит, натечный абсцесс, опухоли яичка и семенного канатика, заворот кишок).
Особенности оперативной техники при ущемленной грыже живота. Критерии для определения жизнеспособности ущемленной петли кишки. Лечебная тактика при: сомнительном диагнозе ущемленной грыжи живота; при самопроизвольном вправлении ущемлённой грыжи; при ложном ущемлении.
Хирургическая тактика при ущемленных грыжах. Единственным методом лечения ущемленных грыж является хирургический. Экстренная операция должна выполняться вне зависимости от сроков ущемления, разновидности и локализации грыжи.
Попытки насильственного вправления ущемленной грыжи недопустимы, так как могут привести к тяжелым осложнениям - повреждению грыжевого мешка и его содержимого, кровотечению, перитониту.
Попытка устранить ущемление грыжи без операции допустима лишь в исключительных случаях, когда больные находятся в крайне тяжелом состоянии из-за наличия декомпенсированных сопутствующих заболеваний и с момента ущемления прошло не более 2 часов. Больному делают инъекции атропина, промедола, опорожняют желудок и мочевой пузырь, выполняют очистительную клизму, теплую ванну. Если указанные меры оказываются безуспешными, то больного, несмотря на тяжесть состояния, необходимо оперировать.
В случаях самостоятельного вправления ущемленной грыжи (на дому, во время транспортировки, в приемном отделении) больной должен быть обязательно госпитализирован в хирургический стационар для динамического наблюдения, так как вправившаяся после ущемления кишка может стать источником перитонита или кишечного кровотечения!
Если спонтанное вправление грыжи произошло в поздние сроки после ущемления или у больного при поступлении в стационар выявляются симптомы перитонита или кишечной непроходимости, то показано экстренное оперативное вмешательство. Больному же, у которого при динамическом наблюдении не выявляются признаки каких-либо осложнений, показано грыжесечение в отсроченном (плановом) порядке.
Больной с установленным диагнозом ущемленной грыжи подлежит немедленному оперативному лечению. Организационные и подготовительные мероприятия должны быть предельно короткими и занимать, как правило, не более 1-1,5 часов.
Больные с нерезко выраженными нарушениями гомеостаза и стабильными гемодинамическими показателями не нуждаются в специальной предоперационной подготовке. В запущенных случаях ущемления, осложненных перитонитом, выраженной интоксикацией, показана кратковременная (1,5-2 часа) инфузионная корригирующая терапия (в объеме 20-25 мл на 1 кг массы тела). Основная ее цель - устра нение грубых нарушений в системе кровообращения.
Основные этапы операции при ущемленной грыже такие же, как и при плановом грыжесечении. Однако имеется и ряд принципиальных отличий. Первоочередная задача хирурга при ущемленной грыже - как можно более быстрое обнажение и фиксация ущемленного органа с помощью влажных марлевых салфеток. Только после этого рассекается ущемляющее кольцо и оценивается жизнеспособность ущемленного органа.
Перед вскрытием грыжевого мешка рану необходимо обложить салфетками, так как вскрытие мешка сопровождается изливанием инфицированной грыжевой воды. Само рассечение грыжевого кольца необходимо производить с большой осторожностью, с учетом анатомических взаимоотношений, чтобы не повредить сосудистые или связочные образования вне ущемляющего кольца. При паховой грыже это рассечение апоневроза наружной косой мышцы живота или внутреннего пахового кольца. При бедренной грыже производится рассечение лакунарной (жимбернатовой) связки кнутри от грыжевого мешка. Другие направления рассечения грыжевого кольца при бедренной грыже недопустимы, так как кзади от мешка лежит лонная кость, кнаружи - бедренная вена, а кпереди в зоне паховой связки могут находиться аномально расположенные сосуды. При пупочной грыже ущемляющее кольцо рассекают в поперечном или продольном направлении в обе стороны.
После рассечения грыжевого кольца ущемленный орган (чаще всего кишка) осторожно подтягивается в рану с целью обследования и выяснения его жизнеспособности. Это один из наиболее ответственных этапов операции.
Определение жизнеспособности ущемленной петли кишки не всегда просто. Предложенные для этого объективные методы (измерение температуры и электропроводимости кишечной стенки, трансиллюминация, интрамуральная ангиотензометрия и пульсомоторография) не нашли широкого распространения. В повседневной клинической практике для определения жизнеспособности кишки, освобожденной от сдавления, руководствуются ее внешним видом. При этом оцениваются: 1) цвет кишки; 2) пульсация сосудов ее брыжейки; 3) наличие перистальтики на измененном отрезке кишки.
Жизнеспособная кишка быстро принимает нормальный вид, становится розовой, серозная оболочка - блестящей, перистальтика отчетливой, брыжейка неотечна, сосуды пульсируют. Перед вправлением кишки в брюшную полость в ее брыжейку следует ввести 100-150 мл 0,25% раствора новокаина.
Бесспорными признаками нежизнеспособности кишки и абсолютным показанием к ее резекции являются: темная окраска кишки, тусклая серозная ее оболочка, дряблая стенка, отсутствие перистальтики кишки и пульсации сосудов брыжейки, наличие грубых изменений в области странгуляционной борозды.
Резекция кишки независимо от протяженности измененного ее участка должна производиться в пределах безусловно здоровых тканей. Такие меры, как инвагинация швами сомнительных участков кишки или странгуляционной борозды являются порочными и долж ны быть исключены из арсенала хирурга. Кроме измененного участка кишки подлежат резекции не менее 40 см неизмененного приводящего и не менее 15-20 см отводящего отрезков кишки. Если после пересечения кишки обнаруживаются изменения со стороны ее слизистой оболочки, объем резекции расширяют в пределах здоровых тканей. Анастомоз между приводящим и отводящим отделами кишки предпочтительнее накладывать «конец в конец». Анастомоз «бок в бок» функционально менее выгоден, но в условиях кишечной непроходимости более безопасен. Пластика грыжевых ворот производится в соответствии с видом грыжи.
Термином «ложное ущемление» обозначают такие ситуации, когда у больного с грыжей при каком-либо остром заболевании органов брюшной полости (аппендицит, холецистит, панкреатит, перфорация полого органа) развивается симптомокомплекс, напоминающий общую картину ущемления. Это обусловлено скоплением воспалительного экссудата брюшной полости в грыжевом мешке, в результате чего грыжевое выпячивание становится болезненным и трудновправимым. Если в этом случае операция будет ограничена грыжесечением, а причина перитонита и «ложного ущемления» не будет распознана и устранена, то больной погибнет в результате диагностической ошибки.
Мнимое вправление ущемленной грыжи живота. Показания и принципы резекции кишечника. Тактика при сомнительной жизнеспособности практически всей ущемленной тонкой кишки. Хирургическая тактика при флегмоне грыжевого мешка.
Результатом попыток насильственного вправления ущемленной грыжи является и так называемое мнимое или ложное вправление. Под мнимым вправлением понимается вправление грыжевого содержимого в брюшную полость или в предбрюшинную клетчатку вместе с ущемляющим кольцом. В таких случаях типичный для ущемления признак в виде напряженного грыжевого выпячивания исчезает. Однако наличие резкой болезненности при исследовании в зоне грыжи, а также анамнестические сведения об имевших место попытках насильственного вправления позволяют установить факт «мнимого» вправления. Такой больной должен быть подвергнут срочному оперативному вмешательству.
При вправлении грыжи во время обезболивания или операции необходимо принять все меры для осмотра ущемленного органа через герниолапаротомную рану. Если орган не обнаружен и имеются сомнения в его жизнеспособности, то показана срединная лапаротомия или интраоперационная лапароскопия через грыжевой мешок.
При осложнении флегмоной ущемленной паховой или бедренной грыжи операцию выполняют в два этапа.
Операция начинается с нижней срединной лапаротомии. Во время ревизии устанавливается, какой орган ущемлен. Если это сальник, то производится резекция его. Если это ущемленная кишечная петля, то выполняют ее резекцию в пределах здоровых тканей, а затем накладывают межкишечный анастомоз. Пересеченные концы кишки, идущие к грыжевому кольцу, ушивают наглухо. После санации брюшной полости лапаротомная рана ушивается (первый этап операции). Только после этого делается рассечение тканей над грыжевым выпячиванием и вскрытие флегмоны. Омертвевшую петлю кишки убирают со стороны раны. Брюшина ушивается, а рана дренируется. Пластика грыжевых ворот производится в плановом порядке, после эпителизации гнойной раны.
При ущемленной пупочной или околопупочной грыжи, осложненной флегмоной, выполняют операцию по способу Грекова. Суть этого способа состоит в следующем: окаймляющим поперечным разрезом вокруг грыжевого выпячивания производят рассечение всех слоев брюшной стенки, включая брюшину, и таким образом высекают единым блоком ущемленную грыжу в пределах здоровых тканей. Войдя в брюшную полость, пересекают ущемленный орган прокси мальнее странгуляции и удаляют грыжу целиком, не вскрывая ее. Если была ущемлена кишка, то между ее приводящим и отводящим отделами накладывают анатомоз. Производят пластику грыжевых ворот.
Грыжи пищеводного отверстия диафрагмы. Классификация. Клиника, диагностика, дифференциальный диагноз. Осложнения. Принципы консервативного лечения. Показания к оперативному лечению. Методы операций.
Грыжа пищеводного отверстия диафрагмы или диафрагмальная грыжа возникает, если через пищеводное отверстие диафрагмы (отверстие, через которое пищевод из грудной полости проникает в брюшную) брюшная часть пищевода, часть желудка или брюшная часть пищевода вместе с частью желудка смещается в грудную полость. Иногда через пищеводное отверстие диафрагмы в грудную полость могут смещаться и другие органы, расположенные в полости живота.
Единой общепринятой классификацией грыж пищеводного отверстия диафрагмы нет. Распространено деление грыж по Akerlund (1926) на три типа: I тип — грыжи пищеводного отверстия с врожденным укорочением пищевода; II тип — параэзофагеальные грыжи и III тип — грыжи с внутригрудным положением кардии и пищеводом нормальной длины.
Если исключить из классификации, предложенный Akerlund, I тип, как не являющийся в подлинном смысле слова грыжей, то все остальные формы грыж пищеводного отверстия диафрагмы можно разделить на параэзофагеальные и аксиальные (осевые), соответствующие III типу
Классификация Б. В. Петровского и Н. П. Каншина (1966) исходит из основных принципов классификации Akerlund, но основывается на названии отделов пищеварительного канала, принимающих участие в грыжеобразовании. В соответствии с этой классификацией различают следующие формы скользящих (аксиальных) грыж: 1) кардиальную, 2) кардиофундальную, 3) субтотальную желудочную, 4) тотальную желудочную без укорочения пищевода и 5) с укорочением пищевода.
Аксиальные грыжи составляют 80—90% всех грыж пищеводного отверстия. Параэзофагеальные грыжи встречаются значительно реже, но в отличие от аксиальных обладают большей наклонностью к ущемлению, поэтому имеют особое клиническое значение.
Клиническая симптоматика грыж пищеводного отверстия диафрагмы довольно неопределенна и многообразна, что часто ведет к ошибочной диагностике. У значительной части больных грыжа протекает бессимптомно и обнаруживается лишь во время рентгенологического исследования по другому поводу.
Жалобы в основном бывают обусловлены недостаточностью кардии и вторично развивающимся рефлюкс-эзофагитом. Больные отмечают изжогу, жжение и боли за грудиной, срыгивания, дисфагию. Симптомы усиливаются в горизонтальном положении, особенно вскоре после еды или усилий, повышающих брюшное давление (наклоны вниз, подъем тяжести, кашель). Боли в области сердца могут симулировать стенокардию, инфаркт миокарда.
Основным признаком аксиальной грыжи является наличие в области пищеводного отверстия диафрагмы типичных складок слизистой оболочки желудка, которые продолжаются непосредственно в складки поддиафрагмальной части желудка. Другим обязательным признаком аксиальной грыжи служит смещение кардиального отдела желудка выше диафрагмы.
Грыжевая часть желудка образует округлое или неправильной формы выпячивание с ровными или зазубренными контурами, что связано с поперечным ходом складок слизистой оболочки желудка. Это выпячивание широко сообщается с желудком. Иногда на контуре пролабировавшей части желудка видны симметричные втяжения — «кардиальные зарубки», которые отделяют преддверие от кардиального отдела желудка.
Пищевод при аксиальной грыже способен частично инвагинировать в желудок, что проявляется симптомом «венчика», или «воротника». Сходную картину образует также соскальзывание слизистой оболочки пищевода в желудок. При большой аксиальной грыже грудной отдел пищевода искривляется, главным образом в его дистальной трети. Если грыжа не фиксирована, то при переводе больного из горизонтального в вертикальное положение можно видеть обратное проскальзывание свода и кардиального отдела желудка через пищеводное отверстие в брюшную полость.
Степень подвижности грыжи устанавливают как в процессе проб с повышением брюшного давления, так и путем сравнения снимков, сделанных в горизонтальном положении больного (с натуживанием) со снимками пищеводно-желудочного перехода в вертикальной позиции пациента.
Нефиксированную аксиальную грыжу при рентгенологическом исследовании в вертикальном положении больного, как правило, обнаружить не удается.
Наиболее затруднительно распознавание небольших аксиальных грыж. О наличии такой грыжи можно с уверенностью говорить лишь в случае обнаружения трех кольцевидных перетяжек в области пищеводно-желудочного перехода, которые лучше всего заметны при исследовании больного в горизонтальном положении в момент глубокого вдоха.
Верхняя перетяжка соответствует входу в желудочно-пищеводное преддверие, вторая представляет собой кардиальный сфинктер, а третья перетяжка на смещенной в грудную полость части желудка отделяет ее от внутрибрюшной и соответствует уровню расположения грыжевых ворот.
Существует также ряд косвенных признаков грыжи пищеводного отверстия: отсутствие или необычно малый размер газового пузыря желудка и искривление наддиафрагмального отдела пищевода. Обнаружение каждого из этих признаков требует целенаправленного поиска прямых симптомов грыжи пищеводного отверстия.
Диагностика параэзофагеальных грыж обычно не сложна, так как они чаще фиксированы и заметны даже при вертикальном положении больного. В горизонтальном положении они увеличиваются еще больше. Выступающий в грудную полость свод желудка перекрывает кардиальную часть пищевода, которая лучше всего видна при исследовании в косых проекциях. Для параэзофагеальных грыж характерно фиксированное расположение кардии на уровне пищеводного отверстия диафрагмы или под диафрагмой.
Наиболее типичным осложнением грыж пищеводного отверстия является рефлюкс-эзофагит, поэтому выявлению желудочно-пищеводной регургитации в процессе рентгенологического исследования следует придавать особое значение.
Язвы и эрозии слизистой оболочки пищевода, развивающиеся в результате рефлюкс-эзофагита, ведут к появлению на контуре пищевода ниши или стойкого депо бария на рельефе слизистой оболочки.
Длительной текущий эзофагит у больных грыжей может вызывать образование рубцовой стриктуры и укорочения пищевода, что не следует смешивать с первичным врожденным коротким пищеводом.
В участке пищеварительного канала, образующего грыжу, могут развиваться раковые опухоли, диагностика которых основывается на свойственной им симптоматике. Первично развивающийся в кардиальном отделе рак может способствовать укорочению пищевода и вторичному образованию грыжи.
Аксиальные грыжи в первую очередь следует дифференцировать с наличием ампулы пищевода, имеющей сходную картину, но исчезающей на выдохе. Облегчают правильную диагностику обнаружение трех отмеченных ранее кольцевидных зарубок на контурах пищевода и желудка, характерная для ампулы активная сокращаемость, регистрируемая во время просвечивания и документируемая рентгенокинематограммой или видеозаписью рентгенотелевизионного изображения.
Выраженные параэзофагеальные грыжи обычно не вызывают диагностических трудностей, небольшие же могут иметь сходство с эпифренальными дивертикулами. Заполнение мешкообразного выпячивания во время проглатывания контрастной массы свидетельствует в пользу дивертикула, тогда как заполнение его за счет ретроградного заброса из желудка, возникающее при переводе больного в горизонтальное положение, наклоне, натуживании, более свойственно грыже.
Осложнением грыжи пищеводного отверстия диафрагмы чаще всего бывает рефлюкс-эзофагит, но может развиться пептическая язва пищевода, при длительном течении которой в свою очередь может произойти рубцовый стеноз (сужение) пищевода. Встречаются острое и хроническое кровотечение из пищевода, перфорация пищевода или ущемление грыжи в пищеводном отверстии диафрагмы
Консервативное лечение направлено на предотвращение осложнений и улучшение самочувствия пациентов. Для лечения и профилактики рефлюкс-эзофагита назначают препараты, снижающие кислотность желудочного сока (омез, париет, ранитидин и т.д.), обволакивающие препараты (маолокс и др.), которые защищают слизистую пищевода от действия желудочного сока. Проводят лечение сопутствующих заболеваний.
При отсутствии эффекта от медикаментозной терапии ГПОД, показано оперативное лечение, суть которого заключается в восстановлении нормальных анатомических отношений в области пищевода и желудка.
Показания к хирургическому лечению грыжи пищеводного отверстия диафрагмы:
неэффективность консервативного лечения;
наличие осложнений грыжи ПОД (эзофагит, эрозии и язвы пищевода, анемия, кровотечения);
большие размеры грыжи, ее фиксация в грыжевых воротах;
параэзофагеальная (около пищеводная) скользящая грыжа (высокий риск ущемления грыжи);
дисплазия слизистой пищевода (слизистая пищевода приобретает строение слизистой тонкого кишечника).
Виды хирургического лечения при грыже пищеводного отверстия диафрагмы: все существующие на сегодняшний день хирургические методики лечения ГПОД направлены на хирургическое создание арефлюксного механизма, препятствующего забросу желудочного содержимого в пищевод. В большинстве отечественных клиник используются операции фундопликации по Ниссену, которая состоит в хирургическом обороте дна желудка вокруг пищевода на 360’, что позволяет создать манжетку, препятствующую забросу желудочного содержимого в пищевод и, следовательно, развитию эзофагита.
Диафрагмальные грыжи. Классификация. Клиника, диагностика, дифференциальный диагноз. Показания к оперативному лечению. Методы операций. Грыжи Ларрея и Бохдалека.
Под грыжами естественных отверстий диафрагмы следует понимать пролабирова-ние органов полости брюшины в грудную полость через расширенные естественные отверстия диафрагмы. Образование грыжи в противоположном направлении, т. е. смещение внутригрудных органов в брюшную полость, относится к редкой патологии. Естественными отверстиями диафрагмы являются, прежде всего, пищеводное отверстие, отверстие аорты, нижней полой вены, а также щель симпатического нерва, отверстия чревного и межреберных нервов. Все перечисленные отверстия грудо-брюшной преграды при определенных условиях могут стать грыжевыми воротами.
В настоящее время единой общепринятой классификации грыж естественных отверстий диафрагмы не существует. С учетом механизмов возникнове-ния данной патологии выделяют грыжи врожденные и приобретенные. По частоте возникновения можно выделить грыжи пищеводного отверстия диафрагмы — на их долю приходится более 75% всех диафрагмальных грыж - и грыжи других есте-ственных отверстий диафрагмы, встречающиеся гораздо реже
Все диафрагмальные грыжи они делят на две группы:
ТРАВМАТИЧЕСКИЕ
Ложные
Истинные
НЕТРАВМАТИЧЕСКИЕ
Ложные
Истинные
Естественных отверстий
- пищеводного отверстия – 70%
- редкие грыжи других отверстий
Клиника и диагностика грыж диафрагмы: появление и степень выраженности симптомов диафрагмальных грыж зависят от характера перемещенных брюшных органов в плевральную полость, их объема, степени наполнения перемещенных полых органов, сдавления и перегиба их в области грыжевых ворот, степени коллапса легкого и смещения средостения, размеров и формы грыжевых ворот.
Симптомы диафрагмальной грыжи: желудочно-кишечные, легочно-сердечные и общие. Факторы, приводящие к повышению внутрибрюшного давления, усиливают выраженность симптомов заболевания в связи с увеличением содержимого грыжевого мешка.
Больные жалуются на чувство тяжести и боли в подложечной области, грудной клетке, подреберьях, одышку и сердцебиение, возникающие после обильного приема пищи. Часто отмечают бульканье и урчание в грудной клетке на стороне грыжи, усиление одышки в горизонтальном положении. После еды бывает рвота принятой пищей, что приносит облегчение. При завороте желудка, сопровождающемся перегибом пищевода, развивается парадоксальная дисфагия (твердая пища проходит лучше жидкой).
Большое диагностическое значение имеет прямая зависимость выраженности клинических симптомов от степени наполнения желудочно-кишечного тракта.
Ущемление диафрагмальной грыжи характеризуют резкие боли в соответствующей половине грудной клетки или в эпигастральной области, иррадиирующие в спину, лопатку. Ущемление полого органа может привести к некрозу и перфорации его стенки с развитием пиопневмоторакса.
Заподозрить диафрагмальную грыжу можно при наличии в анамнезе травмы, перечисленных выше жалоб, уменьшении подвижности грудной клетки и сглаживании межреберных промежутков на стороне поражения, западении живота при больших длительно существующих грыжах, определении притупления или тимпанита над соответствующей половиной грудной клетки, меняющих интенсивность в зависимости от степени наполнения желудка и кишечника, выслушивании перистальтики кишечника или шума плеска в этой зоне при одновременном ослаблении или полном отсутствии дыхательных шумов, смещении тупости средостения в непораженную сторону.
Окончательный диагноз устанавливают при рентгенологическом исследовании. Рентгенологическая картина зависит от характера и объема переместившихся в грудную клетку брюшных органов, от степени наполнения желудочно-кишечного тракта. При выпадении желудка виден большой горизонтальный уровень в левой половине грудной клетки, поднимающийся при приеме жидкости и пищи. При выпадении петель тонкой кишки на фоне легочного поля определяют отдельные участки просветления и затемнения. Перемещение селезенки или печени дает затемнение в соответствующем отделе легочного поля. У некоторых больных хорошо видны купол диафрагмы и брюшные органы, расположенные выше него.
При контрастном исследовании желудочно-кишечного тракта определяют характер выпавших органов (полый или паренхиматозный), уточняют локализацию и размеры грыжевых ворот на основании картины сдавления выпавших органов на уровне отверстия в диафрагме (симптом грыжевых ворот). У некоторых больных для уточнения диагноза накладывают диагностический пневмоперитонеум. При ложной грыже воздух может пройти в плевральную полость (рентгенологически определяют картину пневмоторакса).
Лечение диафрагмальных грыж: в связи с возможностью ущемления при диафрагмальной грыже показана операция. При правосторонней локализации грыжи операцию производят через трансторакальный доступ в четвертом межреберье, при парастернальных грыжах лучший доступ — верхняя срединная лапаротомия, при левосторонних грыжах показан трансторакальный доступ в седьмом — восьмом межреберье.
После разделения сращений, освобождения краев дефекта в диафрагме низводят перемещенные органы в брюшную полость и 1 ушивают дефект отдельными узловыми швами с образованием дубликатуры. При больших размерах дефекта прибегают к аллопластическому замещению диафрагмы протезами из капрона, нейлона, тефлона, лавсана и др.
При парастернальных грыжах (грыжа Ларрея, ретростернальная грыжа) низводят перемещенные органы, выворачивают и отсекают у шейки грыжевой мешок, накладывают и последовательно завязывают П-образные швы на края дефекта диафрагмы и задний листок влагалища брюшных мышц, надкостницу грудины и ребер.
При грыжах пояснично-реберного пространства (грыжа Бохдалека) дефект диафрагмы ушивают трансабдоминально отдельными швами с образованием дубликатуры.
При ущемленных диафрагмальных грыжах доступ трансторакальный. После рассечения ущемляющего кольца исследуют содержимое грыжевого мешка. При сохранении жизнеспособности выпавший орган вправляют в брюшную полость, при необратимых изменениях — резецируют. Дефект в диафрагме ушивают.
Местом проникновения грудинно-реберных грыж (стернокостальных) является лишенная мышц область соединения с грудиной и реберной частью. Это место носит название стернокостального треугольника Ларрея, а такие грыжи носят название грыж треугольника Ларрея
Медиастинит. Классификация. Клиника переднего и заднего медиастинита. Диагностика. Виды операций. Доступы.
Медиастинит (mediastinitis; от позднелатинского mediastinum — средостение) — воспаление клетчатки средостения.Различают острый и хронический медиастинит. Острые медиастиниты относятся к числу наиболее тяжелых форм хирургической инфекции. Острое воспаление жировой клетчатки средостения, содержащей большое количество кровеносных и лимфатических сосудов, лимфатических узлов и нервных проводников, является грозным осложнением различных гнойных заболеваний, прежде всего органов груди и шеи, огнестрельных ран и закрытых повреждений груди. Тяжесть течения, сложность ранней диагностики и связанная с этим высокая летальность придают проблеме особую актуальность.
По происхождению различают пер¬вичные (травматические) и вторичные медиастиниты. Первичные медиастиниты воз¬никают при ранениях средостения и его органов, а также после оперативных вмеша¬тельств на них.
К развитию вторичных воспалительных очагов в средостении могут приводить инфекционные осложнения ранений легких и плевры с формированием гнойных про¬цессов контактным или метастатическим путем. В таких случаях способствующим фактором является скопление в средостении в результате травмы сгустков крови. Иногда медиастинит может быть следствием гнойных заболеваний костного остова грудной клетки (остеомиелит ребер, грудины, перихондрит и др.).
Вторичные медиастиниты встречаются в 2-3 раза чаще, чем первичные, и могут возникать при проникновении в средостение инфекции контактным, гематогенным и лимфогенным путями. Они могут стать осложнениями гнойных и гнилостных воспалений клетчатки шеи, дивертикулов и других нагноений стенок пищевода, распадающегося рака пищевода, остеомиелитов костного каркаса грудной клетки, воспалительных процессов в дермоидных кистах и лимфатических узлах средостения, нагноений легких и плевры.
В зависимости от характера экссудата и вида возбудителя выделяют серозные (негнойные), гнойные, гнилостные, анаэробные и гангренозные формы заболевания.
Различают ограниченные (абсцессы) и распространенные (флегмоны) формы. Сре¬ди них выделяют медиастиниты передние (верхние - с расположением очага выше уровня третьего межреберья; нижние - книзу от третьего межреберья и всего перед¬него средостения), задние (верхние - с расположением очага выше уровня V грудного позвонка; нижние - книзу от V грудного позвонка и всего заднего средостения) и тотальные. Острые медиастиниты могут иметь молниеносную, острую и подострую формы течения.
Клинические проявления острого травматического медиастинита довольно харак¬терны. Состояние пострадавших с травмой груди после некоторого улучшения на фоне хирургического лечения вновь ухудшается. Заболевание начинается остро, обычно на 2-3 сутки после ранения средостения, и характеризуется прежде всего общими симптомами тяжелейшей интоксикации. В отдельных случаях, при повреждении пищевода с поступлением в клетчатку средостения большого количества инфицирован¬ного материала, медиастинит развивается к концу первых — началу вторых суток.
Больные предъявляют жалобы на боль в груди, нарастающую общую слабость, недомогание, нехватку воздуха. Обращают на себя внимание их беспокойство, иногда с двигательным возбуждением, повышение температуры тела до 39-40°С и потрясаю¬щие ознобы, профузное потоотделение, гиперемия кожи, одышка. Через сутки карти¬на возбуждения сменяется выраженным общим угнетением, иногда со спутанностью сознания.
Пострадавшие, как правило, стараются принять вынужденное положение полуси¬дя с наклоненной к груди головой, уменьшая таким образом боль и облегчая дыхание. У части пациентов появляется отек верхней половины туловища, шеи и лица с пере¬полнением кровью и напряжением поверхностных вен, цианозом кожи.
Значительная интоксикация, обусловленная резорбцией токсинов и продуктов распада тканей, сдавление крупных сосудов и нервов приводят к заметным расстрой¬ствам деятельности сердечно-сосудистой системы. Всегда выражена тахикардия с ча¬стотой пульса до 110-120 в минуту. По мере прогрессирования гнойного процесса появляется аритмия. Артериальное давление снижается, венозное — несколько воз¬растает. При аускультации сердца отмечается ослабление I тона на верхушке и П тона -на аорте.
Из местных симптомов наиболее ранним и постоянным является интенсивная боль в груди, усиливающаяся при глотании или запрокидывании головы (симптом Герке). У больных с передним медиастинитом боль обычно локализуется за грудиной, а при заднем расположении - в межлопаточном пространстве или же проецируется в надчревную область. Надавливание на грудину или остистые отростки позвонков при соответствующем расположении гнойников резко усиливает болевые ощущения.
Прогрессировала воспалительного процесса в средостении с отеком клетчатки часто приводит к (давлению блуждающих и диафрагмальных нервов, крупных крове¬носных сосудов, а при наличии больших ограниченных гнойников - пищевода и трахеи. В результате этого возникают дисфагия. удушье, упорный кашель, осиплость голоса. В периферической крови обнаруживают анемию и высокий лейкоцитоз с резким сдвигом формулы влево. При биохимических исследованиях крови выявляют гипо-протеннемню с уменьшением в сыворотке альбуминов, повышение содержания глобу¬линов и уменьшение альбуминоглобулинового коэффициента.
Помимо общих и местных клинических признаков, большое значение в распозна¬вании воспалительного процесса имеет лучевое исследование
Рентгенологическая картина острых гнойных медиастинитов определяется их рас¬пространенностью, локализацией и происхождением.
Ограниченный медиастинит отображается в виде округлой, достаточно очерчен¬ной тени в том или другом отделе средостения, выступающей в правое или левое легочное поле. В ней могут быть включения газа, дающие либо просветления в виде отдельных пузырьков, либо образующие горизонтальный уровень. Все эти изменения достоверно выявляются при КТ. Использование контрастирования позволяет диффе¬ренцировать грануляционную ткань, развивающуюся вокруг такого медиастинально-го абсцесса.
Особой формой ограниченного медиастинита является натечный абсцесс, форми¬рующийся при туберкулезном спондилите шейного или грудного отдела позвоночни¬ка. Он локализуется в паравертебральной зоне, имеет овальную или грушевидную форму, обычно с ровными и четкими контурами. Эта картина весьма схожа с нейро-генной опухолью средостения. Уточнению диагноза способствует выявление при рент¬генографии специфических изменений позвоночника.
Диффузный медиастинит при рентгенологическом исследовании в прямой про-екции характеризуется расширением срединной тени, полицикличностью и нечет-костью контуров, недифференцируемостью сердечно-сосудистых дуг. При разрыве пищевода, трахеи, главных бронхов в средостении определяются скопления газа, горизонтальные уровни жидкости.
На рентгенограммах в боковой проекции передний медиастинит характеризуется затенением ретростернального пространства, а задний медиастинит — затенением па¬равертебральной зоны. Инфильтрация верхнего средостения нередко распространяет¬ся на клетчатку шеи, что также хорошо выявляется на рентгенограммах в боковой проекции.
При КТ воспалительная инфильтрация клетчатки средостения проявляется повы¬шением ее плотности и потерей дифференцируемости анатомических структур средо¬стения. Достоверно определяются даже мельчайшие скопления газа.
Хирургическая тактика. При остром медиастините травматического происхожде¬ния необходимо более раннее оперативное вмешательство для вскрытия воспалитель¬ного очага (медиастинотомия) и его надежного дренирования. Резорбция токсинов и продуктов некробиоза приводит к быстрому ухудшению состояния больных, и без своевременного оказания хирургической помощи процесс почти всегда заканчивается смертью. Оперативное пособие следует проводить даже при общем тяжелом состоянии пострадавших, так как лишь операция в сочетании с другими методами лечения может спасти их жизнь.
Успех лечения таких больных в определенной степени зави¬сит не только от хорошо проведенной анестезии и радикальности самой операции, но во многом определяется оценкой общего состояния пациентов и обязательной кратко-временной (60-80 мин) предоперационной интенсивной терапией, направленной на коррекцию нарушенного гомеостаза и устранение расстройств жизненно важных функ¬ций. Она включает в себя назначение достаточных по объему количеств плазмозаме-щающих растворов и крови, дополнительное введение больших доз антибиотиков широкого спектра действия, кардиотропных средств, витаминов, антигистаминных препаратов и т. д.
Операцию проводят под общим обезболиванием с ИВЛ. Выбор оперативного досту¬па, в конечном счете, определяется уровнем и характером распространенности гной¬ного очага.
Операции при передних медиастинитах. При передних ограниченных медиасти-нитах, развившихся вследствие ранения грудины и клетчатки средостения, иногда может быть применим трансстернальный доступ к гнойнику в средостении с попереч¬ной стернотомией. При этом, помимо полноценного дренирования абсцесса, обязательно резецируют измененные участки кости.
Определенное практическое значение имеет предложенный О. Маделунгом вне-плевральный парастернальный доступ с резекцией 2-3 реберных хрящей. Уровень предстоящего дренирования определяют по обзорной рентгенограмме грудины и при диагностической межреберно-загрудинной пункции переднего средостения.
В случаях верхнего медиастинита (до уровня дуги аорты или IV грудного позвон¬ка) применяют шейную медиастинотомию.
Больной лежит на спине с валиком под лопатками. Производят поперечный раз¬рез длиной не менее 10-12 см чуть выше рукоятки грудины. Рассекают поверхност¬ные слои и 2-ю фасцию шеи, тупым путем расслаивают надгрудинный клетчаточный слой, не повреждая яремные вены, разъединяют 3-ю фасцию и пальцем проникают за грудину в переднее средостение. После вскрытия и опорожнения гнойника его по¬лость многократно промывают антисептическим раствором и дренируют силиконовы¬ми или мягкими резиновыми трубками. В послеоперационном периоде показано не¬прерывное промывание раны в сочетании с активной аспирацией.
При нижнем переднем медиастините проводят срединный разрез длиной 5-7 см, начиная от мечевидного отростка книзу. При необходимости резецируют верхушку мечевидного отростка и тупым путем оттесняют книзу диафрагму. Пальцем входят в клетчаточный слой и продвигаются кверху позади грудины. Вскрывают и опорожня¬ют гнойник, промывают рану и дренируют ее силиконовыми трубками.
Разлитую флегмону переднего средостения дренируют, комбинируя надгрудин¬ный и подгрудинный доступы.
Операции при задних медиастинитах. При высоком заднем медиастините ис¬пользуют доступ, предложенный В. И. Разумовским (1899).
Больного укладывают на спину с подложенным под плечи валиком, голова повер¬нута вправо. Проводят разрез длиной 10-12 см по переднему краю левой грудиноклю-чично-сосцевидной мышцы, начиная от рукоятки грудины. Послойно рассекают кожу, клетчатку, поверхностную и 2-ю фасции шеи. Вместе с мышцей отводят кнаружи сосудисто-нервный пучок. Пальцем осторожно создают канал, проникая вглубь и книзу позади пищевода, по направлению к заднему средостению. Вскрывают гной¬ник, промывают и дренируют рану.
При задних медиастинитах в нижнем отделе средостения можно использовать чрездиафрагмальную медиастинотомию по Савиных-Розанову Брюшную полость вскрывают верхним срединным разрезом. Рассекают треугольную связку печени и отводят левую ее долю книзу и вправо, обнажая пищеводное отверстие диафрагмы. Брюшную полость ограничивают марлевыми салфетками. Про-изводят сагиттальный разрез диафрагмы кпереди от пищеводного отверстия. Пальцем расслаивают клетчатку и проникают вверх вдоль пищевода, достигая полости гнойни¬ка. После удаления гноя и введения дренажа тщательно ушивают разрез диафрагмы вокруг него для создания полной герметичности и условий, обеспечивающих после-дующее активное удаление патологического экссудата из средостения. Поддиафраг-мальное пространство также дренируют.
Дивертикулы пищевода. Классификация. Клиника. Диагностика. Лечение.
Дивертикул пищевода — ограниченное расширение просвета органа в виде меш¬ковидного выпячивания его стенки
Все известные классификации дивертикулов пищевода основаны на их локализа¬ции и механизме возникновения. В 1840 г, Rokitansky, а затем Zenker (1877) предло¬жили различать пульсионные, тракционные и смешанные дивертикулы. Эта простая схема деления сохранила свое значение до настоящего времени.
Пульсионные дивертикулы пищевода формируются обычно в результате длитель¬ного постоянного влияния повышенного внутрипросветного давления на потенциаль¬но слабый участок стенки пищевода вследствие нарушения нервно-мышечной коорди¬нации или органического сужения просвета органа. Само выпячивание чаще всего представлено слизистой оболочкой, вышедшей через истонченную расслоившуюся мышечную стенку пищевода.
Тракционные дивертикулы чаще всего возникают при вовлечении стенки пищевода в воспалительные и спаечные процессы, развивающиеся в клетчатке средостения. В даль¬нейшем к первичной тракцип стенки органа нередко присоединяется пульсионныи механизм, обусловленный задерживающейся в слепом мешке дивертикула пищи. Таким образом, дивертикул приобретает смешанный тракционно-пульсионный характер
Следует выделять еще один вид дивертикулов — функциональные (релаксацион ные). Они являются следствием расстройства иннервации участка пищевода и прояв¬ляются появлением ограниченных выбуханий его стенки во время фазы сокращения органа. Функциональные дивертикулы нередко бывают множественными, имеют не¬постоянные размеры и исчезают при расслаблении пищевода.
По локализации дивертикулы разделяют на глоточно-пищеводные (ценкеровские) бифуркационные и эпифренальные.
ГЛОТОЧНО-ПИЩЕВОДНЫЕ (ЦЕНКЕРОВСКИЕ) ДИВЕРТИКУЛЫ
Эти дивертикулы обычно имеют пульсионный характер и встречаются в практи-ческой деятельности достаточно часто. Выходят они из просвета органа на уровне перехода глотки в пищевод по его задней стенке. Для формирования глоточно-пище-водного дивертикула имеются определенные анатомо-функциональные предпосылки. Установлено, что между нижним сжимателем глотки и перстневидно-глоточной мыш¬цей имеется участок слабо развитых мышц глотки и пищевода (треугольник Ланнье-Геккермана). Второй аналогичный участок расположен между перстневидно-глоточ¬ной мышцей и мускулатурой пищевода (треугольник Лемера-Киллиана).
В эти зоны при определенных условиях и выдвигаются дивертикулы, которые чаще всего смещаются в левую, реже правую сторону. Размеры дивертикулов колеблются в больших пределах: от сравнительно небольших (1-2 см) до выпячивания слизистой в виде мешка значительных размеров, спускающегося в заднее средостение.
Различают три стадии образования ценкеровского дивертикула: 1) небольшое вы¬пячивание слизистой оболочки пищевода; 2) сформированный дивертикулярный ме¬шок, располагающийся между пищеводом и позвоночником; 3) дивертикул больших размеров, распространяющийся в средостение.
Во второй стадии развития дивертикула устье его имеет форму косо расположен¬ного овала. По мере прогрессирования патологического процесса отверстие диверти¬кула принимает горизонтальное положение, способствующее быстрому наполнению его пищей. Наполненный дивертикулярный мешок нередко сдавливает своей тяже¬стью просвет пищевода.
Стенка дивертикула чаще всего состоит из слизистой оболочки, выстланной мно¬гослойным плоским эпителием, снаружи — из фиброзной ткани и истонченных цир¬кулярных мышечных волокон глотки у шейки дивертикула. В стенке дивертикула обычно имеются воспалительные изменения, связанные, главным образом, с застоем пищевых масс. В воспалительный процесс могут вовлекаться окружающие ткани, вызывая картину перидивертикулита с образованием плотных сращений на шее и в средостении.
Клиника и диагностика. Симптоматика глоточно-пищеводных дивертикулов ши¬роко варьирует в зависимости от их размеров и способности опорожняться. Сравни¬тельно небольшие выпячивания слизистой оболочки обычно клинически не проявля¬ются. По мере увеличения дивертикула больной начинает ощущать некоторое неудобство в горле, легкие царапающие боли, чувство жжения, першения в горле. Появляются кашель, незначительная саливация.
Характерная клиническая картина появляется при полностью сформировавшем¬ся дивертикуле (III стадия). Во время глотания при наполнении мешка пищей и воздухом возникают булькающие звуки, слышимые на расстоянии. Постепенно про¬являются нарушения глотания. Это заставляет больных есть медленно, придавая определенное положение голове и шее. Наиболее яркая симптоматика отмечается в третьей стадии заболевания. Отчетливо проявляется дисфагия, регургитация, призна¬ки сдавления окружающих органов, легочные осложнения. Переполненный пищевы¬ми массами дивертикул оттесняет пищевод, вызывая иногда полную его непроходи¬мость. Для облегчения глотания больные расстегивают воротник, давят на шею, нагибают голову в разные стороны, делают рвотные движения, срыгивают задерживаю¬щиеся в дивертикуле пищевые массы. В ряде случаев больные выдавливают содержи¬мое дивертикула в рот или промывают его. Наступает заметное облегчение.
Часть застрявшей в мешке пищи застаивается и разлагается. Появляется зловон¬ный запах изо рта, диспепсические явления.
При большом глоточно-пищеводном дивертикуле на боковой поверхности шеи слева иногда отмечается выпячивание мягкой консистенции, над которым перкуторно определяется тимпанический звук.
Сдавление трахеи вызывает затруднение дыхания, а крупных венозных ство¬лов — нарушение венозного оттока от головы и шеи.
В ряде наблюдений возможна регургитация и аспирация содержимого дивертику¬ла с развитием легочных осложнений (рецидивирующий бронхит, пневмонии, абсцесс легкого). Длительный застой пищи способствует развитию дивертикул ита, перидивер-тикулита с соответствующей симптоматикой. При длительном течении воспалитель¬ного процесса возможны перфорация дивертикула или развитие в нем злокачествен¬ной опухоли.
Окончательный диагноз пищеводно-глоточного дивертикула основывается на кли¬нической картине заболевания и, главным образом, данных рентгенологического ис¬следования.
Лечение. Радикальным методом лечения является оперативное удаление диверти¬кула. Консервативная терапия, включающая строгий пищевой режим, мягкую диету, тщательное пережевывание пищи, промывание дивертикула и тому подобное обычно назначается для подготовки больного к операции. В редких случаях ею ограничива¬ются при наличии серьезных противопоказаний к вмешательству.
Хирургическому лечению подлежат дивертикулы II и III стадии, в первую очередь осложненные. Операцией выбора является одномоментная дивертикулэктомия. Техника ее заключается в следующем. Производят разрез кожи по переднему краю грудино-ключично-сосцевидной мышцы слева. Послойно рассекают ткани, доходят до левой доли щитовидной железы. Последнюю мобилизуют, отодвигают кверху и вправо. Сосудисто-нервный пучок шеи отводят крючком Фарабефа кнаружи, раздвигают клетчатку и обна¬жают заднюю поверхность пищевода и глотки. Глоточно-пищеводнын дивертикул обыч¬но располагается на уровне перстневидного хряща. Его захватывают окончатым зажимом и тщательно выделяют из сращений до самой шейки. На последнюю накладывают мягкие зажимы, между которыми шейку мешка пересекают и дивертикул удаляют.
БИФУРКАЦИОННЫЕ ДИВЕРТИКУЛЫ
Дивертикулы средней трети пищевода располагаются обычно на его переднебоко-вой стенке в области пересечения органа с бифуркацией трахеи. Поэтому их называют эпибронхиальными, бифуркационными или парабронхиальными. Встречаются они чаще глоточно-пищеводных дивертикулов.
Клиника и диагностика. Клиническая картина бифуркационных дивертикулов весьма неоднородна и, как правило, не имеет характерной симптоматики. В ряде случаев они являются случайной находкой во время лучевого исследования средосте¬ния и пищевода.
В клинически выраженных наблюдениях появляется чувство тяжести в груди, эпи¬зодические или постоянные загрудинные боли, усиливающиеся при прохождении пищи по пищеводу. Боли нередко иррадиируют в спину, лопатку. Иногда возникает упорный кашель, болезненность в груди при глубоком вдохе. Очень часто одновременно с бифур¬кационными дивертикулами отмечаются другие заболевания органов желудочно-кишеч¬ного тракта (язвенная болезнь, гастрит, спастический колит). Именно эти патологиче¬ские состояния заставляют больных в первую очередь обращаться за врачебной помощью,
Дисфагия у пациентов с бифуркационными дивертикулами в большинстве случа¬ев выражена незначительно, так как они самостоятельно хорошо дренируются в пи¬щевод. Лишь иногда появляется срыгивание съеденной пищей или старыми пищевы¬ми массами. На этом фоне возникает отрыжка с неприятным запахом.
Наиболее характерными осложнениями бифуркационных дивертикулов являют¬ся дивертикулит, пищеводно-трахеальный свищ, аррозионное кровотечение, развитие рака пищевода в области дивертикула.
Точное установление диагноза с детальной всесторонней характеристикой бифур¬кационных дивертикулов обеспечивает рентгеноконтрастное исследование пищевода.
Лечение. Выбор метода лечения бифуркационных дивертикулов зависит от особен¬ностей течения заболевания. У значительной части этих больных оперативное вмеша¬тельство не показано. Хирургическому лечению подлежат дивертикулы больших раз¬меров с выраженной клинической картиной и признаками длительной задержки контрастной взвеси в них. Операция показана также при выраженной клинике диверти-кулита, пищеводно-трахеальных свищах, развитии кровотечения при аррозии сосудов.
Операцией выбора является дивертикулэктомия, реже инвагинация по Жирару.
Техника дивертикулэктомии сводится к следующему. Выполняют правосторон¬нюю боковую торакотомию в пятом-шестом межреберье. Легкое отводят кнутри и кпереди. Рассекают медиастинальную плевру и перевязывают и пересекают непарную вену. Выделяют из медиастинальной клетчатки пищевод и проводят под него турни¬кет. Обнаруживают дивертикул, который выделяют вплоть до шейки из сращений. В затруднительных случаях для обнаружения дивертикула можно через зонд ввести в пищевод воздух. При этом дивертикул раздувается и становится хорошо заметным.
После выделения дивертикула со всех сторон основание его прошивают сшиваю¬щими аппаратами или накладывают непрерывный П-образный кетгуговый шов. После отсечения дивертикула той же нитью дополнительно прошивают слизистую пищевода через край.
ЭПИФРЕНАЛЬНЫе (НАДДИАФРАГМАЛЬНЫЕ) ДИВЕРТИКУЛЫ
Эти дивертикулы по своей сути являются пульсионными, а впоследствии могут приобретать черты смешанных,
В образовании эпифренальных дивертикулов ведущую роль играет врожденная или приобретенная слабость мышечной оболочки пищевода, а также факторы, способ-ствующие повышению внутрипищеводного давления. Последнее нередко возникает вследствие некоординированной перистальтики пищевода и его нижнего сфинктера. Наддиафрагмальные дивертикулы обычно располагаются на заднеправой стенке пищевода на 2-10 см выше диафрагмы. Форма их правильная шаровидная с достаточ¬но выраженной шейкой. Стенка дивертикулярных мешков представлена слизистой оболочкой пищевода, отдельными истонченными мышечными пучками в области шейки и наружной соединительнотканной оболочкой. Клиника и диагностика. Клинические проявления эпифренальных дивертикулов обусловлены, главным образом, дисфагией, в основе которой лежит сдавление пищевода наполненным дивертикулярным мешком. Дисфагия более выражена в тех случаях, когда шейка дивертикула располагается выше, чем дно, и условия для его опорожнения плохие. Сопутствующий спазм пищевода в еще большей степени способствует затруднению прохождения пищи. Воспалительный отек стенки пищевода, нередко встречающийся в таких наблюдениях, ведет к развитию эзофагита и дивертикулита, — что само по себе усугубляет дисфагию. Со временем длительный воспалительный процесс в стенке пищевода ниже дивертикула может привести к образованию стойкого органического стеноза этой зоны.
Дисфагия приобретает постоянный характер. Жалобы больного и объективные клинические данные лишь позволяют предположить наличие наддиафрагмального дивертикула. Установить же точный диагноз обычно удается с помощью рентгеноконтрастного исследования пищевода. Трудности могут возникнуть только с дифференциацией эпифренального дивертикула с параэзофагеальной грыжей.
Лечение. Во всех случаях при эпифренальных дивертикулах показано оператив-ное лечение. Операцией выбора является дивертикулэктомия. Предпочтителен право¬сторонний боковой доступ в седьмом-восьмом межреберье. После рассечения медиа-стинальной плевры над пищеводом выделяют со всех сторон дивертикул. Шейку дивертикула прошивают механическим швом или синтетическим швом с атравматич-ной иглой. На мышечную оболочку пищевода накладывают второй ряд узловых тонких синтетических швов. Линию швов укрывают лоскутом париетальной плевры или диафрагмы
Химические ожоги пищевода. Патогенез и патофизиология заболевания. Первая помощь при ожогах. Клиника. Диагностика. Дифференциальный диагноз. Осложнения. Консервативное лечение в остром и метаожоговом периоде. Место лечения в остром периоде. Раннее и позднее бужирование.
Ожоги пищевода возникают при попадании в него едких химических веществ при случайном приеме внутрь или вследствие суицидальных попыток.
Чаще ожоги возникают при приеме едкого натра (каустическая сода, натрия гидроокись), концентрированных растворов серной, хлористоводородной, уксусной (уксусная эссенция) кислот, реже наблюдаются ожоги фенолом, лизолом, спиртовым раствором йода (йодная настойка), сулемой.
Помимо пищевода, при приеме внутрь едких веществ страдает также желудок; изменения обнаруживают на слизистой оболочке полости рта и глотки. Принято считать, что при приеме сильной кислоты наиболее выраженные изменения развиваются в пищеводе, а при приеме едкой щелочи — в желудке (так как слизистая оболочка желудка в какой-то степени устойчива к действию кислоты). Степень поражения зависит от концентрации, характера и количества выпитого вещества. Слизистая оболочка желудка поражается меньше, если желудок заполнен жидкостью и пищей.
Ожоги щёлочами характеризуются более глубоким и распространённым поражением стенки пищевода. Наиболее выраженные изменения возникают в местах физиологических сужений
Стадии ожога
• I — гиперемия и отёк слизистой оболочки
•II — некроз и изъязвление слизистой оболочки
•III — образование грануляционной ткани
•IV — рубцевание
К концу первой недели некротизированные участки отторгаются образуя изъязвления. Поверхностные язвы эпителизируются в течение 1–2 мес, глубокие — в течение 2–6 мес с образованием соединительной ткани.
Выделяют 3 степени ожога пищевода. При ожоге 1 степени поражаются только поверхностные слои слизистой оболочки пищевода; при ожоге II степени поражение распространяется до мышечной его оболочки, при ожоге III степени наблюдается поражение всех слоев пищеводной стенки, а также параэзофагеальной клетчатки и окружающих органов. При ожоге III степени помимо местных выражены и общие явления, обусловленные интоксикацией и шоком. При ожогах II и особенно III степени (если больного удается спасти) развиваются рубцовые изменения в пищеводе, стриктуры, рубцовое укорочение пищевода, в ряде случаев — хроническое изъязвление стенки пищевода.
При ожоге пищевода в типичных случаях течение подразделяют на 3 периода: 1-й — острый (до 1—1 1/2 нед), проявляющийся гиперемией, отеком, некрозом и изъязвлениями слизистой оболочки, в этот период из-за сильной боли глотание невозможно; 2-й — подострый (1 1/2 —3 нед), период грануляции и постепенного восстановления возможности принимать жидкость и пищу; 3-й — хронический, период рубцевания, нарастающего сужения пищевода и возобновления дисфагии.
Предварительный диагноз устанавливают на основании анамнеза и оценки тяжести общего состояния больного. Характер едкой жидкости, принятой больным, можно установить либо с его слов, либо по остаткам жидкости, находящейся в емкости (чашка, пузырек, бутылка), из которой больной ее пил. Следует, однако, иметь в виду, что надпись на флаконе или бутылке не всегда соответствует характеру ее содержимого (едкое вещество может по небрежности храниться в случайной, неприспособленной посуде).
Первый и наиболее яркие симптомы — сильное жжение и боль в полости рта, глотки, за грудиной и в эпигастральной области, возникающие сразу вслед за проглатыванием едкого вещества. Нередко появляется рвота. Губы отекают.
В тяжелых случаях развиваются шок, потеря сознания. Если в течение 1—2 дней смерть больного не наступила, появляются выраженная одышка вследствие отека гортани, рвота слизью и кровью, в рвотных массах можно определить кусочки слизистой оболочки. Повышается температура тела. Глотание невозможно. Вследствие глубокого поражения стенки пищевода возможны пищеводные кровотечения, симптомы, обусловленные развитием медиастинита или других осложнений, нарушения функции почек (вследствие их токсического поражения).
В случаях средней тяжести через несколько дней уменьшается боль, однако глотание затруднено, отмечаются повышенная саливация, срыгивание кровянистым отделяемым. При осмотре полости рта видны следы ожога слизистой оболочки. Через 10—20 дней постепенно восстанавливается способность проглатывать жидкость и жидкую пищу, однако глотание долго остается болезненным. В период рубцевания, через несколько недель дисфагия возобновляется; при резком стенозировании пищевода больной не может принимать жидкость и пищу, развивается истощение.
При тяжелых отравлениях едкими веществами больные умирают вследствие интоксикации, шока, развития гнойных осложнений (медиастинит, абсцесс и гангрена легкого, плеврит). Из осложнений могут
наблюдаться тяжелые пищеводные кровотечения, перфорации пищевода, развиваться пищеводно-трахеальные и пищеводно-бронхиальные свищи. Наиболее частым поздним осложнением химических ожогов пищевода является развитие Рубцовых сужений (стенозов) пищевода, его рубцовых деформаций и укорочения.
Окончательный диагноз устанавливают тогда, когда можно точно определить степень поражения и возникшие осложнения.
Рентгенологическое исследование пищевода в первые дни проводить не следует, необходимо добиться стабилизации состояния больного. Через несколько дней после ожога (при средней тяжести поражения) при концентрированном рентгенологическом исследовании можно отметить отечность слизистой оболочки пищевода и локальные спазмы. В более поздние периоды информативность рентгенологического исследования значительно выше: можно определить места, протяженность и выраженность рубцовых сужений и деформаций пищевода.
Эзофагоскопия в первые дни противопоказана, в дальнейшем возможна только в периоде рубцевания и эпителизации слизистой оболочки, при этом проводить ее следует крайне осторожно. Эзофагоскопия позволяет определить протяженность поражения, проследить за динамикой процесса, своевременно выявить формирующиеся стриктуры (они чаще образуются в дистальном отрезке пищевода, над кардиальным сфинктером; несколько реже в области глоточно-пищеводного соединения и на уровне бифуркации трахеи).
Неотложная терапия; необходимы срочная госпитализация, парентеральное введение обезболивающих средств (для борьбы с шоком), введение желудочного зонда, обильно смазанного маслом, для выведения желудочного содержимого и промывания желудка с целью нейтрализации едкого вещества. При отравлениях щелочами желудок промывают разведенным раствором уксусной кислоты (3—6%) или растительным маслом, при отравлениях кислотами — слабым (2%) раствором натрия гидрокарбоната. В сомнительных случаях желудок промывают молоком. До введения зонда назначают обильное питье слабых растворов уксусной кислоты или гидрокарбоната натрия (в зависимости от характера яда)
Промывание с помощью зонда проводят после предварительного введения под кожу наркотических анальгетиков (промедол 1 мл 2% раствора) и атропина сульфата (1 мл 0,1% раствора), а также местной анестезии полости рта и глотки 2% раствором дикаина. Промывание желудка эффективно только в первые 6 ч после отравления. Необходима дезинтоксикационная терапия. Парентерально вводят гемодез, реополиглюкин, солевые растворы. Для профилактики и лечения инфекционных осложнений назначают парентерально антибиотики широкого спектра действия (ампициллина натриевая соль, ампиокс, гентамицина сульфат, цефамезин и др.). Чтобы уменьшить развитие рубцовых изменений в пищеводе, назначают препараты гормонов коры надпочечников парентерально. В зависимости от характера принятого яда и особенностей клинической картины применяют средства, нормализующие деятельность сердечно-сосудистой системы, функцию почек, при значительной кровопотере проводят гемостатическую и кровезамещающую терапию и т. д.
Введение жидкости внутрь в первые 1 —3 сут исключается, а в более тяжелых случаях этот запрет продолжается до 5—7 дней, затем дробными порциями в небольших количествах разрешают прием сливок, молока, сырых яиц, теплого бульона. Постепенно диету расширяют. При тяжелых ожогах пищевода для обеспечения питания больного через 7—10 дней накладывают гастростому.
После стихания острых воспалительных явлений при ожогах 2—3-й степени с целью ранней профилактики развития стенозов начинают бужирование пищевода, которое продолжают несколько недель. Бужирование полыми рентгеноконтрастными бужами по металлическому проводнику под контролем эзофагоскопа по принципу бужирование без конца (бужирование с последовательным увеличением диаметра бужей в течение одной процедуры с использованием гастростомы — бужи проводят через ротовую полость, пищевод и гастростому) Если развитие стеноза не удается предотвратить, прибегают к оперативному лечению — созданию искусственного пищевода. При своевременно начатом лечении благоприятные результаты наблюдаются в 90% случаев. Позднее бужирование пищевода проводят после тщательного общеклинического обследования больного, рентгенологического и эзофагоскопического исследований. Бужирование начинают с бужей № 8—10, постепенно переходя к бужам большего диаметра. Процедуру проводят ежедневно или через день, а по достижении достаточного эффекта — 1—2 раза в неделю на протяжении 3—4 мес, а иногда до полугода и более. Даже при хорошем и относительно стойком результате, достигнутом при бужировании, стриктура обладает тенденцией к сужению, поэтому больные, перенесшие химические ожоги пищевода и лечение бужированием, должны находится под контролем и при необходимости проходить повторные курсы лечения.
Осложнения
• Рубцовое сужение пищевода
• Внутрисосудистый гемолиз при ожогах уксусной эссенцией
• Аспирационная пневмония
• Психоз
• Сепсис.
Рубцовые сужения пищевода после химического ожога. Клиника. Диагностика. Дифференциальный диагноз. Локализация и формы сужения. Методы бужирования. Показания к хирургическому вмешательству. Оперативное лечение: подготовка, доступы, анестезия, виды операций. Органы для эзофагопластики. Пути проведения трансплантата по отношению к грудной клетке и плевральной полости.
Рубцовые сужения пищевода разделяются:
1.По числу пораженных органов:
· изолированные;
· сочетанные - сужения пищевода и желудка или двенадцатиперстной кишки.
2.По протяженности:
· мембранозные (мембранозные) - до 1см;
· короткие (стриктуры) - до 5 см;
· протяженные (стенозы) - более 5 см.
3.По числу сужений в пищеводе:
· единичные;
· множественные.
4.По степени рубцовых изменений стенки пищевода:
· несформированные;
· сформированные, (с супрастенотическим расширением).
5. По наличию деструктивных изменений:
· ульцерированные (изъязвленные);
· простые (не ульцерированные).
6. По срокам формирования:
· ранние - до 6 месяцев;
· поздние от 6 месяцев и более.
7. По степени облитерации просвета пищевода:
· полные;
· частичные.
8. По виду расположения устья сужения:
· с прямым расположением входа;
· с эксцентрично расположенным входом.
Глубина, тяжесть и протяженность ожога пищевода зависит от концентрации, природы химического вещества, его количества, времени контакта со слизистой, резорбтивного действия и реактивности организма пострадавшего. В зависимости от указанных выше причин принято различать три степени ожога пищевода:
I степень - ЛЕГКАЯ - десквамативный эзофагит (повреждение поверхностных слоев эпителия) гиперемия, отек, повышенная ранимость слизистой оболочки. Воспалительные явления сохраняются не более 24 дней.
II степень - СРЕДНЯЯ - фибринозный, эрозивный эзофагит (повреждения слизистой, часто подслизистого слоя) выраженный отек, фибринозные наложения, покрывающие изъязвления, просвет может не дифференцироваться. Поверхностные язвы эпителизируются к концу 23 недели.
III степень - ТЯЖЕЛАЯ - язеннонекротический эзофагит (некроз захватывает стенку органа на всю глубину вплоть до околопищеводной клетчатки). Продолжительность течения процесса отторжения и рубцевания, в случае благополучного исхода интенсивной первичной терапии, до 2 и более лет.
Развитие патоморфологического процесса в пищеводе и желудке разделяют (Э.Н.Ванцян, Р.А.Тощаков, 1971) на 5 стадий:
1 стадия - повреждение тканей;
2 стадия - острое воспаление (от первых часов до 3-10 суток), характеризуется отеком, фибринозным налетом на гиперемированной слизистой;
3 стадия - отторжение некротических масс и образование изъязвлений (от8 до 18 дней), период опасен развитием кровотечений;
4 стадия - развитие грануляций - (начиная с 2- 4 недель и продолжается не-сколько месяцев); ее клинические проявления определяются скоростью раз-вития грануляционных тканей;
5 стадия - рубцевание (длительность от 1месяца до 3лет и более).
При II-III степени ожогового поражения пищевода, начиная со второй недели, острые воспалительные изменения сменяются стадией изъязвления. Симптомов нарушения проходимости пищевода, как правило, не отме-чается. Этот период многими авторами обозначается как мнимое благополучие, иногда его клинически расценивают как полное выздоровление. Рубцовые изменения в эти сроки еще не наступают. При ожогах I-II степени период мнимого благополучия оказывается истинным - эрозии эпителизируются к концу 3-4 недели. При ожогах III степени, с конца 2-3 недели наступает стадия развития грануляционной ткани, периодически возникают симптомы дисфагии. Если не придать этому значения, то к концу 4-5 недели усиливаются проявления "перемежающейся" дисфа-гии, связанные с рубцовыми изменениями. Исходом ожога пищевода III стадии является формирование органического сужения или полная рубцовая непроходимость. Сложность проблемы заключается в том, что из всей группы больных, поступивших с клиникой химического ожога органов верхнего отдела ЖКТ, необходимо выделить нуждающихся в проведении раннего профилактического бужирования. Несмотря на то, что первые клинические проявления формирования РСП появляются через 2-3 недели после ожоговой травмы, нередко начало бужирования задерживается на значительное время, часто до возникновения тяжелых обменных нарушений в результате рубцовых изменений стенки пищевода.
Больным с грубыми циркулярными поражениями и ригидностью стенок пищевода необходимо проводить ПРОФИЛАКТИЧЕСКОЕ бужирование, начиная с 1 - 2 недели после ожоговой травмы.
После выполнения полного объема обследования (неотъемлемой частью которого является рентгенологическая диагностика и эндоскопическое исследование, а нередко - их сочетание), проводится бужирование, начиная с бужей наименьшего диаметра.
ПОКАЗАНИЯ ДЛЯ БУЖИРОВАНИЯ РСП С ИСПОЛЬЗОВАНИЕМ ГИБКОГО ПРОВОДНИКА
Протяженные РСП, осложненные:
- сложным ходом канала;
- множественностью сужений;
- максимальной степенью сужения (менее 2 мм);
- эксцентричным расположением просвета и наличием псевдодивертикулов
При наличии РСП диаметром не менее 5 - 6 мм, можно попытаться провести эндоскоп уменьшенного диаметра через суженный участок пищевода в желудок. По инстументальному каналу эндоскопа, в антральный отдел желудка устанавливается струнанаправитель. Плавно извлекая эндоскоп из желудка, пищевода и одновременно продвигая струну - направитель вниз по инструментальному каналу, под контролем зрения металическая струна установливается в антральный отдел желудка и затем, после извлечения аппарата, фиксируется у зазубника ассистентом. По установленной струненаправителю выполняется бужирование по общепринятой методике.
Применение методики бужирования с использованием эластичного проводника дает возможность:
- сократить количество сочетанных рентгенэндоскопический вмешательств;
- уменьшить лучевую нагрузку на пациента и медперсонал;
- выполнять бужирование преимущественно амбулаторно изза минимальной опасности возникновения осложнений.
После курса стационарного лечения и проведения бужей №№ 36 - 40 больные переводятся на амбулаторное поддерживающее бужирование, которое выполняется с возрастающим интервалом между сеансами от 1 раза в 8 - 10 дней до 1 раза в 2 - 3 месяца на протяжении 1,5 - 3лет. За это время, как правило, формируется рубец в области химического ожога дилатированный "на буже" до диаметра, достаточного для адекватного питания. Однако, признаки хронического эзофагита с периодическими обостениями в зоне бывшего глубокого ожога пищевода обнаруживаются в течение всей жизни. Восспалительный процесс то усиливаясь, то стихая исключительно редко ликвидируется совсем.
Одномоментно с бужированием пациенты проходят амбулаторно курсы физиотерапевтического и общеукрепляющего лечения с интервалом 1 раз в 6 - 9 месяцев.
Показания к операции:
1. Полная рубцовая непроходимость пищевода не подающаяся бужированию. 2. Ограничения возможности проведения бужа выше N 24-26 (по шкале Шарьера) и частые рецидивы сужения на протяжении 2-3 лет. 3. Развитие вторичного укорочения пищевода и тяжелого рефлюкс-эзофагита, приводящего к рецидиву РСП. 4. Развитие выраженного супрастенотического расширения над сужением с проявлениями тяжелого хронического эзофагита на фоне стойкой атонии и истончения стенок 5. Свищи пищевода, при которых бужирование противопоказано. 6. Рак пищевода, развившийся на фоне РСП.
Операция Ру— Герцена состоит из трех этапов: 1. Лапаротомия, мобилизация верхнего отрезка тощей кишки и пересечение ее на расстоянии 15—20 см от двенадцатиперстно-тощей связки; восстановление проходимости путем вшивания приводящего конца в бок отводящего; зашивание конца кишки, мобилизованной для образования искусственного пищевода, и проведение последней впередигрудинно, в образованном в подкожной клетчатке туннеле.
2. Повторная лапаротомия, пересечение тощей кишки выше анастомоза, образованного при первой лапаротомии, ушивание приводящего конца кишки (искусственного пищевода) в желудок и зашивание отводящего конца кишки.
3. Выделение шейной части пищевода продольным разрезом на левой половине шеи, пересечение его, ушивание отводящего конца и соединение приводящего с подведенной кишкой. Для успешного завершения всех трех этапов операции требуется предварительное образование желудочного свища для питания больного.
С. С. Юдин внес изменения в операцию Ру — Герцена, Он исключил второй этап операции, т. е. не соединял искусственный пищевод с желудком, чем исключалось прохождение пищи через желудок, а этим самым желудок выключался из акта пищеварения. Таким образом, это изменение шло в разрез с физиологией пищеварения, и в настоящее время все хирурги от него отказались.
Второе изменение заключалось в том, что С. С. Юдин отказался от пересечения шейной части пищевода и соединение его с подведенной кишкой стал производить бок в бок. В случаях, где сужение пищевода начинается более низко, соединение его с подведенной кишкой бок в бок имеет отрицательную сторону: ниже анастомоза остается слепой мешок, в котором скапливается и задерживается пища. Иногда это причиняет пострадавшему боль.
Существующие методы пластики пищевода можно разбить на 4 группы:
1) тотальная предгрудинная пластика из кожи;
2) тотальная предгрудинная пластика из кишки (тонкой, толстой) и желудка;
3) комбинированные способы предгрудинной пластики (кишечно-кожная, желудочно-кожная);
4) загрудинная (трансмёдиастинальная) пластика пищевода;
5) внутригрудная пластика.
Тотальная пластика из кожи. После предварительного создания желудочного свища (гастростомия — первый этап) на передней поверхности грудной стенки производятся два параллельных разреза, внутренние края которых после частичной отсепаровки сшиваются поверх резиновой трубки в виде цилиндра. Наружные края этого же разреза сшиваются поверх вновь образованного цилиндра. Во второй этап производится соединение орального конца кожной трубки с шейным отделом пищевода и дистального с желудком.
Недостатками этой операции являются трудности герметического смыкания кожной трубки с пищеводом и, особенно, желудком, развитие на этой почве свищей, а также развитие упорных дерматитов внутри кожной трубки.
Тотальная предгрудинная пластика из кишки. Наибольшее распространение в СССР и ряде стран мира благодаря работам С. С. Юдина и его учеников получила операция предгрудинной пластики из тонкой кишки (операция Ру—Герцена—Юдина). Операция производится больным с оформленным заранее желудочным свищом.
Производится срединная верхняя лапаротомия (при условии расположения желудочного свища по левой параректальной линии). Отступя на 8—10 см от flexura duodenojefunalis, мобилизуется петля тонкой кишки с обязательным сохранением артериальных аркад ее брыжейки, обеспечивающих ей надежное питание. После мобилизации петли кишки, длина которой достаточна для выведения ее из эпигастральной области на шею, верхний конец пересекается, кишечный конец закрывается наглухо кисетным швом, а короткий дуоденальный отрезок анастомозируется конец в бок с отводящим коленом мобилизованной кишки (У-образное соустье). С помощью специальных подкожных расширителей создается подкожный предгрудинный туннель, в который проводится мобилизованная петля кишки и фиксируется к коже шеи. Нормальный цвет кишки, сохранение перистальтики являются непременным условием для успеха пластики. Через 5— 7—10 дней производится под местной анестезией соединение шейного отдела пищевода с выведенной кишкой.
С успехом может быть использована в целях пластики правая половина толстой кишки или поперечно-ободочная кишка, имеющая мощные сосудистые аркады.
В тех случаях, где по анатомическим особенностям не удается мобилизовать участок кишки достаточной длины, последнюю выводят на соответствующий уровень грудной клетки, надставляя недостающий отрезок кишки кожной трубкой (комбинированная пластика — III тип).
Загрудинная (трансмедиастинальная) пластика. При этой операции мобилизованная петля кишки проводится сзади грудины через переднее средостение на шею, где соединяется с пищеводом выше уровня препятствия. Физиологические и косметические преимущества этой операции очевидны. Недостатками являются значительные трудности в ее выполнении и опасность некроза мобилизованной кишки внутри средостения с последующим развитием медиастинита.
Кардиоспазм (ахалазия кардии). Классификация. Клиника. Диагностика. Дифференциальный диагноз. Принципы лечения. Кардиодилатация. Показания к операции и виды вмешательств.
Ахалазия кардии — одно из наиболее распространенных нервно-мышечных заболеваний пищевода. Основными клиническими проявлениями его являются дисфагия и регургитация, возникающие вследствие стойкого нарушения рефлекторного открытия кардии при глотании, изменения перистальтики и ослабления тонуса стенки пищевода. установлено, что ведущими этиологическими факторами заболевания являются конституциональные неврастении с предрасположенностью к возникновению под влиянием всевозможных внешних раздражителей неврогенной дпекоординации моторики пищевода, в том числе и его терминального отдела; рефлекторные дисфункции пищевода с формированием ахалазии кардиально-го сфинктера; врожденные аномалии развития нервного аппарата и пищевода, предрасполагающие к развитию болезни при определенных условиях; инфекционно-ток-сические или вирусные поражения нервных сплетений пищевода и кардии.
В начале заболевания нарушение проходимости кардии имеет чисто функциональный характер, что доказывается и фармакологическими пробами (с нитроглицерином и ацетилхолином). В дальнейшем нарастают рубцово-воспалительные изменения в стенке пищевода и кардии, стенка кардиального сегмента пищевода становится ригидной, малоэластичной, плохо растягивается, не поддается лекарственной терапии. Непропульсивные сегментарные сокращения пищеводной стенки не в состоянии протолкнуть пищевой комок сквозь функциональный барьер в виде нерасслабившего-ся нижнего пищеводного сфинктера. Вследствие этого проглатываемая пища надолго задерживается в пищеводе и поступает в желудок только при заполнении пищевода до определенного уровня, когда под влиянием гидростатического давления столба жид-кости в пищеводе происходит механическое насильственное раскрытие кардии, не связанное с глотанием.
Длительный застой пищевых масс, слюны и слизи в пищеводе вызывает ряд дополнительных его изменений в виде расширения просвета органа, эзофагита, пери-эзофагита. Это в свою очередь еще больше усугубляет нарушение перистальтики пищевода.
Известен ряд классификаций ахалазии кардии. В основу большинства из них положены клинико-рентгенологические и морфологические признаки, длительность заболевания, присоединяющиеся инфекции. Т. А. Суворова (1959) предложила выделять два типа ахалазии кардии: при первом типе нижний отрезок пищевода сужен, отмечается одновременная дистрофия и гипертрофия его циркулярных мышечных волокон. Вышележащий отдел пищевода умеренно расширен, весь орган имеет цилиндрическую или веретенообразную форму. При втором типе нижний отрезок пищевода резко сужен, мышечная оболочка его атрофична, имеются прослойки грубоволокнистой соединительной ткани. Вышележащие отделы пищевода резко расширены, диаметр его может Достигать 16-18 см. Стенка органа чаще всего умеренно утолщена за счет гипертрофии мышечного слоя, а в некоторых случаях атрофична. Часто пищевод имеет S-образную форму.
В дополнение А. Л. Гребнев (1969) выделяет три стадии развития заболевания:
/ стадия — субкомпенсации (периоды дисфагии редки и не нарушают самочувствия и общего состояния больного);
// стадия — декомпенсации (значительная задержка пищевых масс в пищеводе, нарушается питание, уменьшается масса тела больного, нередко наблюдается частая и обильная регургитация; угроза возникновения легочных осложнений);
III стадия — резкой декомпенсации (резко нарушено питание, кахексия, дистрофические изменения органов, дегидратация, авитаминоз).
. Основу клинической картины ахалазии кардии составляют дисфагии, регургитации и боли.
Наиболее ранним и характерным симптомом является дисфагия. В большинстве случаев она развивается постепенно. Дисфагические проявления, вначале неотчетливые и редкие, с течением времени возникают все чаще и становятся яснее, пока не принимают постоянного характера. Различные неблагоприятные факторы (спешка, заглатывание плохо пережеванных кусков пищи, питье холодной воды и др.) ведут к еще большему усилению расстройств глотания. Дисфагия также усиливается вследствие отрицательных эмоций, волнений, переживаний, излишнего внимания окружающих.
На фоне прогрессирования заболевания больными вырабатываются различные приемы, облегчающие прохождение пищи в желудок, — заглатывание воздуха во время еды, глубокие вдохи с натуживанием, запрокидывание головы назад, энергичная ходьба, подпрыгивание на месте.
У большинства больных с ахалазией кардии наблюдается регургитация. В поздних стадиях заболевания, когда пищевод расширен и вмещает до 2 л жидкости, она бывает более редкой, но обильной. Иногда она возникает через 2-4 ч после еды,
особенно при сильном наклоне туловища или в положении лежа. У больных со вторым типом ахалазии кардии регургитация наблюдается во время сна, нередко с по-перхиванием и приступами судорожного мучительного кашля, возникающими из-за аспирации пищевых масс в дыхательные пути.
Чувство давления и боли за грудиной также являются частыми симптомами ахалазии кардии.^Они обусловлены, главным образом, растяжением пищевода, его нервных сплетений, сдавлением нервных структур средостения. По мере расширения пищевода интенсивность болей уменьшается, появляются тупые, распирающие болевые ощущения за грудиной. При присоединении эзофагита появляется жжение по ходу пищевода, повышенное слюноотделение, неприятный запах изо рта.
Почти у всех больных с течением времени отмечается более или менее значительное похудание.
Развитию эзофагита, в различной степени выраженного, способствуют длительный застой в пищеводе пищевых масс, слизи, возникновение в них гнилостных процессов с последующим инфицированием стенки органа и кровотечением. Длительный эзофагит с задержкой пищевых масс благоприятствует возникновению рака пищевода.
Периодическое длительное затекание в дыхательные пути содержимого пищевода при регургитации способствует формированию хронического бронхита, аспирацион-ной пневмонии, абсцесса легкого, бронхоэктазов.
Диагностика ахалазии кардии помимо клинических проявлений основывается на данных лучевого исследования, эзофагоскопии и эзофагоманометрии, фармакологических проб.
Наиболее информативным является рентгенологический метод, позволяющий точно установить диагноз у подавляющего большинства больных с ахалазией кардии. Основными скиалогическими симптомами данного заболевания, которые обнаруживаются при рентгеноконтрастном исследовании пищевода, являются сужение пищеводно-желудочного перехода, затруднение прохождения контрастного вещества в этой области и диффузное расширение проксимальных отделов пищевода.
Дифференцировать ахалазию кардии следует с раком пищеводно-желудочного перехода и Рубцовым стенозом этой области. В пользу ахалазии свидетельствуют наличие складок слизистой оболочки в зоне сужения, резкое диффузное расширение всего пищевода выше сужения, отсутствие газового пузыря желудка, многолетний анамнез заболевания.
Эзофагоскопия в сомнительных случаях позволяет уточнить диагноз или провести дифференциальную диагностику с другими клинически схожими заболеваниями.
Лечение. Консервативное лечение ахалазии кардии, имеющее обычно временный эффект, применяют в начальных стадиях заболевания. Оно включает диету (кашицеобразная, химически щадящая пища с достаточным количеством белков и витаминов), местные анестетики, спазмолитики, м-холинолитики, витамины, седативные препараты, физиотерапию.
В случаях развивающегося заболевания с четкой клинической картиной применяют кардиодилатанию или оперативное лечение.
Кардиодилатацию чаще применяют в I, II стадиях заболевания. Противопоказанием к кардиодилатацин являются тяжелая сердечная недостаточность, хроническая ишемическая болезнь сердца с частыми приступами стенокардии, варикозное расширение вен пищевода, выраженный эзофагит, стеноз привратника, поздние сроки беременности, заболевания, сопровождающиеся пониженной свертываемостью крови и повышенной кровоточивостью.
Перед выполнением кардиодилатации тщательно промывают пищевод дезинфицирующим раствором и отсасывают его содержимое через зонд. Подкожно вводят 1 мл 1% раствора промедола и 1 мл 0,1% раствора атропина. Смазывают глотку и корень языка 1% раствором дикаина в дозе 1 мл на 10 кг массы больного. Под рентгенологическим контролем вводят в пищевод и правильно устанавливают кардио-дилататор. Расширение кардии продолжается 10-25 мин.
При использовании дилататора Штарка раскрывают бранши, а при применении пневмо- или гидрокардиодилатации под определенным давлением в баллон нагнетают воздух или воду. Через 2-4 дня проводят повторные сеансы. Общее число их составляет от 2 до 7.
Наиболее тяжелыми осложнениями кардиодилатации являются перфорация и разрыв пищевода, кровотечение из органа.
Хирургическое лечение ахалазии кардии в значительной степени является симптоматическим, устраняющим главное страдание — непроходимость пищеводно-желу-дочного перехода.
Наибольшее распространение получили различные варианты внеслизистой эзофа-гокардиомиотомии — операция Геллера.
Техника видоизмененной эзофагокардиомиотомии по Геллеру сводится к следующему. Выполняют верхнюю серединную лапаротомию. Рассекают левую треугольную связку печени и отводят ее левую долю. Диафрагму рассекают кверху на 4-5 см, предварительно прошив и перевязав нижнюю диафрагмальную вену. Выделяют пищевод до расширенной его части и берут на держалку. Переднюю стенку пищевода рассекают до слизистой от расширенной его части до перехода в желудок. Длина расширения мышц пищевода и желудка должна быть не менее 8-10 см. Разрез на пищеводе не зашивают. Диафрагму ушивают.
Недостаточность кардии. Рефлюкс-эзофагит. Клиника. Диагностика. Осложнения. Дифференциальный диагноз. Показания к оперативному лечению. Виды операций.
Недостаточность кардии — синдром, возникающий вследствие нарушения физиологического механизма запирания кардии.
Чаще наблюдается при аксиальных грыжах пищеводного отверстия диафрагмы вследствие смещения нормального сфинктера из пищеводного отверстия в грудную полость, отсутствия подкрепляющего действия диафрагмальных ножек и сглаживания пищеводно-желудочного угла. Встречается также после операций, сопровождающихся резекцией или повреждением кардиального сфинктера, при системном прогрессирующем склерозе (склеродермии) вследствие атрофии гладких мышц зоны кардии.
При язвенной болезни, холелитиазе и в некоторых других случаях может иметь место относительная, т. е. функциональная, недостаточность кардии из-за спастического сокращения привратника и гипертонуса желудка, повышения внутрижелудочного давления. Наблюдается также при беременности, больших опухолях брюшной полости, асците вследствие значительного повышения внутрибрюшного давления.
Клиника. Основными симптомами являются отрыжка воздухом и срыгивание желудочным содержимым (при наклоне туловища, в положении лежа). При сохраненной секреции желудочного сока возникает рефлюкс-эзофагит, имеющий свою характерную симптоматику.
Диагноз. Рентгенологическое исследование позволяет определить желудочно-пищеводный рефлюкс как проявление недостаточности кардии. Однако исследование нужно проводить и в положении пациента лежа с применением специальных диагностических приемов, повышающих внутрибрюшное давление (натуживание, покашливание, давление тубусом на эпигастрий и т. д.). Эзофагоскопия позволяет выявить недостаточность кардии и рефлюкс-эзофагит. Тонус кардиального сфинктера можно точно оценить методом графической регистрации внутрипищеводного давления — эзофаготонокимографией. Желудочно-пищеводный рефлюкс можно выявить при рН-метрии пищевода и пробой с метиленовым синим, раствор которого вводят в желудок, а затем с помощью зонда откачивают содержимое пищевода; появление окрашенной жидкости подтверждает рефлюкс.
Осложнения: развитие рефлюкс-эзофагита, пептической язвы и стриктуры пищевода, пищеводных кровотечений из воспаленной слизистой.
Лечение прежде всего направлено на предупреждение желудочно-пищеводного рефлюкса. Рекомендуется ограничение физических нагрузок, связанных с напряжением брюшного пресса и наклонами туловища. Спать рекомендуется с высоко приподнятым изголовьем. Лечение также включает терапию рефлюкс-эзофагита. При отсутствии эффекта и возникновении осложнений прибегают к хирургическому лечению: выполняют фундопликацию (подшивание желудка к диафрагме вокруг пищеводного отверстия с фиксацией его малой кривизны к брюшной стенке для восстановления острого угла между дном желудка и брюшной часть пищевода), пилоропластику (хирургическая операция: рассечение стенки привратника или иссечение ее участка с последующим ушиванием образовавшегося дефекта;), селективную ваготомию.
Рефлюкс-эзофагит — это развитие воспалительного поражения пищевода вследствие повторяющегося заброса в пищевод желудочного содержимого.
Проявления рефлюкс-эзофагита выявляют почти у половины взрослого населения, эндоскопические признаки — более чем у 10% лиц, подвергшихся эндоскопическому исследованию. Пищевод Берретта развивается у 20% больных рефлюкс-эзофагитом (0,4% населения).
Классификация рефлюкс-эзофагита
Степень А — одно (или более) поражение слизистой оболочки менее 5 мм, ограниченное пределами складки слизистой оболочки
Степень В — одно (или более) поражение слизистой оболочки более 5 мм, ограниченное пределами складки слизистой оболочки
Степень С — одно (или более) поражение слизистой оболочки, распространяющееся на 2 и более складки слизистой оболочки, но занимает менее 75% окружности пищевода
Степень D — одно (или более) поражение слизистой оболочки, распространяется на 75% и более окружности пищевода.
Проявления рефлюкс-эзофагита
Изжога — наиболее характерный признак (испытывают 83% больных), появляется в результате длительного контакта кислого желудочного содержимого со слизистой оболочкой пищевода. Изжога усиливается при погрешностях в диете, приёме алкоголя, газированных напитков, физическом напряжении, наклонах и в горизонтальном положении. Отрыжка, усиливается после еды, приёма газированных напитков. Срыгивание пищи, усиливается при физическом напряжении .Нарушение глотания. Боли в подложечной области или за грудиной — появляются вскоре после еды, усиливаются при наклонах туловища, в горизонтальном положении. Реже возникают ощущение кома в горле при глотании, боль в ухе и нижней челюсти, боли в грудной клетке, которые могут провоцироваться физической нагрузкой. Внепищеводные проявления — хронический кашель, пневмония, осиплость голоса, кариес зубов и т.д.
Диагностика рефлюкс-эзофагита
Рентгенологическое исследование лёжа на спине или в вертикальном положении при сильном наклоне пациента кпереди: заброс сульфата бария в пищевод
Эндоскопическое исследование с биопсией
Эзофаготонокимография (манометрия)
Суточная рН-метрия — основной метод контроля эффективности лечения.
Билиметрию проводят для выявления щелочных (жёлчных) рефлюксов
Сцинтиграфия показана для выявления моторно-эвакуаторных нарушений пищевода
Омепразоловый тест
Тест Бернстайна
Лечение рефлюкс-эзофагита
Прекращение курения
Нормализация массы тела
Подъём головного конца кровати
Избегать нагрузки на мышцы брюшного пресса, работы с наклоном туловища, ношения тугих поясов, ремней
Нежелателен приём лекарственных средств, снижающих тонус пищеводного сфинктера (нитраты, антагонисты кальция, теофиллин, прогестерон, антидепрессанты)
Диета: ограничение продуктов, усиливающих газообразование, острой, очень горячей или холодной пищи; избегать приёма алкоголя, продуктов, снижающих тонус нижнего пищеводного сфинктера (лук, чеснок, перец, кофе, шоколад и др.); избегать переедания, последний приём пищи — не позднее чем за 3—4 часа до сна.
Лекарственную терапию проводят не менее 8—12 недель с последующей поддерживающей терапией в течение 6—12 месяцев. Применяют ингибиторы протонного насоса (омепразол, лансопразол, рабепразол) в обычной или двойной дозировке, антациды (альмагель, фосфалюгель, маалокс, гелусил-лак и др.) назначают обычно через 1,5—2 часа после еды и на ночь. Прокинетики — домперидон, метоклопрамид.
Хирургическое лечение. Показания к оперативному лечению: осложнения рефлюкс-эзофагита (стриктуры пищевода, повторные кровотечения, пищевод Берретта), неэффективность медикаментозной терапии (в течении 6 месяцев) у молодых пациентов, сочетание рефлюкса с бронхиальной астмой
Доброкачественные опухоли и кисты пищевода. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Лечение.
Доброкачественные опухоли пищевода встречаются довольно редко. Они составляют всего 0,5—5 % от всех опухолевых поражений пищевода. Наиболее часто различные доброкачественные опухоли пищевода встречаются у людей в возрасте 25—60 лет, болеют преимущественно мужчины. В настоящее время этиология этих заболеваний неизвестна, за исключением некоторых видов кист пищевода, являющихся врожденными пороками развития.
Патологическая анатомия. По своему происхождению выделяют эпителиальные и неэпителиальные доброкачественные опухоли и кисты.
По форме роста выделяют внутрипросветные опухоли — аденомы, папилломы, фибромы, липомы и внутристе-ночные — прочие виды опухолей.
Клиника. Клинические проявления болезни обусловлены формой роста опухоли, ее размерами и локализацией. В значительно меньшей степени клиника заболевания связана с гистологической структурой. Следует отметить, что нет строгого параллелизма между величиной опухоли и выраженностью клинической картины. Иногда даже крупные опухоли длительное время протекают бессимптомно и являются случайной находкой при рентгенологическом, эндоскопическом исследовании пищевода или на вскрытии. Реже при небольших опухолях больные жалуются на довольно сильные спастические боли за грудиной или в эпигастральной области, дисфагию, что связано с функциональными расстройствами моторики пищевода и эзофагоспазмом.
Более значительное влияние на клиническую картину заболевания оказывает форма роста опухоли. При внутрипросветных опухолях пищевода ведущим симптомом болезни является дис фагия, как правило, незначительная или умеренно выраженная. Нарастание степени дисфагии происходит медленно, по мере роста самой опухоли.
Вторым по частоте симптомом является тупая боль умеренной интенсивности, локализующаяся за грудиной. Боль усиливается при приеме пищи. Среди других клинических проявлений внутрипросветных опухолей следует отметить тошноту, слюнотечение, срыгивание, ощущение инородного тела за грудиной. При больших размерах внутрипросветных опухолей дисфа-гия может быть достаточно выраженной, нередко возникает рвота, больные теряют в массе тела. Однако выраженных нарушений общего состояния пациентов обычно не наступает. Полной непроходимости пищевода вследствие доброкачественных внутрипросветных опухолей, как правило, не бывает.
Внутрипросветные опухоли локализуются чаще всего в верхней трети пищевода. Нередко аденомы, папилломы и липомы располагаются на довольно длинной ножке и при рвоте могут мигрировать из пищевода в просвет гортани, вызывая асфиксию, иногда даже со смертельным исходом.
Внутристеночные опухоли обычно локализуются в нижней половине пищевода, длительное время протекают бессимптомно. Лишь по достижении опухолью значительных размеров возникает дисфагия, являющаяся наиболее частым симптомом заболевания. Полной непроходимости пищевода, как правило, не бывает, за исключением случаев, когда опухоль циркулярно охватывает пищевод.
Среди прочих клинических проявлений внутристеночных опухолей наиболее часто наблюдается тупая боль за грудиной или в области мечевидного отростка, тошнота, снижение аппетита. Общее состояние больных обычно не нарушается. При преимущественно экстраэзофагеальном росте опухоли, при ее больших размерах могут наблюдаться симптомы, связанные с компрессией органов средостения — постоянные тупые боли за грудиной, сухой кашель, одышка, нарушение сердечного ритма, осиплость голоса.
Кисты пищевода. Занимают второе место по частоте среди всех доброкачественных опухолей пищевода. Наиболее частая их локализация — нижняя часть пищевода. Большинство кист пищевода являются врожденными. Они представляют собой тонкостенные образования, содержащие прозрачную желтоватую или опалесцирующую жидкость. Наружная стенка кисты представлена фиброзной и гладкомышечной тканью, внутренняя — плоскоклеточным или цилиндрическим, мерцательным (при бронхоген-ных кистах) эпителием. Содержимое кисты определяется морфологической структурой ее внутренней оболочки. Оно может быть серозным, слизистым, серозно-гнойным, желеобразным. Во всех случаях в содержимом кисты определяются слущенные эпителиальные клетки. Если внутренний слой кисты представлен желудочной слизистой оболочкой, довольно часто содержимое ее приобретает геморрагический или бурый оттенок. В этих случаях за счет активной секреции желудочного сока киста может быстро увеличиваться в размерах, вызывая сдавление жизненно важных органов средостения с характерной клинической симптоматикой (компрессионный синдром). Нередко наблюдаются изъязвление и кровотечение в просвет кисты. При инфицировании микробной флорой кисты могут нагнаиваться. Описаны случаи и их злокачественной трансформации, что наблюдается и при других доброкачественных новообразованиях пищевода у 10 % больных.
Диагностика. Объективное исследование, как правило, не выявляет специфических симптомов доброкачественных опухолей пищевода. При больших размерах их могут выявляться притупление перкуторного звука в задних отделах легких, а также типичные проявления компрессионного синдрома. Основными способами инструментальной диагностики являются рентгенография пищевода, эзофагоскопия и компьютерная томография.
При рентгенологическом исследовании внутрипросветные опухоли представляются в виде локального утолщения одной из складок (на ранней стадии развития) или округлого дефекта наполнения на широком основании или на ножке. Очертания его резкие, иногда мелковолнистые. Структура тени папилломы может быть сетчатой ввиду соеочкового характера ее поверхности. Складки слизистой оболочки утолщены и огибают полип. Перистальтика не нарушена, задержка контрастной массы бывает лишь при больших размерах новообразования или при локализации его в брюшной части пищевода над кардиальной частью желудка. При глотании образование смещается вместе со стенкой пищевода в проксимальном направлении.
При внутристеночных опухолях складки слизистой оболочки сохранены, могут лишь огибать опухоль и обычно сужены или уплощены. Сама опухоль дает краевой дефект наполнения с ровными контурами. Перистальтика и эластичность пищевода в зоне проекции новообразования сохранены. Если опухоль растет из мышечной оболочки и привела к атрофии ее, наблюдается перерыв перистальтики. Опухоль обычно хорошо смещается при глотании. При преимущественно экстраэзофагеальном росте и связи ее с органами средостения смещаемость ограничена. Наиболее частый симптом — краевой дефект наполнения с четкими ровными контурами. В отличие от дефекта наполнения вследствие сдавления пищевода извне, со стороны окружающих органов доброкачественные опухоли не вызывают смещения пищевода. Отличительной особенностью их является наличие четкого угла между стенкой неизмененного пищевода и краем опухоли (симптом козырька), выявляемого в боковой проекции. На хороших рентгеновских снимках и томограммах (в особенности компьютерных) удается получить изображение той части опухоли, которая вдается в окружающую медиастинальную клетчатку. При крупных опухолях наблюдается веретенообразное расширение вышележащих отделов пищевода.
При преимущественно экстраэзофагеальном росте опухоли ее взаимосвязь с окружающими органами средостения может быть изучена с помощью пневмомедиастинографии. В этих случаях рентгенологическое исследование выполняют после введения газа (кислород) в средостение. Более полную информацию дает компьютерная томография. Этот способ исследования дает возможность дифференцировать кисты пищевода (которые слабее поглощают рентгеновское излучение) от солидных опухолей.
Всем больным с подозрением на опухоль пищевода показана эзофагоскопия. При внутрипросветных опухолях выявляют округлые образования, покрытые малоизмененной слизистой оболочкой. Во время их инструментальной пальпации возможна умеренная кровоточивость слизистой оболочки. Прицельная биопсия с последующим морфологическим исследованием материала позволяет установить окончательный диагноз, верифицировать гистологическую структуру опухоли.
Для внутристеночных опухолей характерно наличие образования, выступающего в просвет пищевода. Слизистая оболочка над ним, как правило, не изменена, рельеф ее сохранен или несколько сглажен. При изъязвлении опухоли можно обнаружить дефект слизистой оболочки. Следует подчеркнуть, что при наличии ин-тактной слизистой оболочки над новообразованием биопсию при выполнении эзофагоскопии производить не надо. Это связано с тем, что при оперативном лечении внутристеночных опухолей обычно удается вылущить опухоль без повреждения покрывающей ее слизистой оболочки. Если же ранее больному была произведена эзофагобиопсия, при выделении опухоли легко травмируется слизистая оболочка, вскрывается просвет пищевода, что значительно увеличивает риск возникновения послеоперационных осложнений. Поэтому клиническое применение биопсии показано лишь при внутрипросветных опухолях и при изъязвленных внутристеночных образованиях, когда слизистая оболочка над опухолью уже разрушена.
Дифференциальная диагностика. Ее необходимо проводить прежде всего со злокачественными опухолями пищевода. Учитывая, что клинические проявления этих групп заболеваний довольно схожи и чаще всего проявляются в виде дисфагии, большое внимание должно быть уделено анамнезу болезни. Более молодой возраст больного, длительное течение заболевания без признаков интоксикации и кахексии свидетельствуют в пользу доброкачественного поражения пищевода. Тем не менее наибольшее значение в дифференциальной диагностике доброкачественных и злокачественных опухолей пищевода имеют инструментальные методы исследования, прежде всего эндоскопическое исследование. В редких случаях окончательный диагноз устанавливают на основании данных интраоперационных находок или морфологического исследования удаленного препарата (экстренного или планового).
Лечение. Лечение доброкачественных опухолей пищевода только оперативное. Показанием к операции является реальная возможность злокачественного перерождения, развития компрессионного синдрома, кровотечения и других осложнений.
Внутрипросветные опухоли, располагающиеся на ножке, могут быть удалены с помощью эндоскопа электроэксцизией. При внутристеночных опухолях обычно выполняют торакотомию и энуклеацию опухоли с последующим восстановлением целости мышечной оболочки пищевода. Во время выделения опухоли из окружающих тканей необходимо стремиться не повредить слизистую оболочку во избежание развития гнойных осложнений в послеоперационном периоде в результате недостаточности наложенных швов. При опухолях больших размеров со значительным разрушением мышечной оболочки пищевода в редких случаях приходится выполнять резекцию пораженного участка органа с последующей пластикой его тонкой или толстой кишки или наложением эзофаго-гастроанастомоза (при локализации опухоли в нижней трети пищевода) .
Рак пищевода. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Показания и противопоказания к хирургическому лечению. Подготовка, доступы, анестезия, виды операций. Органы для эзофагопластики. Пути проведения трансплантата по отношению к грудной клетке и плевральной полости.
Среди всех злокачественных новообразований рак пищевода составляет около 4—6 %. В нашей стране он занимает 6—7-е место среди злокачественных опухолей и 3-е место в структуре причий смертности от онкологических заболеваний, уступая лишь раку желудка и раку легкого. Заболевание встречается чаще всего у лиц в возрасте старше 60 лет, женщины болеют в 2—5 раз реже мужчин. У 65 % больных опухоль локализуется в средней трети пищевода, у 25 % — в нижней его трети и у 10 % пациентов — в верхней трети. Особенно часто опухоль располагается в местах физиологических сужений пищевода.
Классификация. Различают следующие стадии рака пищевода:
0 стадия — так называемая преинвазивная карцинома;
I стадия — четко ограниченная опухоль, прорастающая только слизистый и подслизистый слои; проходимость пищевода не нарушена; метастазы отсутствуют;
IIа стадия — опухоль прорастает мышечный слой и адвентицию; метастазы в регионарных лимфатических узлах отсутствуют;
IIб стадия — опухоль прорастает мышечный слой и адвентицию; имеются мета¬стазы в регионарных лимфатических узлах;
III стадия — опухоль занимает большую полуокружность пищевода или цирку¬
лярно охватывает его, прорастает всю стенку пищевода, спаяна с соседними органа¬
ми. Проходимость пищевода нарушена полностью; множественные метастазы в регио¬
нарных лимфатических узлах;
IV стадия - опухоль прорастает все слои стенки пищевода, выходит за его преде-
лы, пенетрируя в близлежащие органы; имеются множественные метастазы в регио¬
нарные лимфатические узлы и отдаленные органы.
Международная классификация рака пищевода предусматривает характеристи опухоли по системе TNM, учитывая при этом следующие факторы: первичную о КУ холь, глубину инвазии, состояние регионарных лимфатических узлов, отдаленнь метастазы. Эта классификация для рака пищевода является более удобной и точной
Т — первичная опухоль:
ТХ — недостаточно данных для оценки первичной опухоли;
ТО — первичная опухоль не определяется;
Tis — преинвазивная карцинома (carcinoma in situ);
Tl — опухоль инфильтрирует стенку пищевода до подслизистого слоя;
Т2 — опухоль инфильтрирует стенку пищевода до мышечного слоя;
ТЗ — опухоль инфильтрирует стенку пищевода до адвентиции;
Т4 — опухоль распространяется на соседние структуры.
N — регионарные лимфатические узлы:
NX — недостаточно данных для оценки регионарных лимфатических узлов;
N1 — нет признаков метастатического поражения;
N2 — имеется поражение регионарных лимфатических узлов метастазами.
М — отдаленные метастазы:
MX — недостаточно данных для определения отдаленных метастазов;
МО — нет признаков отдаленных метастазов;
M1 — имеются отдаленные метастазы.
Для опухолей нижнегрудного отдела пищевода:
M1a — метастазы в чревных лимфатических узлах;
M1b — другие отдаленные метастазы.
Для опухолей верхнегрудного отдела пищевода:
М1а — метастазы в шейных лимфатических узлах;
M1b — другие отдаленные метастазы.
Для опухолей среднегрудного отдела пищевода:
М1а — метастазы не определены;
М1b — нерегионарные лимфатические узлы и другие отдаленные метастазы.
Клиника и диагностика. Достоверный диагноз заболевания обычно устанавлива¬ется лишь при сопоставлении результатов комплексного исследования пищевода раз-личными методами и данными клиники. Важное значение имеют данные анамнеза, общее состояние больного. Внешний вид больного и данные объективного обследова-ния на ранних стадиях заболевания, как правило, не обнаруживают каких-либо патологических изменений. Поэтому основным методом диагностики рака пищевода является рентгенологическое исследование, при котором выявляются следующие характерные признаки: нарушение структуры рельефа слизистой, обнаружение де-фекта наполнения, наличие тени опухолевого узла, отсутствие перистальтики стенки пищевода. Достоверные представления о состоянии и особенностях стенок пищевода на различных уровнях могут быть получены при рентгенологическом исследовании в различных положениях, а также с помощью двойного контрастирования и парието-графии. Для определения распространения опухоли на соседние органы применяют рентгенологическое исследование в условиях пневмомедиастинума, рентгенографию в прямой, боковой и косой проекциях.
При этом могут быть выявлены призна¬
ки местного распространения рака, включающие извилистость опухоли, перегиб, рас¬
ширение, изгиб, свищи; при подозрении на наличие свища применяется водораствори¬
мый контраст. Для определения распространенности опухолевого процесса в средостении
весьма информативным методом является компьютерная рентгенотомография. Приме¬
нение этого исследования позволяет более четко определить размеры и границы опухо¬
левого поражения в средостении, оценить степень инфильтрации окружающих тканей
и связать новообразования с жизненно важными органами средостения, распространен¬
ность поражения регионарных лимфатических узлов. В некоторых случаях компью¬
терная рентгенотомография может быть дополнена париетографией.
Фиброэзофагоскопия показана всем больным с подозрением на рак пищевода. Эндоскопическое исследование позволяет улучшить визуальное представление о пи-щеводе, непосредственно увидеть и оценить опухоль, установить уровень поражения пищевода, форму опухоли, степень сужения пищевода, наличие распада или крово¬течения из опухоли. Обязательное взятие материала для цитологического и гистоло¬гического исследований позволяет в 96% случаев установить морфологическую струк¬туру опухоли
В клиническом проявлении рака пищевода выделяют три основные группы симп¬томов: местные, зависящие от поражения стенок пищевода; вторичные, возникающие в результате распространения процесса на соседние органы; общие симптомы. На ранних стадиях данное заболевание практически никак себя не проявляет и не имеет специфических симптомов.
Нарушение проходимости пищи (дисфагия) является первым и, по существу, поздним симптомом заболевания. Она связана с сужением его просвета опухолью, возникающим лишь при поражении опухолевым процессом не менее 2/3 периметра пищевода. Возникновению дисфагии могут предшествовать ощущение инородного тела, появляющееся при проглатывании твердой пищи, чувство царапанья за груди¬ной, прилипания пищи к поверхности слизистой пищевода. В начальном периоде заболевания дисфагия возникает при проглатывании плотной пищи. Больные ощу¬щают временную задержку пищевого комка на определенном уровне. Глоток воды обычно устраняет эти явления. В дальнейшем перестает проходить даже хорошо прожеванная пища, дисфагия становится постоянной и возникает даже при приеме жидкости.
Классификация дисфагии, предложенная А. И. Савицким:
I стадия — затруднение при глотании твердой пищи;
II стадия — затруднение при глотании кашицеобразной пищи;
III стадия — затруднение при глотании жидкости;
IV стадия — полная непроходимость.
или болезненность при глотании, — частый симптом рака пищевода, встречается в 33% случаев. Боли возникают во время приема пищи, локализуются за грудиной и носят постоянный и мучительный характер, могут иррадиировать в спи¬ну, шею. Возникновение болей обусловлено механическим травмированием пищей изъязвленной карциномы. Постоянные боли, не зависящие от приема пищи или уси¬ливающиеся после еды, обусловлены прорастанием опухоли в окружающие пищевод ткани и органы, развитием периэзофагита и медиастинита. Срыгивание пищей, или «пищеводная рвота», встречается у 23% больных. Появляется при значительном стенозировании просвета пищевода и скоплении пищи над местом сужения. Некото¬рые больные искусственно вызывают рвоту для снятия ощущения распираний за грудиной и болей, появляющихся во время еды.
Усиленное слюнотечение (гиперсаливация) возникает в 6-7% случаев и является результатом рефлекторного возбуждения блуждающих нервов. Общие проявления заболевания — слабость, прогрессирующее похудание — являются следствием голо¬дания и интоксикации.
Симптомы осложнения рака пищевода, возникающие вследствие распространения процесса на соседние органы, относятся к поздним проявлениям болезни и обычно свидетельствуют о неоперабельности опухоли. К ним относятся нарастающая дисфа-гия, мучительные боли, выраженная интоксикация. При прорастании возвратных нервов у больных развивается осиплость голоса, при поражении узлов симпатическо¬го нерва — синдром Горнера. Сдавление блуждающего нерва может вызвать бради-кардию, приступы кашля, рвоту. Переход опухоли на гортань сопровождается изме¬нением звучности голоса, появлением одышки и стридорозного дыхания. Анорексия, быстрое насыщение, тошнота и рвота манифестируют о распространении опухоли на желудок. Перфорация опухоли в средостение вызывает гнойный медиастинит, а при вовлечении в процесс магистральных сосудов практически во всех случаях приводит к смерти больного.
Дифференциальную диагностику следует проводить с теми заболеваниями, для которых ведущим симптомом является дисфагия. К таким заболеваниям относятся ахалазия кардии (кардиоспазм), рубцовое сужение пищевода и пептический стенози-рующий эзофагит, язвы и доброкачественные опухоли пищевода, склерозирующий медиастинит. Для послеожоговых стриктур и травм пищевода характерны длитель¬ный и стойкий анамнез и рентгенологическая картина стриктуры пищевода. У боль¬ных с пептическим эзофагитом и язвами пищевода в анамнезе имеется указание на наличие язвенной болезни, сопровождающейся симптомами рефлюкс-эзофагита.
Лечение. Основным методом лечения рака пищевода является оперативное удаление опухоли. Выбор метода лечения зависит от локализации опухоли, стадии процесса, наличия сопутствующих заболеваний. Операции при раке пищевода относятся к одним из наиболее сложных вмешательств на органах желудочно-кишечного тракта. По топографо-анатомическим отношениям наиболее выгодным является правосторонний чресплевральный доступ, предложенный еще В. О. Добромысловым. Значительно более вариабельным является вопрос о пластике резецированного пищевода. Наиболее часто для эзофагопластики используются различные отделы толстой кишки и желудок, целый и в виде стебельчатых трансплантатов. Наиболее предпочтительными для замещения пищевода при раке являются различные варианты эзофагогастропластики. Широкое распространение получил способ замещения пищевода в изоперистальтическом положении целым желудком либо изоперистальтическим стеблем из большой кривизны желудка. Тонкокишечная эзофагопластика в настоящее время используется редко из-за большого числа осложнений, частой незавершенности, неудовлетворительных функциональных результатов. Значительно чаще применяется замещение пищевода толстой кишкой, что объясняется устойчивым кровоснабжением, возможностью тотального замещения пищевода.
Немаловажным аспектом эзофагопластики является выбор пути проведения транс-плантата: антероторакальный, ретростернальный, внутриплевральный и заднемедиастинальный
Антероторакальное проведение трансплантат исторически связано с именами Ру (Roux-en-Y), П. А. Герцена, С. С. Юдина, использовавших подкожный путь при тон-кокишечной эзофагопластике. Чресплевральный путь проведения трансплантата счи-тается наиболее целесообразным у больных раком пищевода, так как позволяет наименее травматично объединить два этапа операции — удаление пищевода и его пластику. Хорошие результаты хирургического лечения оказываются в I стадии забо-левания и значительно худшие — при операциях во II-III стадиях. К сожалению, рак пищевода редко диагностируется рано, и больные, как правило, обращаются за помо-щью в поздней стадии заболевания. Таким образом, радикальное оперативное лечение удается выполнить лишь у сравнительно небольшого числа больных. При раке шей-ного и верхнегрудного отделов пищевода опухоль быстро прорастает в окружающие ткани. При этой локализации опухоли методом выбора при лечении считается луче-вая терапия. При раке среднегрудного отдела пищевода методом выбора является одномоментная резекция пищевода с наложением соустья между оставшейся частью проксимального отдела пищевода и перемещенным в плевральную полость или заднее средостение желудком (операция типа Льюиса). Во всех случаях выполняется широ-кая лимфаденэктомия средостения с удалением всех групп лимфатических узлов. При наличии противопоказаний к одномоментным операциям выполняется много-этапная операция Добромыслова-Торека. В этих случаях из чресплеврального досту-па удаляют грудной отдел пищевода и накладывают гастростому. Спустя 3-6 месяцев создают искусственный пищевод из толстой или тонкой кишки. Необходимо подчерк¬нуть, что, несмотря на хорошие непосредственные результаты многоэтапных опера-ций, неудовлетворительным остается показатель завершенности лечения, так как вследствие прогрессирования основного заболевания восстановить непрерывность пи-щеварительного тракта удается только одному из трех больных.
Применение комбинированного (лучевого и хирургического) лечения существенно не улучшило отдаленные результаты, а в некоторых случаях результаты оказались хуже. Тем не менее оно применяется, особенно во П-Ш стадиях заболевания. Суще-ствуют различные методики предоперационного облучения, при котором суммарная очаговая доза (СОД) составляет от 25 до 40 Гр.
При неоперабельных опухолях при наличии противопоказаний к радикальному лечению выполняются различные паллиативные операции с целью восстановления про¬ходимости пищевода. К ним относятся паллиативная резекция пищевода, реканализа-ция опухоли, наложение гастростомы. При наличии метастазов опухоли в отдаленных лимфатических узлах лучевое лечение нецелесообразно. При невозможности выполне¬ния хирургического и лучевого лечения может быть применена химиотерапия.
Язвенная болезнь желудка. Клиника. Диагностика. Дифференциальный диагноз. Классификация Джонсона. Осложнения. Показания и противопоказания к хирургическому лечению. Методы операций.
. Язвенная болезнь — хроническое рецидивирующее заболевание, характеризующееся образованием язвы в желудке или двенадцатиперстной кишке вследствие расстройства общих и местных механизмов нервной и гормональной регуляции основных функций гастродуоденальной системы, нарушения трофики слизистой оболочки
 В
соответствии с
классификацией
английского хирурга Н. Johnson
(1956) различают
три типа язвы желудка (I,
И, Щ), которая в последующем была дополнена
понятиями
IV
и V
типов заболевания (А. М. Flynn,
1998).
В
соответствии с
классификацией
английского хирурга Н. Johnson
(1956) различают
три типа язвы желудка (I,
И, Щ), которая в последующем была дополнена
понятиями
IV
и V
типов заболевания (А. М. Flynn,
1998).
Тип I. Язвы локализуются в теле желудка на малой кривизне, возникают, как правило, на фоне пониженной секреции соляной кислоты и составляют от 50 до 60% всех хронических язв желудка.
Тип II. Язвы локализуются на малой кривизне тела желудка и сочетаются с язвой двенадцатиперстной кишки. Возникают на фоне повышенной секреции соляной кислоты, составляют 5-10% всех хронических язв желудка и редко озлокаче-ствляются.
Тип III. Препилорические язвы желудка возникают на фоне повышенной секреции соляной кислоты, составляют приблизительно 20% всех хронических язв желудка.
Тип IV. Язвы локализуются в верхних отделах малой кривизны желудка около пищеводно-желудочного перехода. Встречаются менее чем в 10% случаев.
Тип V. Эти язвы описаны недавно. Развиваются вторично на фоне длительного приема нестероидных противовоспалительных средств. Имеют высокий риск осложнения кровотечением и перфорацией, до развития которых, как правило, протекают бессимптомно. Эффективная профилактика этих язв обеспечивается применением синтетических простагландинов (мизопростол и др.).
Ведущим симптомом в клинической картине хронической язвенной болезни явля¬ется боль в подложечной области. При язвах тела желудка боли чаще всего ощущают¬ся ближе к левому подреберью, появляются через 20-30 мин после еды и не отлича¬ются четкой сезонностью обострений. При язвах кардиальной и субкардиальной локализации боли, как правило, отмечаются в области мечевидного отростка и за грудиной, которые могут ошибочно приниматься за стенокардию. Частым симптомом язвенной болезни является рвота. При язвах, осложненных Рубцовым стенозом желудка или двенадцатиперстной кишки, рвота бывает обильной, но всегда приносит облегчение, вследствие чего больные охотно вызывают ее искусст¬венно, особенно при высокой кислотности желудочного сока. Из других диспептиче-ских симптомов у больных язвенной болезнью наблюдаются изжога, отрыжка, обыч¬но кислая, и срыгивание, которые чаще всего бывают обусловлены недостаточностью кардиального жома, так как язвенная болезнь очень часто сочетается со скользящей грыжей пищеводного отверстия диафрагмы. Аппетит у больных язвенной болезнью не только сохранен, но иногда даже повы¬шен. Однако у больных язвой желудка из-за ранних болей, связанных с едой, появ¬ляется страх перед приемом пищи, они ограничивают себя в еде и худеют
Клинический анализ крови. Клинический анализ крови при не осложненном течении язвенной болезни чаще всего остается без существенных изменений. Иногда отмечается незначительное повышение содержания гемоглобина и эритроцитов, но может обнаруживаться и анемия, свидетельствующая о явных или скрытых кровотечениях. Лейкоцитоз и ускорение СОЭ встречаются при осложненных формах язвенной болезни.
Анализ кала на скрытую кровь.
Исследование кислотообразующей функции желудка, которое проводится с помощью рН-метрии (в последние годы — с помощью суточного мониторирования внутрижелудочного рН). При язвах тела желудка и субкардиального отдела обычно отмечаются нормальные или сниженные показатели кислотной продукции.
Рентгенологический метод исследования. При рентгенологическом исследовании с двойным тугим контрастированием барием, обнаруживается прямой признак язвенной болезни — «ниша» на контуре или на рельефе слизистой оболочки и косвенные признаки заболевания.
Эндоскопический метод исследования. Наиболее информативным в диагностике язвенной болезни желудка и 12-перстной кишки является эндоскопическое исследование, которое визуально подтверждает наличие язвенного дефекта, позволяет уточнить его локализацию, глубину, форму, размеры, позволяет оценить состояние дна и краев язвы, выявить сопутствующие изменения слизистой оболочки. При проведении эндоскопического исследования имеется возможность произвести прицельную биопсию — «отщипывание» кусочка ткани из краев или дна язвенного дефекта посредством специального инструментария. Полученный таким образом биоптат (кусочек ткани) направляется на гистологическое исследование, которое позволяет выявить возможную раковую природу обнаруженного язвенного дефекта (язвенная форма рака желудка).
Биопсия с последующим гистологическим исследованием полученного материала.
Данное исследование дает возможность исключить злокачественный характер язвенного поражения.
Исследования наличия в слизистой оболочке желудка Helicobacter pylori.
Электрогастроэнтерография и антродуоденальная манометрия — позволяют выявить нарушения гастродуоденальной моторики.
Дифференциальную диагностику проводят с симптоматическими язвами желудка, изъязвленной опухолью (в том числе первично-язвенным раком), туберкулезной, сифилитической язвой; изъязвлениями при коллагенозах, амилоидозе. Особенностью язвенной болезни является характер болей (голодные, после еды через определенный срок, ночные), длительный анамнез заболевания с периодическими обострениями в весенне-осенние периоды, наличие хлористо-водородной кислоты в желудочном соке при исследовании.
Осложнения: кровотечение, перфорация, пенетрация, деформации и стенозы, перерождение язвы в рак, вегетативно-сосудистая дистония, спастическая дискинезия желчного пузыря, хронический холецистит, жировой гепатоз, реактивный панкреатит.
Лечение язвенной болезни до сих пор остается делом сложным. Консервативные и хирургические методы лечения нельзя противопоставлять, наоборот, они должны дополнять друг друга. Большинство больных язвенной болезнью лечатся терапевтами и только при безуспешности такого лечения, при развитии осложнений, приходится больных оперировать. При этом для достижения успеха хирургическое лечение должно сочетаться с терапевтическим пособием. Традиционные, выработанные десятилетиями, основные принципы консервативного лечения язвенной болезни сохраняются до настоящего времени. Эти принципы включают постельный режим при обострении заболевания, лечебное питание, богатое витаминами, лекарственные препараты, подавляющие желудочную секрецию н повышающие сопротивляемость слизистой оболочки желудка и двенадцатиперстной кишки, щелочи, санаторно-курортное лечение. В последнее десятилетие указанное лечение стали сочетать с эндоскопическими методами прямого воздействия на язву различными лекарственными препаратами, ускоряющими заживление язвы, в том числе некоторых ее осложненных форм.
При язвенной болезни желудка и двенадцатиперстной кишки, протекающей на Фоне инфицирования желудка Н. pylori, проводится так называемая эрадикационная антихеликобактерная терапия, включающая ингибиторы протонной помпы (омепра-зол и др.), препараты висмута и антибиотики (кларитромицин, тетрациклин, метро-нидазол и др.). Считается, что уничтожение (эрадикация) Н. pylori способствует быстрому заживлению язвы и удлиняет период ремиссии заболевания.
Все хирургические вмешательства по поводу язвы желудка и двенадцатиперстной кишки делятся на радикальные и паллиативные. К радикальным операциям (с неко¬торой долей условности) относятся резекция желудка и различные виды ваготомии в сочетании с дренирующими желудок операциями, антрумрезекцией и без них (СПБ). К паллиативным операциям относятся: ушивание перфоративной язвы, прошивание и иссечение кровоточащей язвы, перевязка магистральных сосудов желудка, изоли¬рованная пилоропластика и гастроеюностомия.
Единственным условием, при котором можно рассчитывать на заживление язвы после хирургического вмешательства, является снижение желудочной секреции до ах-лоргидрии или близкого к ней состояния. Наиболее признанной в этом отношении операцией считается резекция желудка. Установлено, что при язве желудка для дости¬жения ахлоргидрии бывает достаточно резецировать 1\4 его часть (рис. 163). При этом удалением антрального отдела и значительной части секреторной зоны желудка удается устра¬нить гуморальную фазу секреции, как наиболее ответственное звено в патогенезе язвы желудка. При язве двенадцатиперстной кишки резек¬ция желудка в таком объеме недостаточна, так как остается очень большое секреторное поле и сохраняется мозговая фаза желудочной секре¬ции, регулируемая через ядра блуждающего нерва, в результате чего нередко (4-5%) разви¬ваются пептические язвы желудочно-кишечно¬го соустья. По этой причине при дуоденальной язве резекция желудка должна выполняться в пределах не менее 2/3 органа, а у больных в возрасте до 30 лет и гиперсекреторов — в объе¬ме 3/4 желудка (С. С. Юдин, 1955). При язве желудка предпочтительнее выполнять резекцию Бильрот I, сохраняя пассаж пищи по две¬надцатиперстной кишке. Что касается второй радикальной опе-рации — ваготомии, то физиологической основой ее применения в качестве метода лечения язвенной болезни является пара-симпатическая денервация всего желудка (стволовая ваготомия) или его кислотооб¬разующей зоны (селективные варианты) с целью устранения мозговой фазы желудоч¬ной секреции/
Показания к хирургическому лечению.
Абсолютными показаниями являются такие, когда отказ от операции угрожает жизни больного.
К ним относятся:
перфорация язвы;
профузное продолжающееся кровотечение;
декомпенсированный стеноз привратника или двенадцатиперстной кишки;
малигнизация язвы.
Относительные показания к операции определяются в тех случаях, когда надежды на успех консервативной терапии минимальны, но в данный момент непосредственной угрозы для жизни больного нет.
К ним относятся:
пенетрация язвы;
неоднократно повторяющиеся кровотечения;
каллезная язва;
суб- и компенсированный стеноз привратника;
рецидивы язвы после ушивания перфорации;
безуспешность консервативной терапии язвы желудка в течение 3 мес и язвы двенадцатиперстной кишки в течение 2 лет с частыми обострениями заболевания;
язвенная болезнь с непрерывным типом кислотной продукции и декомпенсированной рН антрального отдела.
Выполнение операций по относительным показаниям, когда имеется возможность хорошего обследования больного и полноценной предоперационной подготовки, уменьшает число тяжелых осложнений и улучшает непосредственные и отдаленные результаты лечения. Выбор способа хирургического лечения должен быть индивидуальным, с учетом возраста больного, тяжести язвенных осложнений и сопутствующих заболеваний.
Язвенная болезнь 12-перстной кишки. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Осложнения. Показания и противопоказания к хирургическому лечению. Виды операций (виды резекций и ваготомий).
Язва двенадцатиперстной кишки (лат. ulcus duodeni)— язва, возникающая в результате действия кислоты и пепсина на слизистую оболочку двенадцатиперстной кишки у людей с повышенной чувствительностью.
мечевидного отростка и за грудиной, которые могут ошибочно приниматься за стенокардию.
Для язвы двенадца¬типерстной кишки характерны голодные, поздние (через 1,5-2 ч после еды) и ночные боли. Происхождение их связано с возникновением в это время алиментарной гипогли¬кемии, которая является мощным раздражителем ядер блуждающего нерва и стимуля¬тором кислой желудочной секреции. В этих случаях еда, особенно прием сладкого чая, повышает содержание сахара в крови, и боль исчезает. При язве двенадцатиперстной кишки обострение заболевания носит строго сезонный характер (весной и осенью), боли локализуются выше и правее пупка («северо-западнее пупка»)
При пенетрации язвы двенадцатиперстной кишки в поджелудочную железу или в печеночно-дуоде-нальную связку боли часто приобретают опоясывающий характер или иррадиируют по ходу правого диафрагмального нерва. В тех случаях, когда язва двенадцатиперст¬ной кишки сочетается с язвой желудка, клиническая картина приобретает признаки обоих заболеваний при язве двенадцатиперстной кишки больные стараются чаще есть, что¬бы утолить голодные и ночные боли, вслед¬ствие чего многие из них не только не ху¬деют, но нередко даже полнеют.
Существует несколько основных схем операций ваготомии:
стволовая ваготомия, при которой пересекаются стволы блуждающего нерва над диафрагмой до их разветвления, что приводит к денервации всех органов брюшной полости; основной недостаток стволовой ваготомии — пересечение печеночной и чревной ветвей блуждающих нервов лишает печень, поджелудочную железу и кишечник парасимпатической иннервации, следствием чего наступает «постваготомический синдром»
селективная ваготомия, при которой пересекаются все желудочные ветви блуждающего нерва, идущие к желудку, при этом сохраняются ветви, идущие к печени и солнечному сплетению; селективная ваготомия выполняется ниже пищеводного отверстия диафрагмы
селективная проксимальная ваготомия, при которой пересекаются только ветви блуждающего нерва, идущие к верхним отделам желудка; этот вариант ваготомии считается в настоящее время наиболее предпочтительным, так как он дает возможность сохранить максимально форму и функции желудка.
Ваготомия может выполняться как с помощью механического рассечения нерва хирургическим инструментом, так и медикаментозно-термическим способом, при котором разрушение ветвей блуждающих нервов происходит за счет комбинации медикаментозного (например, спиртоновокаиновой гиперионной смеси) и электротермического (электрокоагуляция) воздействия (Е.А. Баранов).
Ваготомия может сопутствовать другим операциям, например, при лечении язвенной болезни желудка и двенадцатиперстной кишки ваготомия выполняют с дренированием желудка, при хирургическом лечении рефлюкс-эзофагита селективная проксимальная ваготомия применяется совместно с операции фундопликации (О.С. Васнёв, К.В. Пучков и др.).
В настоящее время ваготомия выполняется не только традиционным, открытым способом, но и лапароскопическим. «Золотым» стандартом в неотложной хирургии является стволовая ваготомия, которую доступно выполнить лапароскопическим способом, а дренирующую желудок операцию с ликвидацией осложнения заболевания из местного минилапаротомного доступа (А.И. Михалев).
Недостатки ваготомии, как метода лечения язвенной болезни
У некоторых больных, несмотря на ваготомию, секреция кислоты и пепсина через некоторое время восстанавливаются, как следствие, язвенная болезнь рецидивирует. Примерно у 4 % оперированных наблюдаются серьезные моторно-эвакуаторные нарушения функции желудка и развивающаяся в тяжелой форме диарея, что иногда даже требует дополнительного операционного вмешательства.
У некоторых пациентов после стволовой ваготомии через 2-3 года обнаруживаются камни в желчном пузыре.
При втором варианте резекции желудка (Бильрот II) культи двенадцатиперстной кишки и желудка зашивают наглухо, а затем создают желудочно-тощекишечный анастомоз по типу бок в бок. Петлю тощей кишки подводят к культе желудка позади поперечной ободочной кишки через отверстие в mesocolon transversum.
Модификация этого способа по Гофмейстеру — Финстереру состоит в том, что гастроэнтероанастомоз накладывают по типу конец в бок (конец культи желудка сшивается с боковым отверстием в тонкой кишке) в изоперистальтическом направлении. Ширина просвета составляет 5-6 см. Приводящий конец кишки 2-3 швами подшивают к желудку ближе к малой кривизне. Края разреза mesocolon узловыми швами подшивают к желудку вокруг созданного анастомоза.
Каллезная и пенетрирующая язвы. Клиника. Диагностика. Лечение
Каллезная язва отличается большой величиной (до 2-3 см) и глубиной. Края такой язвы уплотнены вследствие развития в них грубой соединительной ткани, вокруг язвы образуется плотный воспалительный инфильтрат, напоминающий злокачественное образование (ulcus tumor).
Слизистая оболочка в области язвы утолщена и вследствие гиперплазии желез имеет шагреневый вид, хорошо заметно радиальное расположение около язвы складок слизистой оболочки. Дно омозолелой язвы часто сращено с прилежащим органом (печень, поджелудочная железа и др.), или соседний орган сам служит дном, или язва углубляется в ткань органа. В последнем случае язвы называются пенетри-рующими. Иногда на дне каллезной язвы может находиться кровеносный сосуд, являющийся источником кровотечения. Застарелые долго не заживающие язвы желудка в 20% озлокачествляются.
Особым упорством течения с резко выраженным болевым синдромом отличаются язвы двенадцатиперстной кишки и желудка, пенетрирующие в соседние органы. Такое осложнение наблюдается у 8-10% больных язвенной болезнью. Эти язвы, проникая в ткань другого органа, плохо поддаются рубцеванию, вызывают нередко упорное и массивное кровотечение, а также другие осложнения, в частности, перфорируют в желчные протоки и желчный пузырь. Диагностика пенетрирующих язв бывает трудной. Только в двух случаях можно с уверенностью говорить о пенетрации язвы: в случаях, когда рентгенолог обнаруживает очень глубокую нишу, явно превышающую толщину стенки желудка или двенадцатиперстной кишки, и при перфорации язвы в желчные пути. В этом последнем случае на обзорном рентгеновском снимке будет виден газ в желчных протоках, который может в них проникнуть только при наличии сообщения с желудочно-кишечным трактом
Прободная язва желудка и 12-перстной кишки. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Лечебная тактика. Метод Тейлора. Виды операций.
Перфорация (perforatio — пробурав-ливание) стенки желудка и двенадцатиперстной кишки на месте язвенного дефекта — осложнение язвенной болезни и острых гастродуоденальных язв.
У лиц молодого возраста язва двенадцатиперстной кишки перфорирует значи-тельно чаще, чем язва желудка, у пожилых людей преобладает прободение язв желуд¬ка. Это осложнение наступает при различной локализации язв, но наиболее часто при их расположении на передней стенке.
Различают три вида перфорации язв:
в свободную брюшную полость;
прикрытую;
атипичную.
Такое разделение имеет важное значение, так как позволяет выделить особенно¬сти клинической симптоматики этого осложнения.
Перфорация в свободную брюшную полость встречается чаще всего и сопровожда¬ется истечением в полость брюшины желудочно-кишечного содержимого, которое является сильным раздражителем рецепторов брюшины. Его нередко сравнивают с кислотным ожогом брюшины. При внезапном излиянии желудочного сока в организ¬ме Характеризуя динамику развития заболевания, Н. Н. Самарин (1952) выделил три стадии. Первую стадию он назвал стадией шока. С наступлением «паралича» чувствительных окончаний нервов париетальной брюшины начинается вторая ста¬дия — эйфории, или мнимого благополучия, а в дальнейшем и третья стадия — разлитого перитонита.
Прикрытая перфорация встречается значительно реже и составляет менее 7% (В. Н. Репин с соавт,, 1999). Прободное отверстие может прикрыться соседними органами (сальником, долей печени и др.), иногда кусочком пищи. Такая ситуация при благоприятных условиях может разрешиться ограничением патологического процесса с исходом на выздоровление.
В редких случаях атипичной перфорации прободение происходит в той части СТенки полого органа, где отсутствует брюшинный покров (между листками малого сальника, забрюшинная часть двенадцатиперстной кишки). В этих случаях как пра¬вило, образуется воспалительный инфильтрат с исходом в абсцесс или флегмону за-брюшинной клетчатки. При проникновении значительного количества воздуха может развиться эмфизема тканей.
Клиника и диагностика. У многих больных прободению язвы предшествует так называемый предперфоративный период, характеризующийся обострением язвенной болезни. За 3-4 дня, иногда и больше (2-3 недели), усиливаются боли в эпигастрии и диспептические явления (тошнота, рвота, изжога). Перфорация в этих случаях проис¬ходит на фоне клинически манифестированного обострения язвенной болезни. Иногда перфорация происходит при отсутствии ярких симптомов и даже при бессимптомном течении заболевания.
При прободении язвы в свободную брюшную полость клиническая картина весьма характерна.
Болевой синдром в этих случаях отличается резкой интенсивностью, доводящей иногда больного до шока, который сопровождается появлением характерных призна¬ков: резкой «кинжальной» боли в эпигастрии, «доскообразного» напряжения мышц живота. В это время больной занимает неподвижное вынужденное положение с подтя¬нутыми к животу коленями. Лицо принимает страдальческое выражение, может от¬мечаться акроцианоз, поверхностное дыхание, живот в дыхании не участвует, язык сухой. Пульс замедлен, артериальное давление снижено.
В дальнейшем, по мере распространения излившегося в брюшную полость желу¬дочно-кишечного содержимого, характер боли и ее локализация меняются. В течение 5-6 ч с момента перфорации интенсивность боли уменьшается, напряжение мышц передней брюшной стенки снижается. Самочувствие больного улучшается, иногда он становится несколько эйфоричен и воспринимает это улучшение как благоприятный перелом в течении болезни. Наступает период мнимого благополучия.
Наиболее часто излившееся содержимое перемещается по правому флангу брюш¬ной полости, боль смещается в правое подреберье, правую подвздошную область, но может ощущаться и по всему животу. От раздражения излившимся содержимьш окончаний даафрагмального нерва нередко появляется иррадиация болей в правое
надодечье под правую лопатку. Достоверным свидетельством перфорации язвы желудка или двенадцатиперстной кишки является наличие в брюшной полости свободного газа. Наиболее надежно он может быть обнаружен при рентгенологическом исследовании. Начинаться оно должно с производства обзорной рентгенограммы живота в том положении больного, в котором он доставлен в рентгеновский кабинет. Свободный газ в брюшной полости располагается в наиболее высоких отделах живота. При исследовании в вертикальном положении больного газ определяется под диафрагмой в виде светлого серпа. Если исследование производится в горизонтальном положении пациента, то следует применять методику латерографии: в положении на спине газ будет выявляться под передней брюшной стенкой, в положении на боку — на противоположной стороне. Оптимальной являет¬ся латерография на левом боку, что позволяет получать более четкое изображение даже небольшого количества свободного газа, скапливающегося между печенью и боковой стенкой живота. В противоположность этому при латерографии на правом боку могут возникнуть трудности в дифференциации свободного газа в брюшной поло¬сти с газом в просвете нисходящей кишки. Рентгенограммы после изменения положе¬ния тела больного следует выполнять с интервалом не менее 10 мин, чтобы газ в полном объеме успел переместиться в другой отдел брюшной полости. Наличие спаек в ней может обусловить скопление газа в нетипичных местах. Когда помимо воздуха в брюш¬ной полости имеется еще и жидкость, то могут определяться горизонтальные уровни. Если на рентгенограммах удается обнаружить газ внутрибрюшинной локализа¬ции, то рентгенологическое исследование на этом может быть закончено.
Прикрытая перфорация привносит свою особенность в клиническую картину заболевания. Она заключается в том, что возникший острый болевой синдром обры¬вается. Резчайшие боли прекращаются, напряжение мышц передней брюшной стен¬ки и симптомы раздражения брюшины становятся менее выраженными или имеют локальный характер. Они могут быть установлены в эпигастральной области или ближе к правому подреберью. В это время в остальных отделах живот остается мягким, безболезненным. Из-за малого количества поступившего в брюшную по¬лость газа или отсутствия его печеночная тупость может быть сохранена. Прикры¬тая перфорация в этих случаях часто не распознается и рассматривается как обо¬стрение язвенной болезни.
Атипичная перфорация клинически тоже проявляется внезапно возникшими и уменьшающимися по интенсивности в последующем болями. Локализация боли в эпигастральной области, типичная иррадиация — в спину. Свободный газ в брюшной полости отсутствует, но бывает распространенная крепитация, выявляемая при паль¬пации передней стенки живота или груди. Заболевание развивается относительно медленно при наличии стойкого болевого синдрома. Клинико-лабораторные данные характерны для формирующегося абсцесса брюшной полости или забрюшинной флег¬моны. Диагностика этого вида перфорации очень трудна.
Дифференциальный диагноз перфоративной язвы наиболее часто проводят с уже упоминавшимся острым аппендицитом и острым холециститом, а также с острым панкреатитом, инфарктом миокарда (эпигастральная форма) и нижнедолевой плев¬ропневмонией.Хирургическое лечение. В лечении перфоративной язвы желудка и двенадцати¬перстной кишки основным методом является оперативный. Операция, как правило, Должна осуществляться в экстренном порядке. Чем раньше установлен диагноз и поизведена операция, тем лучше прогноз на выздоровление больного. Поэтому на Догоспитальном этапе наиболее важной задачей является организация немедленной госпитализации больного в хирургический стационар. Перед транспортировкой боль¬ного вводят в желудок зонд и без промывания удаляют содержимое. Несмотря на выраженный бол«3 синдром, противопоказано введение наркотических препаратов,которые могут исказить клиническую картину заболевания и дезориентировать хи¬рурга. Объем лечебных мероприятий должен быть ограничен коррекцией нарушения жизненно важных функций, которая проводится одновременно с транспортировкой больного в стационар.
Диагноз перфоративной язвы в свободную брюшную полость следует считать абсо¬лютным показанием к неотложной операции.
При прикрытом прободении хирурги поступают по-разному. Одни в силу суще¬ствующих трудностей диагностики и прогнозирования течения такой формы перфо¬рации при установлении и даже по подозрению на нее считают необходимым срочно оперировать.
Консервативный способ лечения (метод Тейлора) применим в крайне редких слу¬чаях — категорического отказа больного от операции или при невозможности выпол¬нения вмешательства в силу технических условий. Лечение основано на постоянной аспирации желудочного содержимого через зонд, введении в желудок антибиотиков, адекватной антибактериальной и дезинтоксикационной терапии. Осуществляется па¬рентеральное питание, назначаются препараты, снижающие секрецию желудочного сока, проводится местная гипотермия (холод на живот). Такое лечение длится 7-10 дней. Перед удалением зонда из желудка рекомендуется провести рентгенологи¬ческое исследование с использованием водорастворимого контрастирующего вещества для исключения затекания его за контуры желудка или двенадцатиперстной кишки. Этот метод в исключительных ситуациях дает надежду на выздоровление.
Основная цель хирургического лечения — спасение жизни больного. Поэтому оперативное вмешательство может быть минимальным и заключается в ушивании перфоративного отверстия. Однако выбор вида и объема вмешательства зависит от общего состояния больного, его возраста, наличия сопутствующих заболеваний, вре¬мени, прошедшего с момента перфорации, выраженности перитонита и опыта хирур¬га. Эти основные условия определяют возможность выполнения патогенетически обо¬снованных радикальных операций. В настоящее время в качестве радикальных операций применяются резекция желудка и ваготомия в сочетании с дренирующими желудок вмешательствами.
Предоперационная подготовка включает лечебные мероприятия, направленные
на коррекцию нарушений жизненно важных функций организма.
Обезболивание общее.
Хирургическая тактика. Ушивание перфорационного отверстия производится
без иссечения и с иссечением язвы. В настоящее время накапливается опыт выпол¬
нения таких операций с помощью эндовидеохирургии (лапароскопически).Показаниями к ушиванию является терминальная фаза разлитого перитонита, острая язва молодых людей без предшествующего язвенного анамнеза, тяжелые со¬путствующие заболевания, препятствующие расширению объема оперативного вме¬шательства, отсутствие необходимого опыта хирурга.
Необходимость применения патогенетически обоснованных операций диктуется высоким риском рецидива заболевания после простого ушивания язвы. Считается, что не менее 70% оперированных больных продолжают страдать язвенной болезнью. Резекция желудка показана больным с хронической, особенно каллезной, язвой желудка или вызывающей подозрение на ее малингнизацию, при отсутствии перито¬нита в первые 6 ч с момента перфорации. Некоторые хирурги считают резекцию желудка оправданной при осложненных одновременно перфорацией и кровотечением,
Ваготомия с иссечением или ушиванием перфоративной язвы и пилоропластикой или гастродуоденостомией выполняется у больных с локализацией язвы в двенадца¬типерстной кишке также при условии отсутствия фибринозно-гнойного перитонита в первые 6 ч с момента перфорации. Предпочтение отдается стволовой поддиафраг-мальной ваготомии как более простому и надежному оперативному вмешательству.
Техника ушивания прободной язвы сводится к нало¬жению одиночных узловых швов из нерассасывающегося шовного материала в поперечном направлении по отноше¬нию к продольной оси желудка или двенадцатиперстной кишки. Обычно бывает достаточно 3-4 швов. Второй ряд швов удается наложить на желудке и редко на Двенадцатиперстной кишке. Для укрепления линии швов иногда подшивается прядь сальника. В тех случаях, когда края язвы при завязывании ни¬тей прорезаются или перфорационное отверстие имеет боль¬шие размеры, следует воспользоваться методом Оппеля-Поликарпова. Он состоит в «тампонировании» перфорационного отверстия язвы прядью большого саль¬ника на ножке, которая проводится в просвет органа через прободное отверстие, плотно фиксируется, а по окружно¬сти язвы подшивается дополнительными нитями. При атипичных перфорациях необходимо проводить дополнительно к основной операции дренирование забрюшинного пространства.
Кровоточащая язва желудка и 12 перегной кишки. Клиника. Диагностика. Классификация по степени тяжести кровопотери. Дифференциальная диагностика. Принципы лечения. Хирургическая тактика.
Острые желудочно-кишечные кровоте¬чения являются осложнениями различных заболеваний.
Различают скрытый и явный период острого желудочно-кишечного кровотечения.
В скрытом периоде отмечаются неспецифические признаки, входящие в общую симп¬томатику острой кровопотери. Проявления слабости и головокружения, «шум и звон» в голове, «мелькание мушек» перед глазами, тошнота, холодный пот и даже обморочное состояние могут быть кратковременными или сохраняться несколько часов и даже су¬ток. При этом учащается пульс и снижается артериальное давление. Тяжелая геморра¬гия иногда может начинаться с потери сознания, нередко обморок развивается в момент или после акта дефекации, при этом характерен внезапный позыв к нему. Продолжи-тельность и степень выраженности вышеназванных симптомов в основном определяется темпом и объемом кровопотери. Диагностика кровотечения в это время наиболее трудна, но обнаружение указанных признаков должно заставить врача подумать о нем.
Явный период начинается с появления кровавой рвоты, крови в каловых массах или дегтеобразного кала (мелены) в виде липкой массы черного цвета.
Кровавая рвота может быть неизмененной кровью или «кофейной гущей» (изме¬нение цвета обусловлено воздействием соляной кислоты на кровь). Наличие в рвот¬ных массах большого количества алой крови или сгустков ее — признак тяжелой кровопотери. Рвота бывает однократной или многократной и возникает при кровоте¬чении из верхних отделов пищеварительного тракта.
Дегтеобразный кал характерен для тяжелой кровопотери, оформленный кал чер¬ного цвета (при отсутствии у больного запоров) обычно сопутствует легкой и средней степени тяжести кровотечения, источник которого также находится в верхних отде¬лах желудочно-кишечного тракта.
Кровопотеря бывает разной. Выделяется массивное кровотечение и, если оно про¬исходит быстро, его называют профузным.
В период развития явных признаков установление самого факта кровотечения не вызывает затруднения, но точное определение величины кровопотери не всегда воз¬можно. О ней наиболее часто судят по косвенным признакам. Определение уровня систолического артериального давления и частоты пульса уже дает возможность по¬лучить такое представление
Безусловно, хирург не ограничивается только оценкой лабораторных данных и всегда соотносит их с результатами клинического исследования. Привлекает внима¬ние характеристика степеней кровопотери, рекомендуемая для использования в воен¬ных лечебных учреждениях.
I степень — легкая кровопотеря: общее состояние больного удовлетворительное,
умеренная тахикардия (до 100 ударов в минуту), артериальное давление в норме,
ЦВД — 5-15 см вод. ст., диурез не снижен, содержание гемоглобина не ниже 100 г/л,
дефицит ОЦК до 20% к должному.
II степень — средняя кровопотеря: общее состояние больного средней тяжести,
частота пульса до 110 ударов в минуту, систолическое артериальное давление не ниже
90 мм рт. ст., ЦВД меньше 5 см вод. ст., умеренная олигурия, содержание гемогло¬
бина не ниже 80 г/л, дефицит ОЦК от 20 до 29%.
III степень — тяжелая кровопотеря: состояние больного тяжелое, частота пульса
более ПО ударов в минуту, систолическое артериальное давление ниже 90 мм рт. ст.,
ЦВД — 0, олигурия, метаболический ацидоз, содержание гемоглобина ниже 80 г/л,
дефицит ОЦК 30% и больше. Коллаптоидное состояние на высоте кровотечения все¬
гда свидетельствует о тяжелой кровопотере.
Кровотечения из верхнего отдела пищеварительного тракта. Язвенные кровотече¬ния. При язвенной болезни желудка и двенадцатиперстной кишки манифестированные кровотечения, как правило, возникают из крупного кровеносного сосуда. Хронические язвы желудка и двенадцатиперстной кишки осложняются кровотечением в 15-20% случаев. Такое осложнение развивается в 3-4 раза чаще при язве двенадцатиперстной кишки. Важно отметить, что больной с кровоточащей язвой обычно имеет характер¬ный для язвенной болезни желудка или двенадцатиперстной кишки анамнез. При этом следует иметь в виду, что кровотечение не является редкостью при бессимптом¬ном течении болезни и может быть первичным признаком существования у больного язвы. По данным В. Н. Сацукевича и Д. В. Сацукевича (1999), почти у 14% больных с кровотечениями из язв желудка или двенадцатиперстной кишки не было «желудоч¬ного » анамнеза. В то же время при тщательном изучении анамнестических данных нередко удается обнаружить признаки «желудочного дискомфорта» (нечастые боли в эпигастральной области, отрыжка, изжога, потребление соды, спазмолитиков и т. д.). Появлению правильного предположения о наличии язвы помогают такие дополни¬тельные признаки, как исчезновение боли при возникновении кровотечения, наличие локальной болезненности при пальпации и перкуссии пилородуоденальной зоны.
Существенно усложняется диагностика по клиническим данным в случаях сочета¬ния двух осложнений язвенной болезни кровотечения и перфорации. Обычно перфо¬рирует та же язва, реже — разные. Кровотечение и прободение могут происходить одновременно или в разной последовательности. Указанное сочетание встречается в 2,7-10% случаев по отношению ко всем перфоративным язвам (Р. Ш. Вахтангишви-ли, 1985; В. Н. Репин с соавт., 1999).
Наиболее трудным является распознавание перфорации у больного с развившим¬ся кровотечением. В клинической картине болезни отсутствует болевой синдром, из¬вестный как «кинжальная боль», и нет «доскообразного» живота. Отсутствие или малая интенсивность этих признаков объясняется тем, что при перфорации в брюш¬ную полость изливается содержимое желудка, в котором соляная кислота нейтрализо¬вана поступившей кровью. Для исключения диагностической ошибки любое усиление боли в животе у больного с кровоточащей язвой должно привлечь внимание врача, чтобы с особой настойчивостью осуществить необходимые инструментальные и рент-генологические исследования для исключения или подтверждения предположения о развитии еще одного осложнения — перфорации.
Лечение острых желудочно-кишечных кровотечений до настоящего времени остается сложной проблемой. В идеале оно предусматривает не только достижение гемо¬стаза, но и устранение заболевания, приведшего к кровотечению. Однако реализация этого принципа в полном объеме не всегда представляется возможной, и в этих случа¬ях главной целью является остановка кровотечения, с тем чтобы сохранить жизнь
больного.
Лечение должно начинаться на догоспитальном этапе. Первая враче!fom по-состоит в назначении строгого постельного режима, в запрещении приема , в пении "я" льдом или холодной водой „а живот, во внутримышечном введении 5 мл 1% раствора викасола, внутривенном медленном введении 10 мл 10% раствора хлорида кальция ИЛИ глюконата кальция.
При коллапсе больному придается положение Тренделенбурга и осуществляется внутривенное вливание плазмозамещающих растворов, вначале струйно, а при подъе¬ме артериального давления выше 80 мм рт. ст. — калельно. Инфузионная терапия проводится и в пути следования в хирургический стационар.
Лечение в стационаре должно быть комплексным, с использованием как традици¬онных консервативных методов, так и современных технологий (с применением эндо-видеотехники), а также оперативных вмешательств. Обязательного жесткого алгорит¬ма их применения не существует, но необходимость дифференцированной лечебной тактики неоспорима.
Важное значение придается инфузионно-трансфузионной терапии. Без нее тяже¬лые нарушения в тканях и органах, вызванные кровопотерей, не могут быть ликвиди¬рованы. Предложены различные схемы ее проведения, созданы специальные поэтап¬ные программы лечения больных. Основной целью существующих предложений, независимо от их содержания и этапности использования, является стремление к нормализации гемодинамики и адекватности перфузии тканей. Достижению такого эффекта наилучшим образом способствует тактика управляемой умеренной гемоди-люции — поддержание гематокрита в пределах 30% и гемоглобина около 100 г/л
При язвенном гастродуоденальном кровотечении для подавления желудочной сек¬реции целесообразно применение антацидов, ганглиоблокаторов (атропин), современ¬ных антисекреторных препаратов блокаторов Н2-рецепторов (циметидин и др.). Для предотвращения растворения кровяного сгустка пепсином считается полезным ка¬пельное введение в желудок молока. . Основ¬ную роль в окончательной остановке кровотечения играют эндоскопические методы и оперативные вмешательства.
Эндоскопические методы остановки желудочно-кишечного кровотечения. Диа¬гностика и лечение внутреннего кровотечения при применении эндоскопической тех¬ники должны быть совмещены по времени. При выявлении одиночного источника кровотечения на него можно воздействовать как холодом, так и теплом. Через мани-пуляционный канал эндоскопа в желудок, двенадцатиперстную кишку проводится полихлорвиниловая трубка и патологический очаг орошается хлорэтилом. Через ма-нипуляционный канал можно провести и другие инструменты и осуществить диатер-мокоагуляцию или лазерную коагуляцию.
Для остановки кровотечения применяется также обкалывание источника кровоте¬чения лекарственными препаратами. Под контролем фиброскопа в ткани патологи¬ческого очага вводятся сосудосуживающие лекарства (норвдреналин) или усиливаю¬щие репаративные процессы (витамины, оксиферрискорбон), а также препараты (майодил, йодолипол и др.), создающие плотный инфильтрат, сдавливающий крово-точащий сосуд.
Как показывает опыт, накопленный в специализированных центрах по лечению острых желудочно-кишечных кровотечений, эндоскопическая диатермокоагуляция высокоэффективна у больных с кровотечениями на почве острых язв желудка и двенадцатиперстной кишки, синдрома Маллори-Вейсс. Она менее эффективна при кровоточащих хронических язвах желудка и двенадцатиперстной кишки с локализа¬цией на задней стенке луковицы и залуковичного отдела, при нарастании тяжести кровопотери вследствие аррозии крупных сосудов. Обкалывание источника кровоте¬чения лекарственными препаратами менее надежно при хронических каллезных яз¬вах больших размеров.
Неотложной операции должны подвергаться больные с продолжающимся крово¬течением, представляющим непосредственную угрозу для жизни. Из приемного отде¬ления такие пациенты сразу направляются в операционную. Забор крови для лабора¬торных исследований, аппаратные и другие виды диагностических мероприятий проводятся одновременно с предоперационной подготовкой (в частности, с восполне¬нием крови) и анестезиологическим пособием. При этом эндоскопическая диагности¬ка и попытка остановки кровотечения остаются обязательными мероприятиями. Ус¬пех в такой попытке не может служить основанием для отмены операции при большой (40% ОЦК и более) кровопотере. Он позволяет избежать продолжения кровопотери до ее окончательной остановки во время оперативного вмешательства.Обнаружение подслизистых кровоизлияний в области пищеводно-желудочного перехода позволяет заподозрить синдром Маллори-Вейсс. Хронические язвы желуд¬ка и двенадцатиперстной кишки выявляются по характерному виду серозного покро¬ва в проекции язвы, а также по наличию спаечного процесса, пальпируемого язвенно¬го инфильтрата.
В тех случаях, когда во время операции не находят источника кровотечения, целесообразно прибегнуть к интраоперационной эндоскопии или гастротомии. Хоро¬шим доступом к дистальной части желудка и двенадцатиперстной кишки является продольный разрез (длиной около б см) через привратник, а к проксимальной — продольный или поперечный разрез в верхней трети желудка. Пилородуоденальный разрез ушивают по типу пилоропластики по Гейнеке-Микуличу, остальные разре¬зы — обычным путем с применением двух рядов швов.
Оперативные вмешательства при острых язвеняых кровотечениях. Наиболее це¬лесообразным является дифференцированный подход к выбору оперативного вмеша¬тельства.
Резекция желудка - патогенетически оправданная операция как при хрониче¬ской язве желудка, так и при язве двенадцатиперстной кишки. Кровоточащая язва Должна «уйти, в препарат вместе с гастршшродуцирующеи зоной приязве желудка или в пределах двух третей этого органа при язве двенадцатиперстной кишки. При подозрении на злокачественный характер желудочной язвы резекция желудка осуще-ствляется по онкологическим принципам.
У больных с высокой степенью риска, находящихся в крайне тяжелом состоянии, допустимы паллиативные операции в виде иссечения или прошивания язвы.
Иссечение язвы следует производить дугообразным разрезом в продольном на¬правлении, чтобы избежать функционально невыгодной деформации желудка при зашивании дефекта.
В тех случаях, когда иссечение язвы технически оказывается трудным (при лока¬лизации большой каллезной язвы на задней стенке желудка или высоко в прокси¬мальном его отделе) рекомендуется прошивание кровоточащего сосуда с дополнением тампонадой пористой гемостатической губкой (колартеком).
При прошивании язвы целесообразно накладывать 8-образный или Z-образный швы (см. рис. 174). С его помощью можно надежно остановить кровотечение при наличии плотного язвенного инфильтрата.
Следует отметить, что паллиативные операции при язвенных желудочно-кишеч¬ных кровотечениях дают плохие отдаленные результаты. Почти у половины из них возникает необходимость в повторных оперативных вмешательствах (В. В. Гопеенко, 1999). Следовательно, такие операции не должны иметь широкого применения.
Остановка кровотечения из язвы двенадцатиперстной кишки может быть достиг¬нута другой патогенетически обоснованной, но менее травматичной операцией — под-диафрагмальной стволовой ваготомией с иссечением или прошиванием язвы и дрени¬рующей желудок операцией. Этот вид вмешательства предпочтителен перед селективной и проксимальной селективной ваготомией. Он обладает не меньшим лечебным эффек¬том, но более прост и менее травматичен. Такое преимущество позволяет использо¬вать стволовую ваготомию у больных с высоким операционным риском. Эта операция в сочетании с пилоропластикои по Финнею особенно выгодна при локализации язвы в залуковичном отделе двенадцатиперстной кишки, так как выбранный вид дренирую¬щей операции обеспечивает хороший доступ к кровоточащей язве.
У больных молодого возраста с легкой или умеренной степенью кровопотери ваготомия может быть дополнена антрумэктомией (резекцией дистальной «1/3 же¬лудка), которая обеспечивает более эффективное снижение желудочной секреции. При этом хирург должен быть готов к решению сложных технических задач, связан¬ных с закрытием культи двенадцатиперстной кишки, если низко расположенная в ней большая язва пенетрирует в головку поджелудочной железы.
Лечение сочетанных язв (язвы двенадцатиперстной кишки и желудка) осуществ¬ляется, как правило, так же, как и лечение дуоденальной язвы. Предпочтение отдает¬ся стволовой ваготомии с дренирующей желудок операцией. Кровоточащая желудоч¬ная язва при этом иссекается или ушивается. Она является вторичной по отношению к язве двенадцатиперстной кишки и очень редко малигнизируется. Если язва не иссекалась, то такой больной в последующем подлежит динамическому наблюдению с эндоскопическим (при необходимости с биопсией) контролем.
Остановка кровотечения из пептической язвы желудочно-кишечного соустья, развившейся после резекции желудка, осуществляется прошиванием кровоточаще¬го сосуда. Стволовая ваготомия в этих случаях также является эффективной операци¬ей. Отличительной особенностью такого вмешательства является отсутствие необхо¬димости в дренирующей операции. Ваготомия позволяет избежать более травматичной резекции желудка при недостаточной по объему первичной резекции желудка
Кровоточащая язва желудка и 12 перегной кишки. Классификация Форреста (Forrest). Консервативное и оперативное лечение. Методы операций. Эндоскопические методы остановки кровотечения.
В 1974 г. Forrest и соавт. описали эндоскопические признаки кровотечения из пептической язвы и систематизировали их. В настоящее время эта классификация получила признание во всем мире. Ее преимущество в том, что она является базисной при определении тактики ведения больных с кровотечениями.
Тип F I – активное кровотечение :
I a – пульсирующей струей;
I b – потоком.
Тип F II – признаки недавнего кровотечения :
II а – видимый (некровоточащий) сосуд;
II b – фиксированный тромб-сгусток;
II с – плоское черное пятно (черное дно язвы).
Тип F III – язва с чистым (белым) дном .
Стеноз привратника язвенной этиологии. Клиника. Стадии стеноза. Диагностика. Дифференциальный диагноз. Предоперационная подготовка больных с декомпеисированным пилородуоденальным стенозом. Показания (абсолютные и относительные) к операциям. Виды операций.
Рубцовый стеноз двенадцатиперстной кишки и выходного отдела желудка раз¬вивается у 10-15% больных язвенной болезнью. Ранее указывалось, что стеноз всегда образуется на уровне язвы. Однако сужение выходного отдела желудка и двенадцати¬перстной кишки не всегда бывает обусловлено Рубцовым процессом. Отек и воспале¬ние тканей в области язвы в период обострения заболевания иногда могут сопровож¬даться нарушением эвакуации желудочного содержимого, которое устраняется при эффективном противоязвенном лечении. В зависимости от степени нарушения эвакуа¬ции содержимого желудка принято различать три степени стеноза выходного отдела
желудка или двенадцатиперстной кишки: ком¬пенсированный, субкомпенсированный и деком-пенсированный.
При компенсированной стадии стеноза боль¬ные находятся в удовлетворительном состоянии, у них не бывает рвот застойным содержимым желудка, при рентгенологическом исследовании желудок не расширен, тонус его повышен, пери¬стальтика протекает глубокими волнами («сте-нозирующая», «сегментирующая»), просвет две¬надцатиперстной кишки или выходного отдела желудка сужен до 1-0,8 см, а эвакуация контра¬стирующей массы из желудка бывает задержана до 6-10 ч.
При субкомпенсированной стадии стеноза у больных периодически бывают рвоты, иногда в рвотных массах обнаруживается примесь пищи, употребленной накануне. Такая рвота приносит больному облегчение, так как желудок освобож¬дается от кислого содержимого и застойных пи-щевых масс. Пальпация живота в таких случаях нередко провоцирует заметную на глаз пери-стальтику желудка, а при сотрясении брюшной стенки в подложечной области бывает слышен «шум плеска». При рентгенологическом иссле-довании желудка обнаруживается значительное его расширение, сужение просвета двенадцати¬перстной кишки или выходного отдела желудка достигает 0,5 см. Контрастирующая масса задер¬живается в желудке до 12-24 ч. Однако тонус желудка еще достаточно сохранен, а в положении больного на правом боку эвакуация ускоряется.
Наконец, при декомпенслрованной стадии стеноза рвоты становятся систематическими, обильными (до 1-1,5 л), больные обезвоживают¬ся, у них резко нарушается белковый и мине-ральный обмен, иногда до появления судорог, больные истощаются, уменьшается диурез, раз¬вивается гемоконцентрация, натощак в желудке постоянно отмечается симптом «шума плеска». В связи с резким опущением желудка, контуры которого хорошо видны при осмотре живота, ча¬сто в подложечной области пальпаторно опреде-ляется пульсация брюшной аорты, которая у здо¬ровых людей обычно прикрыта желудком. При рентгенологическом исследовании обнаруживает¬ся резко расширенный желудок (рис. 161), тонус его почти утрачен, он опущен в полость малого таза, эвакуация контрастирующей массы отсут¬ствует, в том числе в положении на правом боку. Просвет двенадцатиперстной кишки или выход¬ного отдела желудка бывает сужен до 0,2-0,4 см и не пропускает даже конец фиброскопа. При по-вторном рентгенологическом исследовании же¬лудка у таких больных контрастирующая масса задерживается в нем до 36-72 ч. Очень часто у этих больных стул может отсутство-вать в течение 7 сут а в терминальной стадии иногда развивается энтероколит с тяжелой, холероподобнои диареей и энцефалопатией. Прогноз в таких случаях крайне сомнительный, больные нуждаются в интенсивном реанимационном пособии Длительный анамнез заболевания, классические признаки язвенной болезни и данные инструментальных исследований позволяют в таких случаях исключить злокачественную опухоль.
Лечение начальных стадий стеноза привратника сводится к уменьшению воспалительного процесса в области язвы, т.е. лечению самой язвенной болезни, так как стихание воспалительного процесса может привести к полному восстановлению проходимости. Также применяют медикаментозные средства улучшающие моторику желудка и кишечника – прокинетики.
Если стадия болезни далеко зашедшая, то прибегают к хирургическим методам лечения.
В ряде случаев возможно проведение эндоскопического вмешательства, при котором специальным баллоном раздувают место сужения, конечно, после этого пилорический клапан функционировать не будет, но проходимость восстановиться.
Если такая процедура противопоказана или заведомо шансов на успех мало, прибегают к открытой, полостной операции.
При рубцовом стенозе привратника язвенной этиологии показано оперативное лечение — резекция желудка. Истощенные и обезвоженные больные с резко атрофичной желудочной стенкой плохо переносят радикальную операцию, поэтому успех последней во многом зависит от рациональной предоперационной подготовки. Для уменьшения атонии желудка производят ежедневные промывания его, инъекции азотнокислого стрихнина. Больной получает парентеральное питание, частые переливания белковых кровезаменителей и гемотрансфузии, вливания глюкозы с витаминами, электролитных жидкостей (физиологический раствор хлористого натрия, 0,3% раствор хлористого калия в 5% растворе глюкозы).
При гастрогенной тетании немедленно внутривенно вливают 50 мл 10% раствора хлористого натрия, 20 мл 40% раствора глюкозы с витаминами Вх и С и налаживают капельное вливание 1000 мл 0,3% раствора хлористого калия в 5% растворе глюкозы. В дальнейшем необходимо энергично готовить больного к операции по указанной выше схеме.
Симптоматические острые язвы: стрессовые, гормональные, лекарственные. Клиника. Диагностика. Дифференциальный диагноз. Осложнения. Хирургическая тактика. Показания и особенности хирургического лечения. Синдром Золлингера-Эллисона.
Заболевание возникает при стрессовых ситуациях, связанных с серьезной патологией внутренних органов, тяжелыми оперативными вмешательствами, ожогами, политравмой, приемом некоторых лекарственных веществ и др.
В зависимости от причины возникновения различают следующие виды острых язв:
с т р е с с о в ы е язвы — у больных с множественной травмой (политравма), шоком, сепсисом, тяжелыми большими операциями на органах грудной полости, живота, на крупных сосудах и операциях на мозге;
я з в а К у ш и н г а — после операции на головном мозге, при черепно-мозговой травме и опухолях мозга вследствие центральной стимуляции желудочной секреции и повышения его агрессивных свойств по отношению к слизистой оболочке желудка;
л е к а р с т в е н н ы е я з в ы , возникающие при приеме ацетилсалициловой кислоты, индометацина, волтарена, стероидных гормонов, цитоста-тических препаратов.
Типичными признаками всех острых язв является внезапное массивное угрожающее жизни кровотечение или перфорация язвы. Оптимальным способом диагностики острых язв является эндоскопическое исследование. Следует учитывать, что до появления кровотечения острые язвы протекают обычно бессимптомно.
Острый эрозивный гастрит. Для этого заболевания характерны поверхностные плоские округлые или удлиненной формы дефекты слизистой оболочки желудка (эрозии). В отличие от язв они не разрушают мышечную пластинку слизистой оболочки (lamina muscularis mucosae). Причинами их возникновения являются тяжелый стресс, множественные травмы, обширные ожоги (язва Курлинга), обширные травматичные операции, прием некоторых лекарственных средств; основные клинические симптомы — кровотечение (гематемезис, мелена), шок. Диагноз устанавливают при эндоскопическом исследовании.
Лекарственные средства (стероидные гормоны, ацетилсалициловая кислота, бутадион, индометацин, атофан) уменьшают образование слизи, разрушают защитный барьер слизистой оболочки, вызывают геморрагии. При отмене препаратов язва и эрозии быстро заживают.
Ишемия слизистой оболочки играет ключевую роль в развитии геморрагического гастрита, так как способствует ослаблению ее защитного барьера.
Лечение. При острых язвах и эрозивном гастрите вначале проводят консервативное лечение
Хирургическое лечение применяют редко. Предпочтение отдают селективной проксимальной ваготомии, обкалыванию и перевязке кровоточащих сосудов, реже производят резекцию желудка или даже гастрэктомию (в исключительных случаях).
Простая язва Дьелафуа поддается только оперативному лечению: обкалывают и перевязывают кровоточащую артерию через гастротомическое отверстие или иссекают изъязвленный участок и накладывают шов на края раны в стенке желудка. Кровотечение часто рецидивирует.
Синдро́м Зо́ллингера-Э́ллисона (аденома поджелудочной железы ульцерогенная, гастринома) — опухоль островкового аппарата поджелудочной железы, характеризующаяся возникновением пептических язв двенадцатиперстной кишки и желудка, не поддающихся лечению и сопровождающаяся упорными поносами. Клиническими проявлениями заболевания являются боли в верхней части живота, которые имеют те же закономерности по отношению к приёму пищи, что и при обычной язве двенадцатиперстной кишки и желудка, но в отличие от них очень упорны, отличаются большой интенсивностью и не поддаются противоязвенной терапии.
Характерны упорная изжога и отрыжка кислым. Важным признаком являются поносы, обусловленные попаданием в тонкий кишечник большого количества соляной кислоты и усилением вследствие этого моторики тонкой кишки и замедлением всасывания. Стул обильный, водянистый, с большим количеством жира. Возможно значительное снижение массы тела, что характерно для злокачественной гастринемии.
Язвы желудка и двенадцатиперстной кишки при синдроме Золлингера—Эллисона не поддаются заживлению даже при продолжительной соответствующей терапии. У многих пациентов наблюдаются явления эзофагита, иногда даже с образованием сужения пищевода. Пальпаторно определяется выраженная болезненность в верхней части живота, и области проекции нижней части желудка, может быть положительный симптом Менделя (локальная болезненность в проекции язвы). В случае злокачественного течения болезни возможны опухолевые образования в печени и значительное её увеличение.
Основным методом лечения (в 80%) считается гастрэк-томия. Для того чтобы решиться на полное удаление желудка, надо быть уверенным в наличии синдрома Цоллингера-Эллисона. Если такой уверенности нет, то некоторые авторы (В. М. Ситенко, В. И. Самохвалов, 1972) рекомендуют прибегать к диагности¬ческой ваготомии или резекции неоперированного желудка и, если через месяц после них желудочная секреция остается чрезвычайно высокой, производить экстирпацию желудка в плановом порядке, не дожидаясь развития осложнений язвы. Показанием к гастрэктомии считают наличие множественных гастрином, одиночной гастриномы с метастазами, а также рецидив язвы после удаления опухоли.
Как уже указывалось, гастриномы часто бывают множественными, располагают¬ся в разных отделах поджелудочной железы и в различных органах, что крайне затрудняет их поиск во время операции. Поэтому попытки лечить больных синдро¬мом Цоллингера-Эллисона одним только удалением опухоли, как правило, нереаль¬ны. Правда, описаны случаи успешного лечения таких больных подобным вмешатель¬ством под контролем операционной рН-метрии слизистой желудка (А. А. Курыгин, 1987). В этих отдельных наблюдениях после удаления одиночных гастрином уже на операционном столе наступала ахлогидрия. Однако такие наблюдения крайне редки и не всегда надежны.
Удаление аденомы поджелудочной железы оправдано и надежно при синдроме Вернера-Моррисона, при котором больному не угрожает развитие язв в желудке и двенадцатиперстной кишке.
Синдром Меллори-Вейса. Определение. Причины. Клиника. Диагностика. Дифференциальный диагноз. Консервативное лечение. Показания к операции.
Синдром Мэлори-Вейса - это продольный разрыв слизистой оболочки пищевода, происходящий при сильных позывах к рвоте или во время самой рвоты.
Клинически синдром Мэлори-Вейса будет проявляться наличием крови в рвотных массах. При чем кровь может отсутствовать во время первых приступов рвоты, когда только происходит разрыв слизистой.
Кроме рвоты с примесью крови у больных с данным синдромом возможно наличие болей в животе, стула черного цвета (мелены).
Диагностика синдрома Мэлори-Вейса.
Из инструментальных методов диагностики синдрома Мэлори-Вейса наибольшую ценность представляет эндоскопическое исследование (фиброэзофагогастродуоденоскопия). Данное исследование позволяет увидеть продольный разрыв слизистой оболочки пищевода. Кроме того, если обнаруживается кровотечение, то его можно попытаться остановить эндоскопически (см. Лечение синдрома Мэлори-Вейса).
В анамнезе больных синдромом Мэлори-Вейса часто можно встретить упоминание об употреблении алкогольных напитков в большом количестве, вследствие чего возникала рвота.
При осмотре больного с синдромом Мэлори-Вейса можно обнаружить общие признаки всех кровотечений: бледность кожных покровов, холодный липкий пот, вялость, тахикардия, гипотония, возможно, даже развитие шока.
В клиническом анализе крови будет снижение количества эритроцитов, уровня гемоглабина, повышение количества тромбоцитов, что свидетельствует о наличии кровотечения.
а. Консервативная терапия при синдроме Мэлори-Вейса используются с целью восстановления объема циркулирующей крови. Для этого применяют различные кристалоидные (NaCl 0,9%, глюкоза 5%, раствор Рингера и др.), коллоидные растворы (альбумин, аминоплазмаль и др.), в случае тяжелой кровопотери возможно применение гемотрансфузии (эритроцитарная масса, свежезамороженная плазма)
При рвоте (или позывах на рвоту) применяют метоклопрамид (церукал).
С целью остановки кровотечения используют зонд Блэкмора. Этот зонд имеет 2 балона. С помощью нижнего балона зонд фиксируется в желудке в правильном положении, после чего раздувается второй балон, находящийся в просвете пищевода. Гемостатический эффект достигается за счет механического сдавления кровоточащих сосудов
пищевода. С целью остановки кровотечения возможно приминение этамзилата натрия, хлористого кальция, аминокапроновой кислоты, октреатида.
б. При выполнении фиброэзофагогастродуоденоскопии и обнаружении продольного разрыва слизистой оболочки пищевода с кровотечением, можно попытаться остановить это кровотечение эндоскопически. При этом используется:
1. Обкалывание места кровотечения адреналином
Раствор адреналина гидрохлорида вводят в область кровотечения, а также вокруг источника кровотечения. Гемостатический эффект достигается за счет сосудосуживающего действия адреналина.
2. Аргоно-плазменная коагуляция
Данный метод является одним из наиболее эффективных и одновременно одним изи наиболее технически трудным. Применение метода аргонно-плазменной коагуляции позволяет добиться стойкого гемостаза.
3. Электрокоагуляция
Также достаточно эффективный метод. Часто применение электрокоагуляции сочетают с введением адреналина.
4. Введение склеразантов
Данный метод заключается в том, что гемостатический эффект достигается за счет введение слеразирующих препаратов (полидоканол).
5. Лигирование сосудов
При синдроме Мэлори-Вейса часто используется эндоскопическое лигирование кровоточащих сосудов. Применение эндоскопического лигирования сосудов особенно оправдано при сочетании синдрома Мэлори-Вейса и портальной гипертензии с варикозным расширением вен пищевода.
6. Клипирование сосудов
По своей сути этот метод схож с предыдущим. Разница лишь в том, что на кровоточащий сосуд накладывается не лигатура, а металлическая клипса. Наложение клипс возможно с помощью аппликатора. К сожалению, эндосопическое клипирование сосудов не всегда возможно из-за технических трудностей наложения клипс на сосуды.
в. При синдроме Мэлори-Вейса к хирургическому лечению прибегают в случае неэффективности консервативной терапии и эндоскопических методов лечения. При синдроме Мэлори-Вейса выполнят операцию Бейе:
Доступ: срединная лапоротомия.
Операция: гастротомия, прошивание кровоточащих сосудов.
Рак желудка. TNM классификация. Пути метасгазирования, признаки иноперабельности. Стадии заболевания. Виды расширенной лимфаденэкгомии. Химиотерапия и лучевая терапия при раке желудка.
Рост и распространение рака желудка идут как внут-ристеночно, так и путем перехода на соседние органы. Вначале процесс распространяется по слизистой и подслизистой оболочкам, в дальнейшем проникает в глубокие слои желудочной стенки.
Инфильтрация стенки желудка более выражена при язвенных и инфильтративно растущих (эндофитных) раках, чем при экзофитных (ограниченно очерченных) формах. Наибольшее распространение опухолевого процесса наблюдается в сторону кар-дии по основному току лимфы от желудка вплоть перехода его на пищевод. На двенадцатиперстную кишку рак желудка переходит редко, при этом он инфильтрирует стенку кишки, не захватывая слизистой оболочки.
Рак желудка в 60-70% случаев возникает в антральном отделе, в 10-15% — на малой кривизне, в 10% -— в кардиальном отделе и значительно реже — в других частях желудка. Поражение раковой опухолью всего желудка наблюдается у 3-5% этих больных.
Исходя из характера роста и внешнего вида опухоли С. А. Холдин (1952) предлагает следующую морфологическую классификацию рака желудка.
I. Ограниченно растущий рак (экзофитная форма):
полипообразная, грибовидная, капустообразная формы; 4
блюдцеобразная форма; *
плоский, бляшкообразный рак с поверхностным изъязвлением или без него. П. Инфильтративно растущий рак (эндофитная, диффузная форма):
язвенно-инфильтративная форма;
диффузный рак: а) фиброзного характера (скиррозная — linitis plastica), б) коллоидного характера.
III. Переходные формы (смешанные, неясные формы).
Рак желудка может давать метастазы. Различают три пути метастазирования: по лимфатическим, кровеносным путям и имплантационное метастазирование по брюшине. Этот последний путь метастазирования часто приводит к генерализованному карциноматозу (обычно с асцитом) брюшины с образованием крупных метастазов в полости малого таза (метастаз Шницлера), этот же путь метастазирования некоторые авторы признают основным при метастазах в оба яичника (метастаз Крукенберга), хотя не исключается связь лимфатических путей яичников с лимфатическим коллектором желудка через забрюшинные сосуды.
Гематогенные метастазы часто возникают в печени, реже в других органах.
Главный путь метастазирования — лимфогенный. В соответствии с путями оттока лимфы из различных отделов желудка можно проследить четыре направления: в ретропилорическое пространство, по направлению к воротам печени, соответственно ходу левых желудочных сосудов по малому сальнику и в сторону ворот селезенки по большому сальнику (А. В. Мельников, 1960).
Согласно Japanese Research Society for Gastric Cancer (JRSGC) (1998), регионарными лимфатическими узлами являются перигастральные узлы, расположенные вдоль малой и большой кривизны, а также вдоль левой желудочной, общей печеночной, печеночно-двенадцатиперстной, селезеночной и чревной артерий. Эти лимфатические узлы могут быть удалены при хирургическом вмешательстве на желудке.
Поражение ретропанкреатодуоденальных, брыжеечных и парааортальных лимфатических узлов классифицируется как отдаленные метастазы.
Кроме того, к отдаленным метастазам относятся метастазы в печень, поджелудочную железу, почки, надпочечники и др., а также некоторые типичные метастазы: Вирхова — в область левого надключичного пространства, Крукенберга - в яичники, Шницлера - в дугласово, пузырно-прямокишечное пространства и в пупок.
Клиническая классификация по системе TNM (шестое издание, 2003) выглядит следующим образом:
Т — первичная опухоль:
Тх - недостаточно данных для оценки первичной опухоли;
ТО — первичная опухоль не определяется;
Tis - неинвазивная карцинома: интраэпителиальная опухоль без инвазии ственной пластинки слизистой оболочки (carcinoma in situ),
T1 - опухоль инфильтрирует стенку желудка до подслизистого слоя,
Т2 — опухоль инфильтрирует стенку желудка до субсерозной оболочки;
ТЗ — опухоль прорастает висцеральную брюшину без инвазии в соседние органы-
Т4 — опухоль распространяется на соседние структуры.
N — регионарные лимфатические узлы:
Nx — недостаточно данных для оценки регионарных лимфатических узлов;
N0 — нет признаков поражения регпонарных лимфатических узлов;
N1 — имеются метастазы в 1-6 регионарных лимфатических узлах;
N2 — имеются метастазы в 7-15 регионарных лимфатических узлах;
N3 — имеются метастазы более чем в 15 регионарных лимфатических узлах.
М — отдаленные метастазы,
Мх — недостаточно данных для определения отдаленных метастазов;
МО — нет признаков отдаленных метастазов;
M1 — имеются отдаленные метастазы.
Симптомы рака желудка разнообразны и не всегда оди¬наково выражены. Так, наблюдаются больные раком желудка, считающие себя здоро¬выми, и больные, диагноз заболевания которых ясен при первом ознакомлении с ними. Особенно сложно бывает согласиться с диагнозом рака желудка, когда он развивается у больных, постоянно наблюдаемых врачами в течение ряда лет по пово¬ду хронической язвы желудка, хронического гастрита с пониженной желудочной секрецией, хроническим колитом и боль¬ных с астеническим складом нервной си¬стемы, «надоевших» своим врачам тысяча¬ми жалоб. В этих случаях так называемый синдром малых признаков рака желудка, приписываемый А. И. Савицкому, но из¬вестный еще с 1914 г. (В. С. Левит, 1914), не имеет никакого значения в распозна¬вании рака желудка. Эти малые призна¬ки в виде слабости, бессонницы, пониже¬ния аппетита, потери удовлетворения едой, похудания, депрессии и др., появив-шиеся на фоне предшествующего полного здоровья, должны привлечь внимание добросовестного и вдумчивого врача. При стечении таких обстоятельств при совре¬менных методах диагностики распознава¬ние рака желудка состоится практически во всех случаях, в том числе при озлока-чествленных полипах, хронической язве желудка и антральном гастрите типа бо¬лезни Менетнер (Menetner), если будет сделана эндоскопическая биопсия.
Локализация раковой опухоли в желудке, характер ее роста сильно влияют на клиническую картину заболевания. Появление дисфагии непременно заставит поду¬мать о раке кардиального отдела желудка или пищевода. Однако при кардиальной локализации рака дисфагия иногда отсутствует. Заболевание может проявляться в виде стенокардии, и такие больные иногда долго лечатся у терапевтов.
Появление рвоты съеденной накануне пищей, «шум плеска» при сотрясении брюш¬ной стенки, быстрое похудание больных непременно наведут на мысль о стенозе выходного отдела желудка, а дальше — дело диагностической техники.
Наибольшие трудности диагностики возникают при поражении раковой опухолью малой кривизны желудка, его свода, задней стенки и большой кривизны. Эти раки отличаются длительным «немым» течением, но почти всегда наблюдаются симптомы малых признаков. При этих локализациях опухоли часто развивается анемия, больных тревожит потеря массы тела, утомляе¬мость и периодическое повышение темпера¬туры тела. На этом фоне неожиданно ет развиться желудочное кровотечение, перфо¬рация желудка на месте опухоли, а также симптомы заболевания других органов при переходе на них ракового процесса. Часто бывает так, что до обнаружения основного очага в желудке на первый план выступают асцит, увеличенная метастазами печень и опухолевые узлы в левой надключичной ямке, в полости малого таза и пупке, что свидетельствует о неизлечимости больного.
Диагностика рака желудка в настоящее время сильно упростилась. Добротно собран¬ный анамнез, последовательная пальпация живота, обследование всех мест возможной локализации типичных отдаленных метаста¬зов, выполнение УЗИ живота, использова¬ние компьютерной томографии живота, об¬щепринятые исследования крови дают много сведений о патологическом процессе. Однако определение главного очага заболевания — рака желудка — позволяют сде¬лать рентгенологическое исследование желудка и фиброгастроскопия. Первое иссле¬дование решает вопрос диагностики почти в 90% случаев, а ФГДС с при¬цельной биопсией доводит его до 99%, в том числе и в плане дифференциального диагноза. Большую помощь в определении распространенности процесса оказывает лапароскопия и, в случае сомнений, радиоизотопная диагностика. Однако во многих случаях диагностика в расширенном плане продолжается во время оперативного вме-шательства, если оно предпринимается.
Лечение. Основным методом лечения рака желудка в настоящее время является хирургический. Химиотерапия, лучевая терапия и иммунотерапия, как самостоя¬тельные методы, так и в сочетании с хирургическим лечением, применяются в специа¬лизированных учреждениях, однако сколько-нибудь значительного успеха при этом пока не достигается.
Показания к операции имеются во всех случаях рака желудка, если отсутствуют несомненные признаки отдаленных метастазов и асцита, а также при наличии непро¬ходимости кардиопнщеводного участка и выходного отдела желудка и если общее состояние больного позволяет выполнить оперативное вмешательство.
Основными, так называемыми радикальными, операциями при раке желудка считаются субтотальная резекция желудка (дисталыгая — при раке выходного отдела и проксимальная — при раке проксимального отдела желудка) и гастрэктомия.
Субтотальная дистальная резекция желудка должна выполняться только при эк-зофитной опухоли, расположенной в дистальных отделах желудка и не распространяю¬щейся далее'его угла. Проксимальная субтотальная резекция желудка должна выпол¬няться при экзофлтной опухоли кардиального отдела желудка.
При расположении экзофитных опухолей в теле желудка, тотальном поражении желудка, а также при инфильтративных опухолях любой локализации показана гастрэктомия. Особенности дистальной субтотальной резекции желудка при раке заключаются в широкой мобилизации желудка вместе с обоими сальниками, перевязке левой желудочной артерии у места отхождения ее от чревной, полном удалении всей малой кривизны и отсечении двенадцатиперстной кишки, отступив от привратника вниз на 2-3 см. Линия пересечения по малой кривизне проходит в 1-2 см от пищевода, а по большой - на уровне нижнего полюса селезенки. При прорастании опухоли в соседние органы нередко выполняют комбинирован¬ные (расширенные) операции, удаляя вместе с желудком участки пораженной печени, поджелудочной железы, селезенки, поперечной ободочной и тонкой кишок. Ради¬кальным операциям из поступающих в лечебные учреждения подвергаются 40-60% больных раком желудка.
Кроме радикальных операций при раке желудка часто приходится выполнять паллиативные и симптоматические вмешательства.
Сущность паллиативной резекции желудка состоит в том, что удаляется часть желудка с опухолью (например, при кровотечении и перфорации), но остаются отда¬ленные метастазы. Симптоматические вмешательства в виде обходных анастомозов, гастростомы и еюностомы производятся при неосуществимости радикальной опера¬ции по поводу непроходимости кардиалъного отдела пищевода и выходного отдела желудка. Паллиативная экстирпация желудка недопустима. Паллиативные и симпто¬матические операции существенно не продлевают жизнь, но часто избавляют больных от физических и душевных страданий.
Рак желудка. Осложнения: кровотечения, прободение, стеноз. Клиника, диагностика, дифференциальный диагноз.
К частым осложнениям рака желудка следует отнести:
- истощение (кахексия), которое обусловлено нарушением питания и интоксикацией;
- хроническое малокровие, связанное с голоданием (нарушено усвоение пищи), мелкими частыми кровопотерями, нарушением выработки антианемического фактора (фактор Кастля), опухолевой интоксикацией, метастазами в костный мозг (нарушение гемопоэза);
- общее острое малокровие, которое может возникнуть в результате разъедания крупных сосудов и служить причиной смерти;
- перфорация опухолевой язвы желудка и развитие перитонита;
- флегмону желудка в результате инфицирования;
- развитие желудочной и кишечной непроходимости, возникающей при прорастаниии и сдавлении просвета привратника и кишки (чаще ободочной);
- развитие механической желтухи, портальной гипертензии, асцита в результате прорастания опухолью головки поджелудочной железы, желчных протоков, воротной вены или сдавления их метастазами в лимфоузлы ворот печени.
Одним из тяжелых осложнений рака желудка является кровотечение.
Кровотечения чаще возникают при раковой опухоли: расположенной на малой кривизне желудка. Они могут возникнуть в любой стадии процесса, но чаще наблюдаются в III-IV стадии. Кровотечение возникает в результате распада или изъязвления опухоли или разрыва кровеносного сосуда, пораженного опухолью. В других случаях деструкция опухоли и развитие гнойного и воспалительного процессов ведут к тромбированию и аррозии питающих ее сосудов, что в свою очередь является причиной гангрены значительных участков опухоли и ее распада, сопровождающегося кровотечением. Более часто осложняются кровотечением язвенные формы рака. Чаще кровоточат опухоли желудка, расположенные в теле и антральном отделе, значительно реже кровотечение возникает при опухолях кардии. Это необходимо учитывать при определении локализации источника кровотечения, особенно при его профузном характере. Наиболее интенсивные кровотечения характерны для рака малой кривизны желудка, где проходят ветви левой желудочной артерии.
Кровотечение может быть скрытым и диагностироваться лишь при исследовании кала на скрытую кровь (реакция Грегерсена). В других случаях клиническая картина довольно типична. Главным и нередко единственным симптомом кровотечения является кровавая рвота (рвота "кофейной гущей"), часто повторная, несколько реже - дегтеобразный стул, или, наконец, и то. и другое вместе.
В связи с кровопотерей у больных развивается выраженная в той или иной степени картина острого малокровия. При незначительных кровотечениях симптомы острой анемии выражены в большинстве случаев нечетко или могут отсутствовать. При выраженных кровотечениях, сопровождающихся рвотой, дегтеобразным стулом, падением гемоглобина до 6 ммоль/л, больные жалуются на общую слабость, головокружение, наблюдаются бледность кожных покровов и видимых слизистых оболочек, тахикардия и снижение уровня артериального давления. При тяжелых профузных кровотечениях,. сопровождающихся быстрым падением гемоглобина до 5-4 ммоль/л и ниже. развивается тяжелый сердечно-сосудистый коллапс с падением уровня артериального давления до 60-40 мм рт.ст. и ниже. Пульс учащается до I20-I40 уд в мин. Некоторые больные теряют сознание, кожные покровы их принимают восковидный оттенок и покрывается холодным потом, лицо делается мертвенно бледным, отмечается цианоз губ, расширение зрачков. Количество эритроцитов снижается до 2 млн в I мм3 (2 Т/л ) и менее. В терминальной стадии пульс становится нитевидным, часто не сосчитывается, у больных появляется непроизвольное мочеиспускание и дефекация.
Скрытое кровотечение из раковой опухоли нередко не распознается на фоне раковой анемии и кахексии.
Выбор оптимальной лечебной тактики при кровотечении, обусловленном распадающейся опухолью желудка, зависит прежде всего от объема потерянной крови, и от того, остановилось кровотечение или нет. Большую помощь при этом может оказать срочная эндоскопия. Она позволяет не только определить локализацию источника кровотечения, но также установить факт его прекращения или продолжения.
Лечение больных с желудочным кровотечением ракового происхождения в большинстве случаев должно начинаться с консервативных мероприятий: холод на живот, голод, хлористый кальции, викасол, аминокапроновая кислота, гемотрансфузии, переливание кровезаменителей. Однако при проведении указанных мероприятий не всегда удается добиться успеха. Консервативная терапия при кровотечении у больных раком желудка позволяет в большинстве случаев лишь временно остановить кровотечение и подготовить больного к операции.
Большие возможности для местной остановки желудочного кровотечения дает использование эндоскопа. У тяжелобольных эндоскопию можно проводить только в тех случаях, когда обеспечены срочное оказание анестезиологического пособия и реанимационная помощь. При гастроскопии можно добиться гемостаза путем охлаждения места кровотечения хлорэтилом или углекислым газом, прицельного орошения источника кровотечения гемостатическими средствами. В отдельных случаях кровотечение останавливается путем электрокоагуляции
Показаниями к экстренному оперативному вмешательству являются: 1) не останавливающееся под влиянием консервативной терапии кровотечение, 2) прекратившееся кровотечение при угрозе его возобновления, 3) рецидив кровотечения после его остановки в условиях стационара, 4) сочетание кровотечения с перфорацией.
Следует иметь в виду, что одномоментная потеря 500 мл крови при продолжающемся кровотечении из раковой опухоли желудка является показанием к немедленной операции на высоте кровотечения. Таких больных следует сразу же направлять в операционную, где одновременно с анестезиологическим пособием им проводят интенсивную инфузионно-трансфузионную терапию.
Нередко весьма трудно выбрать метод хирургического лечения при кровотечении из раковой опухоли желудка непосредственно во время операции. Следует учитывать состояние больного, локализацию и стадию развития раковой опухоли и часто чрезвычайно сложные топографо-анатомические взаимоотношения, возникшие в результате распространения опухоли за пределы желудка. Методом выбора является выполнение радикальной или паллиативной резекции желудка.
Прободение опухоли желудка - сравнительно частое осложнение, требующее неотложного хирургического вмешательства.
Наиболее часто происходит прободение в свободную брюшную полость с развитием гнойного и нередко гнилостного перитонита.
Перфоративное отверстие обычно неправильной формы, с неровными истонченными краями грязно-серого цвета. Встречаются и отверстия с плотными, утолщенными краями белесоватого цвета, имеющие вид извилистого свищевого хода, щели, канала или небольшого дефекта ткани опухоли. Нередко наблюдается большие прободные отверстия (до 1 см в диаметре). В запуганных стадиях рака возможна микроперфорация, которая может протекать как с выраженной картиной перфорации полого органа, так и в форме скрытого течения. Обычно перфорация бывает одиночной, но может быть двойной и множественной. Перфорация возможна при любой локализации злокачественного процесса, но чаще встречается при опухолях малой кривизны и пилорического отдела желудка.
Перфорация рака желудка может сопровождаться кровотечением, что затрудняет диагностику и несомненно ухудшает прогноз возникшего осложнения. Иногда кровотечение и развившаяся вследствие этого анемия становятся ведущими в клинической картине течения опухолевого процесса и затуиевывают симптомы прободения.
Перфорация раковой опухоли желудка отличается разнообразием клинических проявлений, изменчивостью и непостоянством симптомов. Она может характеризоваться типичной клинической картиной перфорации полого органа, но может протекать атипично, скрыто, без обычных признаков прободения. Прободной рак желудка имеет много сходных черт с прободением язвы и в большинстве случаев так и расценивается.
Симптоматика прободения зависит от локализации и величины перфорационного отверстия, изменений местного характера, стадии развития опухолевого процесса, времени, прошедшего с момента перфорации, сочетания перфорации с другими осложнениями. Для острой формы прободения характерно внезапное появление резких болей, а в дальнейшем развитие клинической картины прободения полого органа и симптомов перитонита. В этих случаях обычно отчетливо выражены признаки прободения: резкое напряжение передней брюшной стенки. положительный симптом Щеткина-Блюмберга, разлитая болезненность по всему животу, симптом исчезновения печеночной тупости. При острой форме, как правило, легко диагностируют перфорацию, но не распознают раковый характер процесса. Нередко перед прободением возникают продромальные симптомы. Весьма характерными клиническими предвестниками перфорации являются усиление боли в эпигастральной области с иррадиацией в подреберье иди надплечье, икота, тошнота, рвота, повышение температуры тела, озноб. Появление предвестников прободения связано с развитием воспалительно-деструктивных изменений в стенке желудка и прилегающих к нему органов. В этот момент могут определяться умеренное напряжение мышц передней брюшной стенки и даже симптомы раздражения брюшины при сохранении печеночной тупости и отсутствии признаков свободного газа в брюшной полости.
В запущенных случаях злокачественного процесса типичная картина перфорации полого органа может отсутствовать, или быть слабо выраженной, или напоминать таковую прикрытой перфорацией.Характерным симптомом прободного рака желудка, как и прободной язвы, служит наличие свободного газа в брюшной полости, которое выражается в исчезновении печеночной тупости. В положении больного на спине на два пальца выше края реберной дуги по сосковой и парастернальной линиям справа на месте определяемого обычно перкуторно тупого звука выявляется отчетливый тимпанит.
Выбор метода оперативного вмешательства при прободном раке желудка является трудной задачей, особенно в Ш-IV стадии злокачественного процесса. Зачастую хирургу приходится решать ее непосредственно во время экстренного оперативного вмешательства, предпринятого по поводу предполагаемой прободной язвы желудка или двенадцатиперстной кишки.
Нередко злокачественный характер перфорации не распознается даже во время операции, поэтому производится типичное ушивание перфорационного отверстия, как при обычной язве. Особенно трудно установить истинный характер прободения в ранних стадиях ракового процесса, когда оно макроскопически не отличается от перфорации при язве желудка. Это связано с тем, что в I-II стадии рака желудка инфильтрация и уплотнение краев перфоративного отверстия имеет такой же вид, как при обычной язве. Только при гистологическом исследовании язвенных краев или лимфатических узлов в случае резекции желудка удается установить точный диагноз.
Выбор объема оперативного вмеиательства при прободном раке желудка зависит от стадии злокачественного процесса, локализации опухоли, наличия или отсутствия перитонита, состояния больного, квалификации хирурга, владения им техникой резекции желудка, а также от наличия условий для проведения такой операции и прежде всего обязательного участия анестезиолога и ассистента. Операцией выбора при прободном раке желудка следует считать субтстальную резекцию желудка. Крайне редко в этих случаях осуществляют проксимальную резекцию или экстирпацию желудка, которые сопровождаются весьма высокой летальностью, особенно при выполнении по неотложным показаниям. Эти операции могут оказаться паллиативными в смысле соблюдения онкологических принципов и в то же время радикальными в отношении ликвидации патологического очага, являющегося непосредственной угрозой жизни. В неоперабельной стадии рака желудка, но при наличии подвижной опухоли показана паллиативная резекция или даже экстирпация. При малоподвижной опухоли в некоторых случаях удается мобилизовать и выделить желудок вместе с опухолью и произвести резекцию. Однако выполнение паллиативной резекции не всегда возможно из-за распространения злокачественного процесса на прилегающие органы и ткани. При общем тяжелом состоянии больного: разлитом перитоните и неподвижной опухоли, показано ушивание прободного отверстия с дренированием брюшной полости.
Быстрота возникновения стеноза зависит от формы роста опухоли и ее локализации. При экзофитных paкax, растущих в просвет желудка, стеноз наступает быстрее, чем при эндофитных. При локализации опухоли в канале привратника стенозирование наступает раньше, чем при раке антрального отдела желудка.
Различают три стадии стеноза выходного отдела желудка. В начальной стадии (компенсированный стеноз) наряду с умеренным сужением выхода из желудка имеет место гипертрофия мускулатуры желудка с небольшим увеличением его объема. В следующей стадии (субкомпенсированный стеноз) сужение выхода из желудка прогрессирует, желудок растягивается, стенка его начинает атрофироваться, отмечаются явления застоя пищи в желудке. Наконец, заключительная стадия (декомпенсированный стеноз) проявляется почти полной непроходимостью привратника, резким растяжением желудка и атрофией его стенки.
.Рак пилорического отдела желудка в ранних стадиях клинически проявляется чувством переполнения в подложечной области после приема пищи, урчанием в животе, отрыжкой воздухом или пищей. С ростом опухоли симптомы стенозирования усиливаются, приобретая характер стойкой задержки эвакуации содержимого желудка. Чувство переполнения в подложечной области после еды усиливается, отрыжка приобретает кислый, затем тухлый запах. К концу дня у больного появляется рвота пищей, съеденной не только в течение дня, но и накануне. Рвота носит постоянный характер, повторяясь ежедневно. Нередко больные сами вызывают рвоту. Иногда в рвотных массах определяется примесь свежей или измененной крови. После рвоты больной испытывает значительное облегчение.
Сужение привратника может достичь крайней степени, при которой полностью прекращается поступление пищи из желудка в двенадцатиперстную кийку. Наступает резкое похудание, переходящее в кахексии. С рвотными массами больной теряет большое количество электролитов.
Стеноз выходного отдела желудка является жизненным показанием к операции. Однако операция может быть выполнена только после полноценной предоперационной подготовки больного.
Для борьбы с обезвоживанием назначаются внутривенные инфузии раствора Рингера, изотонического раствора поваренной соли. 5% раствора глюкозы. Необходимое количество жидкости рассчитывается из суточной потребности организма в соответствии с весом больного и степенью обезвоженности, которая определяется на основании показателей гематокрита (норма 0.85-1,05) и пробы Мак-Клюра-Олдрича. На I кг веса больного вводится 30-50 мл жидкости в сутки. При этом необходимо контролировать суточный диурез и центральное венозное давление, объем циркулирующей крови.
Наряду с обезвоживанием при частой рвоте наблюдается гипохлоремия (в норме хлоридов 95-110 ммоль/л) и гипокалиемия (калий сыворотки 4,1-6,1 ммоль/л). В связи с этим назначается вливание 10% раствора поваренной соли (50-100 мл) и 3% раствора хлористого калия (200 мл).
У больных со стенозом привратника должна быть проведена тщательная подготовка желудка к операции. В связи с застоем в желудке развиваются процессы брожения и гниения, в связи с чем наблюдаются воспалительный процесс в стенке желудка, лейкоцитарная инфильтрация. Стенка желудка в таких случаях легко прорезается при накладывании швов. Для уменьшения воспалительных явлений необходимо ежедневное промывание желудка на ночь большим количеством воды с добавлением соляной кислоты. Такая подготовка должна проводиться в течение 3-5 дней.
Оперативное лечение при раке выходного отдела желудка может быть выполнено в виде радикальной операции, паллиативной резекции желудка, симптоматической операции и эксплоративной (пробной) лапаротомии.
Из радикальных операций при дистальном раке желудка выполняется дистальная субтотальная резекция, а при инфильтративных формах и большой распространенности процесса - гастрэктомия.
При субтотальной резекции малую кривизну пересекают отступя на 1.5-3 см от пищевода, большую - на уровне нижнего полиса селезенки. В дистальном направлении линия пересечения проходит через двенадцатиперстную кишку на расстоянии 1,0-1.5 см за привратником.
При субтотальной резекции и других радикальных операциях вместе с резецируемой частью желудка должны быть удалены регионарные лимфатические узлы. С этой целью одним блоком с желудком удаляют большой и малый сальники с заключенными в них лимфатическими узлами, а левую желудочную артерию пересекают в желудочно-поджелудочной связке непосредственно у места отхождения от чревной артерии.
При наличии отдаленных метастазов и технически удалимой опухоли выполняют паллиативную резекцию желудка; Во время операции удаляют сальники с лимфатическими узлами. Операция ликвидирует тягостные симптомы, продлевает жизнь больного на несколько месяцев, предотвращает осложнения опухоли желудка. Последующая адъювантная химиотерапия иногда позволяет увеличить продолжительность жизни оперированных.
При неоперабельном раке желудка, осложненном стенозом привратника, возможно выполнение обходного гастроэнтероанастомоза. Операция восстанавливает эвакуацию содержимого из желудка, ликвидирует мучительнув рвоту и улучшает состояние больных. Гастроэнтероанастомоз может быть выполнен с задней стенкой желудка (по Гаккеру-Петерсену) или с передней (по Бельфлеру). Из-за возможного сдавления анастомоза метастазами в забрюшинные лимфатические узлы обычно накладывают передний впередиободочный анастомоз на длинной петле с дополнительным брауновским соустьем
Рак кардиального отдела желудка. Клиника. Диагностика, Дифференциальный диагноз. Показания и противопоказания к радикальным и паллиативным операциям Основные этапы проксимальной резекции желудка и гастрэктомии,
Рак кардиального отдела желудка. Первым симптомом является боль в эпигастральной области под мечевидным отростком, нередко иррадиирующая в область сердца. По мере роста опухоли нарастает дисфагия, вначале при глотании грубой пищи, а затем и при приеме жидкости. Чувство давления за грудиной, слюнотечение, срыгивание пищей - признак расширения пищевода над опухолью и застоя пищи в пищеводе. Больные быстро истощаются. Рентгенологически определяется дефект наполнения в кардиальном отделе желудка.
Этапы операции:
Мобилизация желудка по большой и малой кривизне.
Резекция 2/3 мобилизованного желудка.
Обработка культи двенадцатиперстной кишки.
Обработка культи желудка.
Мобилизация петли тонкой кишки.
Наложение позади-оободочного гастроэнтероанастомоза на короткой петле.
Рак тела желудка. Клиника. Диагностика, дифференциальный диагноз. Принципы хирургическою лечения Комбинированные операции.
Рак тела желудка долгое время протекает бессимптомно. Среди первых проявлений рака этой локализации преобладают общие симптомы: нарастание слабости, быстрая утомляемость, похудание, анемия. Могут быть снижение и потеря аппетита, отрыжка, рвота. При распаде опухоли наблюдается повышение температуры тела.
На рентгенограммах выявляют большой дефект наполнения. При локализации рака в области дна желудка первыми проявлениями может быть боль типа стенокардии.
Вздутие живота, урчание, задержка стула бывают обусловлены прорастанием опухоли большой кривизны желудка в поперечную ободочную кишку с сужением ее просвета.
Радикальность операции включает:
1) иссечение желудка, двенадцатиперстной кишки и пищевода в пределах здоровых тканей;
2) удаление в едином блоке с желудком тех групп лимфоузлов, которые могут быть поражены метастазами при данной локализации рака;
3) абластическое оперирование, т. е. использование комплекса приемов, направленных на уменьшение возможности так называемой манипуляционной диссиминации.
Противопоказания к операции:
1) наличие отдаленных метастазов в печень, легкие, надключичные лимфоузлы, наличие большого асцита, в случае поражения метастазами лимфатических узло 3-го и 4-го порядка;
2) тяжелые сопутствующие заболевания.
Уровень пересечения органов определяется локализацией опухоли, характером ее роста и распространенностью. Линия резекции от краев опухоли должна отстоять при инфильтративно-язвенных формах не менее чем на 8-10 см в обе стороны от пальпируемой границы опухоли, при экзофитно растущих формах - не менее чем на 6-8 см от пальпируемой границы опухоли.
Пересечение пищевода надо производить не менее чем на 3 см выше пальпируемой верхней границы опухоли при экзофитной форме и на 5-6 см при инфильтративной форме рака.
При раке пилорического отдела желудка, особенно при эндофитных формах, возможно распространение опухолевых клеток по лимфатическим сосудам подслизистого и мышечного слоев на начальную часть двенадцатиперстной кишки. В связи с этим необходимо удалять 2-3 см двенадцатиперстной кишки.
Основные типы радикальных операций для лечения рака желудка:
1) дистальная субтотальная резекция желудка, выполняемая чрезбрюшинно;
2) гастрэктомия, выполняемая чрезбрюшинным и чрезплевральным доступом;
3) проксимальная субтотальная резекция желудка.
Рак пилорического отдела желудка. Клиника. Диагностика. Дифференциальный диагноз. Подготовка к операции. Показания и противопоказания к радикальным и паллиативным операциям. Отличие дистальной резекции желудка при раке и язвенной болезни.
Рак пилорического отдела желудка вызывает стенозирование и появление симптомов нарушения эвакуации. Вначале возникают непостоянное чувство тяжести, полноты, распирания в эпигастральной области после еды, отрыжка пищей. По мере роста опухоли симптомы непроходимости усугубляются и становятся постоянными.
Стойкая задержка эвакуации пищи вызывает распирающую боль в эпигастральной области, а компенсаторное усиление перистальтики придает ей схваткообразный характер. Часто возникает рвота съеденной пищей, приносящая временное облегчение. Накапливающаяся в желудке пища подвергается брожению, появляется дурно пахнущая отрыжка. Рвота непереваренной пищей, съеденной задолго до рвоты и даже накануне, возникает несколько раз в день. Больные прогрессивно худеют, наступает обезвоживание. Рентгенологически выявляется сужение выходного отдела желудка.
Дистальная резекция:
Этапы операции:
доступ, ревизия;
мобилизация желудка и двенадцатиперстной кишки;
пересечение двенадцатиперстной кишки и ушивание ее культи;
резекция желудка и восстановление непрерывности пищеварительного тракта;
ушивание операционной раны.
Вместе с желудком единым блоком удаляют малый и большой сальник с лимфатическими узлами, расположенными вдоль сосудов по обеим кривизнам желудка, околопилорические лимфатические узлы и лимфатические узлы по ходу левой желудочной артерии, которую пересекают у места отхождения ее от чревной.
При раке производят расширенную лимфодиссекцию.
Кишечная непроходимость. Классификация. Патогенетические и патофизиологические изменения в кишечнике и организме при разных видах непроходимости кишечника. Коррекция гомеостаза в послеоперационном периоде.
Непроходимость кишечника (ileus) относится к числу наиболее грозных и тяжелых заболеваний.синдром, характеризующийся частичным или полным нарушением продвижения содержимого по пищеварительному каналу и обусловленный механическим препятствием или нарушением двигательной функции кишечника.
Классификация. Предложения по классификации кишечной непроходимости мн гообразны, но в основе большинства из них лежит принцип Е. Wahl (1889). Он разде лил все виды непроходимости на странгуляционную и обтурационную. С позиций практической хирургии привлекает внимание предложение придерживаться следую¬щей классификации.
I. По происхождению:
1) врожденная;
2) приобретенная.
II. По течению:
1) острая;
2) хроническая.
Ш. По механизму развития:
1) механическая: а) странгуляционная, б) обтурационная (закупорка изнутри
и сдавление извне): опухолевая, неопухолевая, в) смешанная;
2) функциональная: а) спастическая, б) паралитическая.
IV. По локализации механического препятствия:
1) тонкокишечная: а) высокая, б) низкая;
2) толстокишечная.
Кроме того, по развитию патологического процесса выделяют следующие стадии:
I - стадия острых нарушений пассажа по кишечнику;
II — стадия острых расстройств внутристеночной кишечной гемоциркуляции;
III — стадия перитонита.
Наиболее важными моментами в этой классификации следует считать выделе¬ние механической и динамической, а также странгуляционной и обтурационной непроходимости.
Существенное отличие первых двух видов состоит в том, что при динамической непроходимости просвет кишки свободен. Это в большинстве случаев обратимое забо¬левание, развивающееся в результате нарушения мышечного тонуса кишечника на почве функциональных или органических поражений его иннервационного аппарата. Механическое препятствие отсутствует, но перистальтика прекращается.
Спастическая непроходимость характеризуется тем, что спазм развивается на отдельных участках кишечника или является общим. Предположительно механизм ее возникновения сводится к рефлекторным влияниям из различных источников, в том числе от раздражения слизистой оболочки самой кишки инородными телами, ядовиты¬ми веществами и т. д. Известно, что иннервация большинства органов брюшной поло¬сти осуществляется из одного и того же нервного сплетения. Любое раздражение этих органов может привести к рефлекторному спазму. Особенно подвергнуты такому влия¬нию лица с вегетоневрозами. Спазм, как правило, сменяется параличом кишки.
Паралитическая непроходимость встречается значительно чаще, чем спастиче¬ская. При ней отмечается расширение кишки. Наиболее часто парез и паралич кишки наступают вследствие воздействия токсинов или перехода воспалительного процесса с серозного покрова на нервно-мышечный аппарат кишки (при перитоните). Раздраже¬ние брюшинного покрова (травма, излияние в забрюшинную клетчатку или в полость брюшины крови, высыхание, охлаждение и т. д.) также ведут к развитию паралити¬ческой непроходимости. Кроме того, в силу указанных выше особенностей иннерва¬ции, такая непроходимость может появиться и при острых воспалительных процессах в других органах брюшной полости.
Динамическая кишечная непроходимость составляет в структуре острой кишеч¬ной непроходимости не больше 3-5%, хотя хирурги встречаются с ней практически ежедневно в раннем послеоперационном периоде у больных, оперированных на орга¬нах брюшной полости и забрюшинного пространства. К ее развитию могут привести метаболические нарушения (диабетическая и уремическая комы), острые нарушения кровообращения (тромбоз брыжеечных сосудов, инфаркт селезенки и др.).
Наиболее часто как при диагностике, так и при лечении трудности возникают при механической кишечной непроходимости. Выделение странгуляционного и обтурационного вида ее имеет принципиальное зна¬чение. Если обтурационная непроходимость характеризуется закрытием про-света кишечной трубки извне или изнутри (опухолью, каловым или желчным камнем, клубком гельминтов и т. д.), то при стран-гуляционной непроходимости нарушается еще и кровоснабжение кишки. Такое со-стояние возникает в результате заворота ки-шечной петли вокруг своей оси , образования узла между несколькими пет¬лями кишки , ущемления ки¬шечной петли вместе с брыжейкой в гры¬жевых воротах .
К смешанной кишечной непроходимо¬сти относится инвагинация, при которой происходит внедрение одной кишки в дру¬гую . При этом внедрившаяся кишка может закупоривать (обтурировать) просвет другой кишки и приводить к сдав-лению сосудов своей брыжейки.
Ущемление кишки и спаечная непро¬ходимость также могут быть отнесены к смешанной кишечной непроходимости.
Хроническая непроходимость прежде всего связана с развитием мощных сраще¬ний в брюшной полости. Большинство та¬ких больных были многократно опериро¬ваны вследствие рецидивов острой кишеч¬ной непроходимости. Иногда к хронической форме кишечной непроходимости относят случаи неполного, частичного перекрытия просвета кишки. Такие ситуации могут воз¬никнуть, например, при новообразованиях кишки, при наличии многокамерных пос-леоперационных вентральных грыж.
В современных концепциях патогенеза синдрома ОКН прослеживаются два пути развития патологического процесса: ишемический и обтурационный.
Механизм ишемических нарушений при ОКН достаточно универсален и связан как с общими повреждениями микроциркуляции, так и с влиянием на кровообраще¬ние кишечной гипертензии и других звеньев патогенеза. Волемические и гемодинами-ческие изменения возникают в связи с сокращением артериального притока и веноз¬ного оттока за счет компрессии сосудов брыжейки (при странгуляционных видах непроходимости), либо внутристеночных сосудов за счет повышения критического давления в просвете кишки при функциональной или обтурационной ОКН.
В последующем под влиянием биологически активных веществ происходит ише¬мический паралич прекалиллярных сфинктеров, развивается стаз и агрегация фор¬менных элементов крови. Свободные тканевые кинины и гистамин нарушают прони¬цаемость сосудистой стенки, что способствует появлению интерстициального отека, это в совокупности с ишемией и действием эндотоксинов приводит к деструкции кишечной стенки с некробиозом всех ее слоев даже при обтурационных формах ОКН, а следовательно, и к развитию перитонита. Острая кишечная непроходимость, по сути, — это осложнение, а основное заболевание, являющееся этиологическим факто¬ром, оказывается на втором плане.
a. Универсальность механизмов развития ОКН независимо от причин заболевания позволяет рассматривать ее как синдромную патологию. Считается, что поврежде¬ния основных функций кишечника, характерные для кишечной непроходимости, объединяются в синдром кишечной недостаточности или энтераргию. Катастрофи¬ческий рост обменных расстройств при синдроме кишечной недостаточности являет¬ся следствием нарушения гомеостаза, в норме поддерживаемого межуточным обме¬ном между энтеральной и внутренней средой. Доказано, что «синдром кишечной недостаточности* в определенной мере универсален и присущ многим заболевани¬ям. Он является составной частью описанного в конце 1970-х гг. синдрома полиор¬ганной недостаточностb
Патологические изменения в кишке при ОКН разви-ваются прежде всего в участках, противоположных месту вхождения брыжеечных сосудов. Вначале возникает деструкция слизистой оболочки, а затем и других слоев кишечной стенки. Тяжесть и темп некробиотических изменений нарастает значитель¬но быстрее при странгуляционной непроходимости, а также в приводящей петле кишки, чем в отводящей. В приводящей кишке они располагаются намного дальше в проксимальном направлении, чем в отводящей кишке в дистальном направлении.
Клиника и диагностика. Клиническая картина непроходимости разнообразна и изменчива. С течением времени одни симптомы могут исчезать, другие появляются. Однако окончательная оценка состояния больного не может быть отложена до появ-ления какого-нибудь несомненного признака. Все усилия врача на любом этапе болезни должны быть направлены на самые тщательные поиски тревожных симпто¬мов этого грозного патологического состояния и, несомненно, учтены даже косвен-ные признаки.
Клиническая картина механической кишечной непроходимости зависит не толь¬ко от ее формы, но также от уровня закупорки, сроков заболевания, индивидуальных особенностей больного и других факторов.
Известно, что чем выше расположено препятствие, вызвавшее непроходимость, тем тяжелее клинически протекает это заболевание. Чем больше времени проходит от начала заболевания, тем больше вероятность появления симптомов перитонита. Наи-более тяжело непроходимость протекает в раннем детском возрасте и у пожилых людей. При всем многообразии клинической картины все же можно выявить ряд доминирующих симптомов, позволяющих распознать ее. К этим симптомам относятся боль, рвота, задержка стула и газов.
Боль относится к наиболее ранним и постоянным симптомам заболевания. Самой характерной особенностью при обтурационной непроходимости являются схваткооб-разные боли. Появление боли совпадает с моментом прохождения перистальтической волны перед препятствием. Схватка может быть очень мучительной, и взрослые люди даже просят врача на этот момент прервать осмотр. С прекращением схватки оль утихает, но на короткое время (на 2-3 мин), а затем вновь возникает прогрессиро-ванием болезни сила мышечных сокращений кишки ослабевает, наступает парез, болезненные проявления успокаиваются.
Динамическая кишечная непроходимость. Классификация. Этиология. Патогенез. Клиника. Диагностика. Дифференциальный диагноз. Принципы лечения.
Динамическая непроходимость кишечника характеризуется стойким парезом или параличом кишечника или стойким спазмом. Функциональные расстройства, ведущие к паралитической динамической непроходимости, бывают обусловлены острыми воспалительными процессами в брюшной полости (холецистит, панкреатит, аппендицит, перитонит) или забрюшин-ной клетчатке (паранефрит и др.), травмами и травматичными операциями, интоксикацией, острыми нарушениями кровообращения в органах брюшной полости (тромбоз брыжеечных сосудов, инфаркт селезенки), забрю-шинными гематомами и др. Метаболические нарушения (диабетическая, уремическая кома), интоксикация, гипокалиемия также могут привести к развитию паралитической непроходимости кишечника. Спастическая динамическая непроходимость чаще вызывается аскаридами, отравлением свинцом, плоскостными спайками в брюшной полости, печеночной порфирией.
Этиология: чтобы вызвать стаз кишечного содержимого и клинические проявления динамической кишечной непроходимости, достаточно того, чтобы был парализован не весь кишечник, а лишь какой-либо его отдел Отсутствие пропульсивной перистальтической волны обусловливает застой в приводящем отрезке кишки. Паралитическая непроходимость кишечника развивается как осложнение различных заболеваний и травм органов брюшной полости. Все перитониты ведут к появлению симптомов паралитической непроходимости. Нередко паралитическая непроходимость кишечника осложняет нехирургические заболевания органов грудной и брюшной полости, забрюшинного пространства (инфаркт миокарда, острая плевропневмония, плеврит, мочекаменная болезнь и др.).
Отдельную и тяжелую группу динамической паралитической непроходимости составляют те виды, которые возникают на почве острых нарушений кровообращения в мезентериальных сосудах (тромбозы и эмболии верхнебрыжеечной артерии Клиника и диагностика: основными симптомами динамической паралитической непроходимости являются боли, рвота, стойкая задержка отхождения стула и газов, вздутие живота. Боли носят тупой, распирающий характер, не имеют четкойлокализации и иррадиации. Они, как правило, постоянные, схваткообразный компонент как бы уходит на второй план.
Рвота, второй по частоте симптом паралитической непроходимости, обычно многократная, сочетается со срыгиванием застойного зловонного желудочного содержимого. Рвотные массы обильные, с большой примесью дуоденального и кишечного содержимого. Нередко рвота носит геморрагический характер вследствие диапедезного кровотечения из стенки желудка, а также из острых язв и эрозий. Живот вздут равномерно. Асимметрии вздутия, свойственной механической непроходимости, не наблюдается. При пальпации определяют ригидность брюшной стенки. У худощавых больных удается пальпировать растянутые в виде цилиндров петли тонкой кишки. Перистальтика либо резко ослаблена, либо отсутствует и при аускультации живота вместо кишечных шумов слышны дыхательные и сердечные шумы (симптом "гробовой тишины" Лотейссена).
Если паралитическая непроходимость не сочетается с развитием перитонита, в первые часы общее состояние больных от нее страда ет мало, но затем, спустя 3–4 ч, быстро начинают нарастать ги поволемия, тяжелые расстройства обмена веществ, нарушения сердечной деятельности.
Диагноз паралитической непроходимости ставят на основании характерных признаков динамической непроходимости и наличия симптомов основного заболевания, приведшего к ее развитию.
При обзорной рентгеноскопии живота для паралитической непроходимости характерны: равномерное вздутие всех отделов кишечника, преобладание в раздутых кишках газообразного содержимого над жидким, наличие горизонтальных уровней жидкости как в тонкой, так и в толстой кишке одновременно. Лечение: комплексное и в первую очередь направлено на устранение патологического процесса, приведшего к развитию пара литической кишечной непроходимости. С целью восстановления моторной функции кишечника и борьбы с парезом проводят мероприятия по восстановлению активной перистальтики.
При консервативном лечении паралитической непроходимости применяют аминазин. снижающий угнетающее действие на перис тальтику симпатической эфферентации и антихолинэстеразные препараты (прозерин, убретид), активирующие перистальтику путем усиления функции парасимпатической нервной системы. Необходима определенная последовательность в использовании этих препаратов. Вначале вводят аминазин или аналогичные ему препараты, через 45–50 мин прозерин. Хороший эффект дает также и электростимуляция кишечника. Больным необходима постоянная декомпрессия желудка и ки шечника путем назогастральной катетеризации двенадцатиперстной и тонкой кишки, зондом Миллера – Эббота.
Нарушения гомеостаза корригируют по общим принципам лс чения острой кишечной непроходимости Хирургическое лечение при паралитической кишечной непроходимости показано редко в случаях возникновения кишечной непроходимости на фоне перито нита, тромбоза или эмболии брыжеечных сосудов, а также при смешанном варианте кишечной непроходимости (сочетание механичес кого и паралитического компонентов) Спастическая кишечная непроходимость сравнительно редкий вид динамической кишечной непроходимости. Прекращение продвижения кишечного содержимого обусловлено возникновением стойкого спазма мышечного слоя стенки кишки. Этиология.
Стойкий спазм кишечника возникает, при отравлении тяжелыми металлами (свинцом), никотином; при порфириновой болезни, при уремии.
Длительность спазма может быть различная: от нескольким минут до нескольких часов.
Клиника и диагностика: спастическая кишечная не проходимость может быть в любом возрасте. Заболевание характеризуется внезапным началом. Ведущий симптом – сильные схваткообразные боли. Боли не имеют определенной локализации и обычно распространяются по всему животу. В период схваток больной мечется по кровати, кричит.
Диспепсические расстройства не характерны. Задержка стула и газов наблюдается не у всех больных, они никогда не бывают стойкими. Общее состояние больного нарушается незначительно. Живот при осмотре имеет обычную конфигурацию. Иногда брюшная стенка вытянута, и живот принимает ладьевидную форму. При обзорном рентгеновском исследовании живота выявляют спастически-атоническое состояние кишечника. Иногда по ходу тонкой кишки видны мелкие чаши Клойбера, расположенные цепочкой слева сверху вниз и вправо. При контрастном исследовании желудочно-кишечного тракта с барием определяют замедленный пассаж бариевой взвеси по тонкой кишке.
Лечение: консервативное. Больным назначают спазмолитики, физиотерапевтические процедуры, тепло на живот, проводят лечение основного заболевания.
Механическая кишечная непроходимость. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Осложнения. Предоперационная подготовка.
Обтурационная непроходимость кишечника
Артериомезентериальная непроходимость обусловлена сдавлением нижней горизонтальной ветви двенадцатиперстной кишки верхней брыжеечной артерией, отходящей у таких больных от аорты под острым углом. Иногда этот вариант кишечной непроходимости возникает остро, после обильного приема пищи (желудочное содержимое, поступающее в кишечник, оттягивает его книзу, пере-давливая натягивающейся при этом верхней брыжеечной артерией двенадцатиперстную кишку). В клинической картине преобладают резкие боли в верхней половине живота и обильная рвота с примесью желчи. Состояние больного довольно быстро улучшается при принятии горизонтального или коленно-локтевого положения. Рентгенологически в остром периоде отмечается значительное расширение желудка и двенадцатиперстной кишки, при контрастном исследовании отмечается задержка эвакуации контраста из двенадцатиперстной кишки в вертикальном положении и улучшение эвакуации в коленно-локтевом. Возможно хроническое течение заболевания. Лечение: консервативное – частое дробное питание, после еды отдых в горизонтальном положении, лучше на правом боку. При неэффективности консервативных мероприятий показано хирургическое вмешательство – наложение дуоденоеюноанастомоза.
Прогноз: благоприятный.
Обтурация желчными камнями составляет 0,5–2% от всех случаев кишечной непроходимости.
Этиология: при хронических холециститах вследствие деструктивных изменений в желчном пузыре происходит спаяние его стенки с органами желудочно-кишечного тракта и затем образуется пузырно-дуоденальный свищ, по которому камень, находящийся в желчном пузыре, отходит в просвет кишечника Обтурацию вызывают камни диаметром 3–4 см. Застреванию камня в просвете кишки и развитию острой кишечной непроходимости способствует вторичный спазм кишечной стенки. Наиболее часто обтурация желчными камнями происходит на уровне терминального отрезка подвздошной кишки, что объясняют сравнительной узостью просвета этого отдела кишечника.
Клиника и диагностика: явления обтурационной непроходимости при закупорке желчными камнями возникают, как правило, остро и протекают со схваткообразными болями, многократной рвотой. Явления непроходимости иногда носят перемежающийся характер.
При обзорной рентгеноскопии живота обнаруживают раздутые газом петли тонкой кишки с характерным "спиралевидным" рисунком складок слизистой оболочки. Нередко имеется газ в проекции желчевыводящих протоков и в отдельных случаях на фоне газа в кишечнике видна тень камня, обтурирующего просвет кишки. Лечение: только хирургическое. Производят энтеротомию дистальнее камня, удаление его и декомпрессию кишечника. В дальнейшем выполняют по показаниям холецистэктомию.
Закупорки, каловыми камнями бывает преимущественно в толстой кишке. Этот вид непроходимости наблюдается у пожилых людей, страдающих хроническим энтероколитом, упорными запорами. Предрасполагающими факторами часто бывают аномалии развития (мегаколон, мегасигма, врожденные мембраны слизистой оболочки и др.).
Клиника и диагностика: судьба копролитов различна. Нередко они, находясь в просвете кишки годами, не вызывают болезненных симптомов. Копролиты могут самостоятельно отходить со стулом. В ряде случаев копролиты приводят к развитию пролежней стенки кишки и каловому перитониту. Они могут вызывать острую непроходимость толстой кишки, симптомы и клиническое ,течение которой имеет все характерные особенности низкой непроходимости кишечника: схваткообразные боли, полная задержка стула и газов, усиленная, длительно сохраняющаяся перистальтика, резкое вздутие сигмовидной и ободочной кишки, принимающих форму раздутой автомобильной шины, пустая, баллонообразно раздутая ампула прямой кишки.
Лечение: при обтурации каловыми камнями операция показана в редких случаях, если консервативные методы лечения (сифонные и масляные клизмы, попытка пальцевого удаления камней через прямую кишку даже под наркозом) не дают эффекта.
Хирургическое лечение заключается в колотомии, удалении камней и наложении колостомы или противоестественного заднего прохода.
Обтурация кишечника опухолью составляет 9–10% от всех форм острой кишечной непроходимости. Обтурацию чаще вызывают злокачественные опухоли, локализующиеся в тонкой или толстой кишке (чаще в сигмовидной кишке). Клиника и диагностика симптомы кишечной непроходимости при обтурации опухолями развиваются постепенно, подостро. Обычно они сочетаются с симптомами злокачественной опухоли, которая вызывает истощение, кровотечение и интоксикацию больного. Нередко непроходимость является первым симптомом опухоли ободочной кишки.
Непроходимость на почве опухоли в зависимости от локализации может протекать по типу как высокой, так и низкой непроходимости. Резкое вздутие ободочной кишки при опухоли, обтурирующей сигмовидную кишку, приводит к резким нарушениям микроциркуляции в стенке кишечника и перфорациям, которые чаще локализуются в слепой кишке, чем в непосредственной близости от опухоли. Лечение: только хирургическое. При тонкокишечной обтурации производят резекцию с первичным межкишечным анастомозом. При раке слепой и восходящей кишки–гемиколэктомию (см.выше). В случае наличия неоперабельной опухоли накладывают обходной анастомоз. При непроходимости на уровне левых отделов ободочной кишки производят двух- и трехэтапные операции. При неоперабельной опухоли толстой кишки накладывают постоянную колостому или противоестественный задний проход. Послеоперационная летальность составляет 20–30%.
Странгуляционная кишечная непроходимость
Частота странгуляционных видов непроходимости составляет 40–50% от всех наблюдений острой непроходимости.
Завороты (volvulus) представляют собой закручивание кишки с ее брыжейкой вокруг продольной оси и составляют 4–5% всех видов кишечной непроходимости. Различают завороты тонкой; сигмовидной и слепой кишки. Этиология: среди причин заворотов кишки выделяют предрасполагающие и производящие.
К предрасполагающим причинам относят: а) врожденную или приобретенную чрезмерно длинную брыжейку кишки, мальротацию, б) рубцовые тяжи, сращения, спайки между петлями кишечника как врожденного, так и приобретенного характера, в) резкое похудание с исчезновением жировых прослоек между листками брыжейки. К производящим причинам относят: а) внезапное повышение внутрибрюшного давления, приводящее к резкому перемещению кишечных петель, б) алиментарные факторы: нерегулярное питание, длительное голодание с последующей перегрузкой кишки большим количеством грубой пищи.
В нормальных условиях петли кишечника совершают значительные по объему движения и нередко делают повороты до 180°С, не вызывая каких-либо патологических нарушений. При перекручивании кишки более чем на 180° происходит перекрытие ее просвета и сдавление сосудов брыжейки. Возникают кровоизлияния и некроз стенки кишки. Впоследствии развивается перитонит.
Заворот слепой кишки возможен в тех случаях, когда кишка имеет собственную брыжейку или общую с брыжейкой тонкой кишки. Наиболее часто бывает заворот сигмовидной кишки. Помимо значительной длины брыжейки завороту способствует рубцовое сморщивание корня брыжейки сигмовидной кишки при мезосигмоидите. Следствием этого является сближение петель кишки, которые располагаются почти параллельно (по типу "двустволки"). При усилении перистальтических сокращений или переполнения плотным и газообразным содержимым кишка легко закручивается вокруг своей оси, что приводит к непроходимости.
Клиника и диагностика: завороты тонкой кишки начинаются остро. Заболевание протекает с тяжелыми общими и местными клиническими симптомами, характерными для острой высокой странгуляционной непроходимости кишечника. Ведущим симптомом являются резкие боли. Характерна постоянная острая боль в глубине живота и в превертебральной области. В первые часы заболевания на фоне постоянной боли периодически возникают схваткообразные боли, интенсивность которых нарастает синхронно с перистальтикой, достигая характера нестерпимых. Часто больные кричат от болей, становятся беспокойными, принимают вынужденное положение с приведенными к животу ногами. . Рвота с самого начала многократная и не приносит облегчения. |Сначала она рефлекторная, неизмененным желудочным содержимым "и желчью, а затем принимает фекалоидный характер. Задержка стула и газов бывает не всегда. Часто в начале заболевания бывает однократный стул за счет опорожнения нижних отделов кишечника, не приносящий облегчения. Общее состояние крайне тяжелое. Быстро появляются и нарас-гают нарушения водно-солевого, белкового и углеводного обмена, микроциркуляторные и гемодинамические расстройства, интоксикация, сокращается диурез. Живот умеренно вздут. Иногда вздутие фоявляется лишь сглаженностью подреберных областей. В первые часы заболевания нередко обнаруживают положи-гельный симптом Валя. В более поздние сроки над растянутой странгулированной петлей тонкой кишки определяют "шум плеска" (положительный симптом Склярова). При обзорной рентгеноскопии живота обнаруживают чаши Клойбера, которые появляются через 1–2 ч от начала заболевания.
Прогноз: при заворотах тонкой кишки плохой. Летальность постигает 30%. При завороте слепой кишки симптомы выражены так же остро, как и при завороте тонкой кишки.
Боли (как постоянные, так и схваткообразные) локализуются в правой половине живота и в околопупочной области Рвота появляется в начале заболевания, но редко бывает фекалоидной Задержка стула и газов имеется у большинства больных. При осмотре выявляют асимметрию живота за счет вздутия в околопупочной области Одновременно нередко происходит западение правой подвздошной области (положительный симптом Шимана–Данса). При пальпации живота часто обнаруживается ригидность мышц брюшной стенки.
При выслушивании живота отмечают характерные звонкие с металлическим оттенком перистальтические шумы. В дальнейшем, по мере развития перитонита, перистальтические шумы ослабевают.
На обзорной рентгенограмме живота видна шаровидно раздутая слепая кишка, которая локализуется в правой половине живота или смещена кнутри и кверху. В зоне проекции кишки виден большой (длиной до 20 см) горизонтальный уровень жидкости. Заворот сигмовидной кишки возникает чаще у пожилых людей, длительно страдающих запорами.
Боли носят такой же характер, как и при других формах стран гуляционной непроходимости. Они возникают внезапно, интенсивные, локализуются обычно в нижних отделах живота и в области крестца. Рвота одно- и двукратная. Фекалоидной рвоты, как правило, не бывает. Она появляется лишь с развитием перитонита. Ведущим симптомом является задержка стула и газов. Живот резко вздут. Асимметрия проявляется выбуханием верхних отделов правой его половины. При этом живот приобретает характерный "перекошенный" вид.
Вследствие сильного вздутия ободочной кишки все внутренние органы и диафрагма оттесняются кверху. В связи с этим у больных затрудненное дыхание и нарушается сердечная деятельность.
При рентгеноскопии видна резко раздутая газами сигмовидная кишка, которая занимает почти всю брюшную полость и дает характерный симптом "светлого живота", на фоне которого видны 1–2 чаши Клойбера с длинными уровнями жидкости. Лечение- при заворотах кишечника необходима экстренная операция, так как консервативные методы лечения не эффективны.
Хирургическое лечение состоит в расправлении завернувшихся петель кишки (деторсия) и опорожнении кишки от содержимого (декомпрессия). При омертвении кишки показана ее резекция. Резекцию производят по общим правилам, принятым при хирургическом лечении острой непроходимости кишечника (см выше). С целью профилактики рецидива заболевания при заворотах слепой и сигмовидной кишки необходима их фиксация к брюшной стенке Узлообразование кишок (nodulus intestini). Протекает с тяжелыми нарушениями кровообращения в сосудах брыжейки и ранним некрозом больших отрезков тонкой и толстой кишки. Наблюдается у 3 4% всех больных острой кишечной непроходимостью. Этиология- в узлообразовании принимают участие не менее двух кишечных петель. Одна из кишечных петель, сложенная в виде двустволки вместе со своей брыжейкой, образует ось, вокруг которой вторая петля кишки также вместе с ее брыжейкой закручивается на один или несколько оборотов, сдавливает первую петлю и сама подвергается странгуляции. В результате образования узла просвет кишечника оказывается перекрытым не менее чем на двух уровнях.
В узлообразовании обычно принимают участие тонкая кишка и подвижные, имеющие собственную брыжейку отделы толстой кишки. Наиболее частыми видами межкишечных узлов являются узлы между тонкой кишкой и сигмовидной или тонкой кишкой и слепой, которая в этих случаях имеет собственную брыжейку. Узлообразование между петлями тонкой кишки (тощей и подвздошной) наблюдается редко. Кровоснабжение в сосудах брыжеек странгулируемой и странгулирующей кишки в начальных стадиях заболевания нарушается в различной степени. В начале заболевания обычно в большей степени страдает кровоснабжение в странгулируемой петле. Затем быстро нарушается кровоснабжение обеих петель, и они оказываются в состоянии некроза.
Клиника и диагностика: предполагать узлообразование кишок надо в тех случаях, когда клинические и рентгенологические признаки странгуляции тонкой кишки сочетаются с признаками непроходимости толстой кишки, невозможно введение высокой клизмы, имеются "баллонообразная" ампула прямой кишки и горизонтальные уровни жидкости в левых отделах толстой кишки (наряду с уровнями жидкости в тонкой кишке) Лечение: хирургическое.
В ранней стадии заболевания производят развязывание узла. При невозможности расправить узел, что часто наблюдается в поздние сроки, прибегают к резекции больших отделов толстой и тонкой кишки.
Принципы оперативного лечения острой механической кишечной непроходимости: 1) Ликвидация механического препятствия или создание обходного пути для кишечного содержимого. При тонкокишечной непроходимости следует стремиться к полной ликвидации причины, вызвавшей ее, вплоть до резекции кишки с наложением межкишечного анастомоза (рассечение спаек, резекция кишки при опухоли, рассечение кишки с удалением желчного камня и др.). Это правило не относится к толстокишечной непроходимости, при лечении которой одномоментное наложение межкишечного анастомоза приводит к недостаточности швов и развитию перитонита. Только при правосторонней локализации опухоли, обтурирующей ободочную кишку, у молодых больных при незапущенной кишечной непроходимости допустима правосторонняя гемиколэктомия с наложением илеотрансверзоанастомоза. В остальных случаях более целесообразны: а) двухэтапные и б) трехэтапные операции.
Двухэтапная операция – резекция кишки, несущей опухоль, с наложением противоестественного заднего прохода на приводящую петлю, вторым этапом – наложение анастомоза между приводящей и отводящей петлей. Трехэтапная операция – разгрузочная цекостома или противоестественный задний проход проксимальнее места обтурации; резекция участка ободочной кишки с опухолью с наложением межкишечного анастомоза; закрытие цекостомы или противоестественного заднего прохода. 2. Удаление некротизированных или подозрительных на некроз участков кишечника. Необходимость в резекции может возникнуть как при странгуляционной, так и при обтурационной непроходимости (некроз приводящей петли кишки). Признаки нежизнеспособности петли кишки см. "Ущемленные грыжи". 3. Разгрузка дилатированного участка кишечника способствует восстановлению микроциркуляции в стенке кишки, тонуса стенки кишки и перистальтики. Добиться разгрузки дилатированного сегмента можно трансназальным введением в тонкую кишку во время операции перфорированных зондов или введением аналогичных зондов через гастро- или цекостому.
Лечение больных оперативной ликвидацией непроходимости не заканчивается. В послеоперационном периоде патогенетическое лечение проводят по тем же принципам, что и в дооперационном периоде.
Основной задачей послеоперационного введения является ликвидация тяжелых патофизиологических нарушений, восстановление нормального водно-солевого, белкового и углеводного обменов. Особое значение приобретают мероприятия, направленные на раннюю активизацию кишечной перистальтики, дезинтоксикацию, профилактику тромбоэмболических и воспалительных осложнений. С целью восстановления моторной функции желудка и кишечника в послеоперационном периоде проводят постоянную (на протяжении 3–4 сут) аспирацию желудочно.кишечного содержимого через назогастральный зонд, назначают антихолинэстеразные препараты, сеансы электростимуляции кишечника. Дезинтоксикация достигается восстановлением нормального диуреза, для чего необходимо тщательное возмещение водных потерь. Хороший дезинтоксикационный эффект достигают стимуляцией форсированного диуреза введением лазикса (30–40 мг) при умеренной гемодилюции. Синтетические плазмозаменители (реополиглюкин, гемодез) являются хорошими адсорбентами токсинов, способствуют их выведению почками.
профилактику тромбоэмболических осложнении осуществляют комплексом мероприятии: эластической компрессией вен нижних конечностей, активным режимом, назначением дезагрегантов, антикоагулянтов прямого и непрямого действия. Для борьбы с инфекцией и профилактики ее назначают антибиотики широкого спектра действия: внутривенно, внутримышечно и местно в брюшную полость через введенные в нее во время операции микроирригаторы.
Прогноз: летальность после операций по поводу острой кишечной непроходимости остается высокой и составляет в среднем 13–18%. Для снижения послеоперационной летальности большое значение имеет организация оказания скорой медицинской помощи. Ранняя госпитализация и раннее хирургическое вмешательство имеют основное значение для благоприятного исхода лечения. По данным крупных статистик, летальность среди больных с острой кишечной непроходимостью, оперированных в первые 6 ч, составляет 3,5%, а среди оперированных после 24 ч – 24,7% и более.
Обтурационная кишечная непроходимость. Определение. Клиника. Диагностика. Дифференциальный диагноз. Виды операций. Борьба с интоксикацией, парезом кишечника.
