
Kolloidnaya himiya_1 / Kolloidnaya himiya
.pdf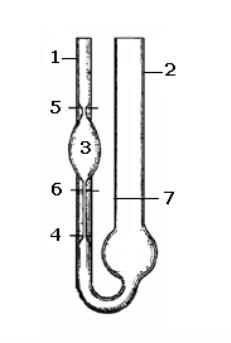
181
Порядок выполнения работы:
1.На предметное стекло нанесите 1 каплю эмульсии и с помощью микроскопа определите тип эмульсии (по окрашиванию дисперсионной среды и дисперсной фазы).
2.Затем к 2 мл исследуемой эмульсии, стабилизированной олеатом натрия, добавьте при встряхивании 1-2 капли 30%-ного раствора MgCl2.
3.Тщательно встряхивайте до образования устойчивой эмульсии. Каплю полученной эмульсии нанести на предметное стекло, и с помощью микроскопа определить ее тип (по окрашиванию дисперсионной среды и дисперсной фазы).
4.Дайте объяснение наблюдаемым явлениям, сделайте вывод.
ТЕМА III. РАСТВОРЫ ВМС
Учебно-исследовательская лабораторная работа №8
Тема: Вискозиметрическое определение молекулярной массы полимера
Цель работы: Научиться определять относительную вязкость растворов ВМС различных концентраций, графически определять характеристическую вязкость; рассчитывать молекулярную массу ВМС.
Оборудование и химическая посуда: Вискозиметр Оствальда; секундо-
мер; стеклянный стаканчик на 100 мл; резиновая груша. Описание прибора: прибором для измерения относительной вязкости служит вискозиметр Оствальда, который представляет собой две сообщающиеся стеклянные трубки 1 и 2.
Трубка 1 имеет расширение 3, переходящее в капилляр 4; через трубку 2 исследуемая жидкость протекает под влиянием собственной тяжести в трубку 1.
В трубке имеются метки 5, 6 и 7. Объем расширенной части трубки равен 3–4 мл.
Рис. Вискозиметр Оствальда
Реактивы: Растворы поливинилового спирта следующих концентраций: 0,05; 0,1; 0,15; 0,2, дистиллированная вода.

182
Порядок выполнения работы:
1.Внесите в широкое колено вискозиметра из химического стакана воду по верхнюю метку (7).
2.Грушей передавите жидкость из широкого колена вискозиметра в узкое выше метки, выньте грушу, дайте жидкости свободно вытекать. При прохождении жидкости через верхнюю метку (5) включите секундомер, при прохождении ее через нижнюю метку (6) секундомер выключите. Повторите измерения 2-3 раза, добиваясь, чтобы расхождения в параллельных измерениях составляли не более 0,5–1 с. Для расчетов берите среднее значение времени истечения чистого растворителя.
3.Определите время истечения из вискозиметра растворов полимера сле-
дующих концентраций (г/100 мл Н2О): 0,05; 0,1; 0,15; 0,2. Измерения выполняйте как в п.2. Повторите измерения 2-3 раза . Измерения начинайте с наименее концентрированного раствора. Переходя к более высокой концентрации, необходимо тщательно с помощью груши удалить из вискозиметра прежний раствор и промыть вискозиметр раствором следующей концентрации.
4.Рассчитайте удельную вязкость ( уд.) раствора по уравнению:
|
o |
, |
|
уд . |
|||
|
|||
o
где – время истечения раствора, с;
о– время истечения воды, с.
5.Рассчитайте приведенную вязкость ( пр.) раствора по уравнению:
уд .
пр .
с
Результаты эксперимента и расчетные данные внесите в таблицу.
|
|
|
|
Таблица |
|
Концентрация полимера |
Время истечения |
Удельная |
Приведенная |
||
в растворе, с, |
из вискозиметра |
||||
вязкость, |
|
вязкость, пр |
|||
г/ 100 мл растворителя (Н2О) |
, с |
уд. |
|||
|
|
|
|||
0,00 (вода) |
|
|
|
|
|
0,05 |
|
|
|
|
|
0,10 |
|
|
|
|
|
0,15 |
|
|
|
|
|
0,20 |
|
|
|
|
|
6.Постройте график зависимости приведенной вязкости от концентрации ВМС в растворе. По графику определите характеристическую вязкость. Отрезок на оси ординат, отсекаемый прямой, соответствует характеристической вязкости [ ].

183
7.Рассчитайте относительную молекулярную массу (ОММ) полимера по уравнению Марка-Хаувинка
[ ] lg([ ] / K )
[ ] = KM M = K ; lgM= 
Значения констант в уравнении Марка-Хаувинка для поливинилового спирта и ОММ представлены в табл. 10 приложения.
8.Сделайте вывод о соответствии полученного результата M(ВМС) справочным данным.
Учебно-исследовательская лабораторная работа №9
Тема: Набухание ВМС
Цель работы: Научиться экспериментально определять величину, степень набухания и изоэлектрическую точку желатина, изучить влияние различных факторов на набухание.
Опыт № 1. Влияние рН на набухание и определение изоэлектрической точки желатина
Оборудование, химическая посуда и реактивы: бюретки на 25 мл, шта-
тив для пробирок, пробирки на 20 мл, мерные пробирки на 10 мл, стеклянные палочки, желатин, дистиллированная вода, 0,1 н. раствор CН3СООН, 0,1 н. раствор CН3СООNa.
Порядок выполнения работы:
1. В 5-ти пробирках составьте буферные смеси согласно таблице:

184
|
|
|
|
|
|
|
|
Таблица |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Состав буферной |
рН смеси |
Объем |
Объем |
Вели- |
|
|
|
|||
№ |
смеси, мл |
|
|
желати- |
Степень |
||||||
|
|
желатина |
чина |
||||||||
про- |
|
|
рас- |
Из- |
на после |
набухания |
|||||
|
|
до набу- |
набу- |
||||||||
бир- |
0,1 н. |
0,1 н. |
счи- |
ме- |
набуха- |
= V |
|
||||
хания V1, |
хания |
100 % |
|||||||||
ки |
CН3СООН |
CН3СООNa |
тан- |
рен- |
ния V2, |
|
V1 |
||||
мл |
V, мл |
|
|
||||||||
|
|
|
ная |
ная |
мл |
|
|
|
|||
|
|
|
|
|
|
|
|
||||
1 |
9 |
1 |
|
|
|
|
|
|
|
|
|
2 |
7 |
3 |
|
|
|
|
|
|
|
|
|
3 |
5 |
5 |
|
|
|
|
|
|
|
|
|
4 |
3 |
7 |
|
|
|
|
|
|
|
|
|
5 |
1 |
9 |
|
|
|
|
|
|
|
|
|
2.Рассчитайте рН буферных растворов по уравнению ГендерсонаГассельбаха:
рН = рK + lg с (CH 3 COONa ) V (CH 3 COONa ) , где pK(CН3СООН) = 4,75.
3.Измерьте значение рН каждой буферной смеси с помощью рН-метра.
4.В 5 сухих мерных пронумерованных пробирок внесите по 1 г порошка желатина и добавьте в каждую приготовленные буферные растворы. Содержимое пробирок перемешайте палочкой, которую затем удалите.
5.Через 30 минут определите объем набухшего желатина и рассчитайте изменение объема желатина и степень набухания.
6.Результаты занесите в таблицу.
7.Постройте график зависимости величины набухания от рН среды. По графику определите ИЭТ желатина.
Рис. Степень набухания желатина в средах с различным значением рН
5.Сделайте вывод о влиянии рН на набухание. Объясните, почему белок минимально набухает в ИЭТ? Что такое изоэлектрическая точка?

185
Опыт № 1-А. Влияние рН на набухание (для студентов стоматологического факультета)
Оборудование и химическая посуда: мерные пробирки на 10 мл, стеклян-
ные палочки.
Реактивы: желатин, 0,1н. (рН = 1) раствор HCl, 0,1н. (рН = 13) раствор NaOH, буферный раствор с рН = 4,7.
Порядок выполнения работы:
1.В пять сухих мерных пробирок внесите до метки 1 мл порошка желатина, добавьте до метки 10 мл указанных растворов с различным значением рН. Содержимое каждой пробирки перемешайте отдельной стеклянной палочкой, которую затем удатите.
2.Через 30 минут определить объем набухшего желатина, рассчитайте степень набухания. Результаты занесите в таблицу.
|
|
|
|
|
Таблица |
|
|
|
|
Объем желатина |
Степень |
||
|
рН |
Объем желатина до |
набухания |
|||
Растворы |
после набухания V2, |
|
|
|
||
среды |
набухания V1, мл |
V V o |
|
|||
|
мл |
100 % |
||||
|
|
|
|
V o |
||
|
|
|
|
|
|
|
HCl |
1 |
|
|
|
|
|
Буферный |
4,7 |
|
|
|
|
|
NaOH |
13 |
|
|
|
|
|
3.Постройте график зависимости величины степени набухания от рН среды. По графику определите pI желатина.
4.Сделайте вывод о влиянии рН на степень набухания.
Опыт № 2. Влияние электролитов на набухание
Оборудование и химическая посуда: мерные пробирки на 10 мл, стеклян-
ные палочки, штатив для пробирок.
Реактивы: желатин, дистиллированная вода, 0,1М раствор K2SO4, 0,1М раствор KI.
Порядок выполнения работы:
1.В три сухие мерные пробирки внесите по 1 г порошка желатина и добавьте по 10 мл растворов:
1) K2SO4; 2) H2О; 3) KI. Содержимое пробирок перемешайте палочкой.
2.Через 30 минут определите объем набухшего желатина. Результаты занесите в таблицу.

186
|
|
|
|
|
|
Таблица |
|
|
Объем жела- |
Объем желати- |
Величина |
Степень набухания, |
|
||
|
тина до на- |
|
|||||
Электролиты |
на после набу- |
набухания |
= |
V |
|
|
|
бухания V1, |
100 % |
|
|||||
|
хания V2, мл |
V, мл |
|
V1 |
|
||
|
мл |
|
|
|
|||
|
|
|
|
|
|
|
|
K2SO4 |
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
KI |
|
|
|
|
|
|
|
3.Сделайте вывод о влиянии природы ионов на набухание. По какому принципу электролиты располагают в лиотропные ряды?
Опыт № 3. Влияние природы растворителя на степень набухания
Оборудование и химическая посуда: мерные пробирки на 10 мл, стеклян-
ные палочки, пробки.
Реактивы: желатин, дистиллированная вода, бензол.
Порядок выполнения работы:
1.В две сухие мерные пробирки внесите порошок желатина до метки 1 мл и добавьте до метки 10 мл воды и бензола. Содержимое каждой пробирки перемешайте отдельной стеклянной палочкой, закройте пробирки пробками.
2.Через 30 мин определите объем набухшего желатина, рассчитайте степень набухания. Результаты занесите в таблицу.
|
|
|
|
Таблица |
||
|
|
Объем желатина |
Степень набухания |
|||
|
Объем желатина до |
V V o |
|
|||
Растворитель |
после набухания V, |
|
||||
набухания V0, мл |
100 % |
|||||
|
мл |
|
V o |
|||
|
|
|
|
|||
|
|
|
|
|
||
Н2О |
|
|
|
|
|
|
Бензол |
|
|
|
|
|
|
Сделайте вывод о влиянии природы растворителя на степень набухания.
Тестовые задания, задачи, упражнения для самостоятельного решения
Тест для самоконтроля
Выберите один правильный ответ
1. Какие из приведенных утверждений верны?
А. Размер коллоидных частиц составляет 1-100 нм.
Б. Частицы коллоидного раствора не проходят через бумажный фильтр.
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
187
2. Какие из приведенных утверждений неверны?
А. Коллоидные растворы опалесцируют при боковом освещении.
Б. Частицы коллоидного раствора проходят через животные и растительные мембраны.
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
3. Какие из приведенных утверждений верны?
А. К микрогетерогенным системам относятся суспензии, эмульсии, пены, аэрозоли.
Б. Микрогетерогенные системы не проходят через бумажный фильтр.
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
4. Какие из приведенных утверждений верны?
А. Для лиофобных систем стабилизатор не требуется.
Б. Туманы, дымы, пыли – это связнодисперсные системы.
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
5. Какое условие необходимо для образования лиофобного коллоидного раствора?
1)размер частиц ДФ 10–4 – 10–6 м
2)размер частиц ДФ 10–9 – 10–7 м
3)хорошая растворимость ДФ в ДС
4)неравномерность распределения ДФ в объеме среды 6. К ПАВ не относятся:
1)соли жирных кислот
2)фосфолипиды
3)нитраты серебра, натрия
4)гликолипиды 7. Степень набухания белка увеличивается
1)в ИЭТ
2)вдали от ИЭТ
3)при понижении температуры
4)при добавлении сульфат-ионов 8. Синерезис – это:
1)старение геля
2)способность геля разжижаться при механическом воздействии
3)ограниченное набухание
4)структурирование раствора ВМС
188
9. Выберите правильное утверждение.
А. Набухание – самопроизвольный процесс поглощения растворителя полимером
Б. При набухании увеличивается объем и масса полимера
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
10. По какому признаку классифицируют дисперсные системы на ультрадисперсные, микрогетерогенные и грубодисперсные :
1) по степени дисперсности
2)по агрегатному состоянию дисперсной фазы и дисперсионной среды
3)по взаимодействию дисперсной фазы и дисперсионной среды
4)по взаимодействию частиц дисперсной фазы
11. Имеем двухфазные системы: (1) вода/бензол, (2) вода/гексан, (3) вода/анилин. Расположите эти системы в ряд по убыванию межфазного натяжения.
1)1>2>3;
2)2>1>3;
3)3>2>1;
4)3>1>2
12. Выделите из приведенных характеристик те, которые относятся к лиофобным дисперсным системам:
А) дисперсная фаза и дисперсионная среда сильно различаются по природе (полярности), характеру межатомных (межмолекулярных)
взаимодействий; Б) межмолекулярные силы сильно не скомпенсированы на поверхно-
сти раздела фаз; В) поверхностное натяжение на границе раздела фаз имеет очень
низкое значение (σ→0); Г) при образовании дисперсной системы энергия диспергирования не
компенсируется энергией межмолекулярного взаимодействия на образующейся поверхности и возрастанием энтропии;
Д) система возникает в результате самопроизвольного диспергирования, при этом изменение энергии Гиббса ΔG<0;
Е) система термодинамически неустойчива, требуется наличие специального стабилизатора для предотвращения ее разрушения (коагуляции)
1) АВД; 2) АБГЕ; 3) АВЕ; 4) БДЕ
Вставьте пропущенное слово.
13. Адсорбция – это поглощение какого-либо вещества из газообразной среды или раствора _________слоем жидкости или твѐрдого тела.

189
14. Свободной поверхностной энергией называется _______ энергии в тонком слое вещества у поверхности соприкосновения тел (фаз) по сравнению с энергией вещества внутри тела.
15. Чем хуже данный растворитель смачивает поверхность адсорбента, тем
_____________ будет происходить адсорбция растворенного вещества.
16. Если вещество хорошо растворяется в данном растворителе, то адсорбироваться оно будет _______.
Установите соответствие
17. Установите соответствие между дисперсной системой и агрегатным состоянием ее дисперсной фазы.
Система |
Фаза |
|
А. Суспензия |
1. |
газ |
Б. Эмульсия |
2. |
твердая |
В. Пена |
3. |
жидкая |
Г. Туман |
|
|
18. Установите соответствие между дисперсной системой и размером частиц
дисперсной фазы. |
|
|
Дисперсная система |
Размер частиц ДФ |
|
1. Дым |
А. |
10–10 м |
2. Молоко |
Б. |
10–7 м |
3. Коллоидное золото |
В. 10–6 м |
|
4. Раствор NaCl |
Г. 10–4 м |
|
19. Гидрозоль хлорида железа (III) получен гидролизом FeCl3 при кипяче-
нии раствора: FeCl3 + 3H2O ↔ Fe(OH)3↓ + 3HCl
В результате образуется мицелла, строение которой можно выразить формулой {m[Fe(OH)3] nFeO+ (n-x)Cl–}х+ xCl–.
Установите соответствие между составляющими частями мицеллы и их формулой.
Составляющие части мицеллы |
Формулы |
|
1) |
ядро мицеллы |
А) m[Fe(OH)3] |
2) |
потенциалопределяющие ионы |
Б) xCl– |
3) |
противоионы адсорбц. слоя |
В) (n–x)Cl– |
4) |
противоионы диффузной части ДЭС |
Г) nFeO+ |
20. Перечислите вещества, которые могут образовывать структурномеханический барьер на границе раздела вода-масло и использоваться в качестве стабилизаторов прямых эмульсий.
а) натрий пропионат; б) желатин; в) валериановая кислота; г) мел; д) лецитин
Укажите возможные варианты правильного ответа.

190
Ответы на тестовые задания
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
1 |
2 |
3 |
4 |
2 |
3 |
2 |
1 |
3 |
1 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
2 |
2 |
Поверх- |
Избы- |
лучше |
хуже |
А2 |
1БВ |
1А |
б, д, |
|
|
ност- |
ток |
|
|
Б3 |
2ВГ |
2Г |
г |
|
|
ным |
|
|
|
В1 |
3Б 4А |
3В |
|
|
|
|
|
|
|
Г3 |
|
4Б |
|
|
|
|
|
|
|
|
|
|
УПРАЖНЕНИЯ И ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
ТЕМА 1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
1.Как ориентируются молекулы изоамилового спирта на границе раздела вода-воздух, бензол-воздух? Изобразите схематично.
2.Как графически будут располагаться относительно друг друга изотермы поверхностного натяжения растворов спиртов: этанола, бутанола, пропанола?
3.Оцените размеры экологической катастрофы при аварии нефтеналивного танкера: рассчитайте площадь океана, покрытую мономолекулярной пленкой нефти, образованной за счет попадания в океан из танкера
20 тонн нефти ( нефти = 35 10-3 н/м; Мнефти = 84 г/моль; (Н2О) = 72,75 10-3 н/м; t = 20оС) (Ответ: 1,535 104 км2).
4.Какие ионы Na+, K+, NO 3 , Br– будут адсорбироваться ионитом, содер-
жащим группы –СООН?
5. Какие ионы K+, Cu2+, Br-, SO 24  , HPO 24
, HPO 24  , Fe3+ адсорбируется на поверхности кристалла бромида серебра?
, Fe3+ адсорбируется на поверхности кристалла бромида серебра?
Решите задачи: Литвинова Т.Н. Сборник задач по общей химии. Задачи по общей химии с медико-биологической направленностью. Учебное пособие для студентов медицинских вузов.– 3-е изд., перераб. Гриф УМО МЗСР РФ//– М.: ООО «Изд-во Оникс»: ООО «Издательство «Мир и обра-
зование», 2007. №;№ 3, 4, 5, 6, 10, 11, 13, 17 стр.188-190.
ТЕМА II. ДИСПЕРСНЫЕ СИСТЕМЫ
1.Золь бромида свинца(II) получили при смешивании ацетата свнца и бромида кальция. Коагулирующая способность нитрата магния по отношению к этому золю больше коагулирующей способности сульфата аммония. Каков заряд гранулы? Напишите формулу мицеллы этого зо-
