
Kolloidnaya himiya_1 / Kolloidnaya himiya
.pdf11
Тема 1. Поверхностные явления
Цели изучения: получение представления о поверхностных явлениях, их биологическом значении; физико-химической основе адсорбционной терапии; хроматографическом методе анализа, возможностях его применения в медико-биологических и санитарногигиенических исследованиях; приобретение знаний о причинах возникновения поверхностной энергии; сути и видах сорбции, теоретических основах адсорбции; формирование умения пользоваться математическим аппаратом для расчета величины адсорбции; выработка ценностного отношения к получаемым заниям и умениям как профессионально значимым.
Повторите и вспомните:
1.Основы химической термодинамики. Системы гомогенные и гетерогенные. Фаза. Энергия Гиббса.
2.Химическое равновесие. Принцип Ле-Шателье. Константа химического равновесия.
3.Поверхностная энергия. Поверхностное натяжение и методы его определения (из курса физики).
4.Способы выражения концентрации вещества в растворе.
Учебно-целевые вопросы
1.Поверхностные явления. Основные определения: фаза, межфазная граница, свободная поверхностная энергия, поверхностное натяжение. Примеры поверхностных явлений, их медико-биологическое значение.
2.Особенности энергетического состояния молекул в поверхностном слое и объеме жидкости.
3.Сорбция и ее виды. Основные понятия: сорбент, сорбтив, сорбционный комплекс, сорбционное равновесие. Использование сорбции для детоксикации организма.
4.Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Положительная и отрицательная адсорбция.
5.Поверхностноактивные (ПАВ) и поверхностноинактивные (ПИВ) вещества, их строение и ориентация на границе раздела фаз. Изотермы поверхностного натяжения для ПАВ и ПИВ.
6.Понятие о поверхностной активности. Правило Траубе-Дюкло.
7.Биологическая роль ПАВ.
8.Абсорбция в системах газ/жидкость, жидкость/жидкость, твердое/жидкость. Законы Генри и Сеченова. Роль абсорбции в жизнедеятельности организма.
9.Адсорбция на неподвижной поверхности раздела фаз. Удельная адсорбция. Уравнения Фрейндлиха и Ленгмюра для расчета величины

12
адсорбции. Изотерма адсорбции.
10.Адсорбция из растворов, ее особенности. Молекулярная и ионная адсорбция. Правило Панета–Фаянса, лиотропные ряды электролитов.
11.Ионообменная адсорбция, иониты, их классификация. Применение ионитов в медицине, санитарно-гигиенической практике.
12.Понятие о хроматографии и ее видах. Применение хроматографии в медицине, медико-биологических исследованиях.
13.Применение адсорбции в медицине, санитарно-гигиенической практике.
Краткая теоретическая часть
Поверхностные явления происходят на границах раздела фаз и обусловлены особенностями состава и структуры поверхностей.
Фаза – однородная часть гетерогенной системы, которая имеет одинаковый химический состав и одинаковые значения термодинамических параметров.
Фазы в гетерогенных системах отделены друг от друга поверхностью раздела, при переходе через которую свойства системы изменяются скачкообразно.
Поверхностные
явления
сорбция |
|
адгезия |
|
|
|
поверхностное |
|
смачивание |
натяжение |
|
|
|
|
|
|
|
|
В зависимости от агрегатного состояния контактирующих фаз различают поверхностные явления на подвижной и неподвижной поверхности раздела.

13
1. Свободная поверхностная энергия, поверхностное натяжение
Причиной поверхностных явлений служит особое энергетическое состояние молекул в слоях жидкостей и твердых тел, прилегающих к поверхности раздела фаз и находящихся в глубине их объема.
В объеме жидкости результирующая сила действия на молекулу равна нулю. В поверхностном слое межмолекулярные силы не уравновешиваются и их равнодействующая не равна нулю. Кроме того молекулы поверхностного слоя находятся под действием газовой фазы, поэтому молекулы на поверхности стремятся «втянуться» внутрь – поверхность раздела стремится к уменьшению (рис.1.).
газ
жидкость
Рис. 1. Возникновение поверхностной энергии
Следовательно, потенциальная энергия молекул на поверхности раздела фаз выше, чем у молекул внутри фазы. Эти отличия в энергетическом состоянии всех молекул поверхностного слоя характеризуются свободной поверхностной энергией (Gs), которая является энергией межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз.
Gs = s
где – удельная свободная поверхностная энергия (коэффициент поверхностного натяжения), Дж/м2, Н/м; s – площадь поверхности раздела фаз.
Свободная поверхностная энергия (Gs) – термодинамический параметр,
характеризующий энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз.
Поверхностное натяжение (σ) – это поверхностная энергия, отнесенная к единице поверхности (Дж/м2, Н/м).
= Gs

14
Величина поверхностного натяжения зависит от:
природы соприкасающихся фаз;
природы и концентрации растворенных веществ;
температуры.
Самопроизвольно протекают процессы, которые сопровождаются уменьшением свободной энергии Гиббса. Так как GS – это произведение величины поверхностного натяжения на величину межфазной поверхности, то уменьшение GS произойдет, соответственно, при уменьшении множителей и s , т.е. поверхностного натяжения и площади межфазной поверхности раздела.
Поверхностное натяжение можно снизить за счет адсорбции, адгезиии, а площадь межфазной поверхности уменьшается при коалесценции (например, слияние капелек жира на поверхности воды), при коагуляции (объединение более мелких частиц в агрегаты).
2. Смачивание, адгезия, когезия
Поверхностное натяжение и межмолекулярные взаимодействия внутри фаз обусловливают процессы смачивания, растекания капли жидкости на твердых и жидких поверхностях, а также явления когезии и адгезии.
Смачивание – поверхностное явление, которое наблюдается при контакте жидкости с твердым телом в присутствии третьей фазы – газа (пара) или другой жидкости, которая не смешивается с первой.
смачивание
иммерсионное |
|
контактное |
|
|
|
полное погружение твердо- |
|
протекает с участием |
го тела в жидкость; участ- |
|
трех фаз: |
вуют 2 фазы: тв/ж |
|
тв/ж/г |
|
|
|
|
|
|
Смачивание влияет на ход многих процессов в природе, медицине, технике, так как служит начальной стадией взаимодействия жидкостей с твердыми телами.
Количественной мерой процесса смачивания служит краевой угол смачивания (тэта, ), значения которого могут изменяться от 0 до 180о.
Если на твердую поверхность нанести каплю жидкости, то возможны
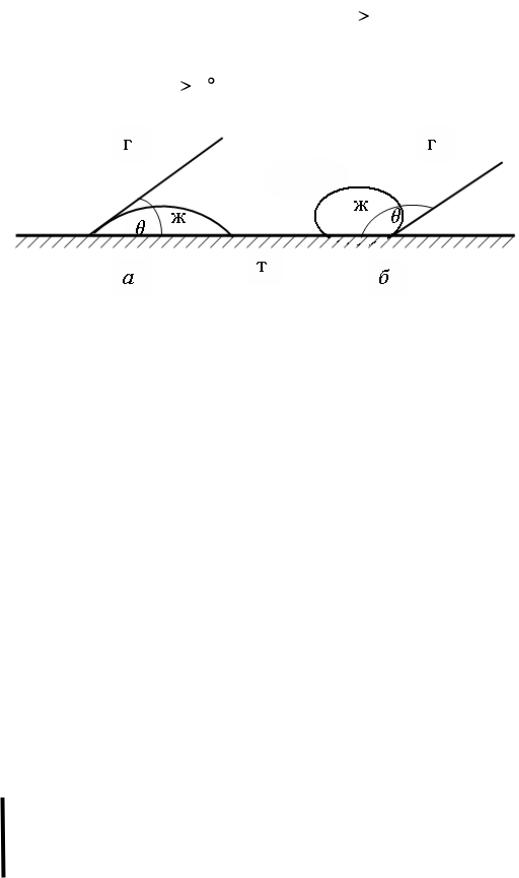
15
три случая:
1)капля растекается по поверхности, краевого угла нет, например, ртуть на поверхности цинка;
2)капля остается в виде шарика, 180
 90
90 (рис. 2 б), например, вода на парафине;
(рис. 2 б), например, вода на парафине;
3)капля растекается лишь частично, образуя с поверхностью неко-
торый краевой угол 90
 0 , (рис. 2 а), например, вода на металле, покрытом оксидной пленкой.
0 , (рис. 2 а), например, вода на металле, покрытом оксидной пленкой.
Рис. 2. Краевые углы смачивания:
а – смачивающая жидкость; б – несмачивающая жидкость
Твердые поверхности, хорошо смачиваемые водой, называются гидрофильными (силикагель, глины, пористые стекла и др.), а несмачиваемые – гидрофобными (сажа, активированный уголь).
Если угол смачивания определить затруднительно, то для количественной характеристики процесса смачивания используют теплоту смачивания (Qсм, Дж/м2, Дж/кг), которая выделяется при погружении твердого тела в жидкость. Для гидрофильных поверхностей теплота смачивания водой больше, чем органическими жидкостями, для гидрофобных поверхностей – обратная зависимость.
Чем выше полярность жидкости, тем слабее ее смачивающие свойства: высокополярная ртуть смачивает только некоторые металлы, вода смачивает поверхности многих полярных веществ, органические жидкости (спирты, бензол и др.) смачивают практически любую поверхность.
Адгезия и смачивание, как правило, сопровождают друг друга: адгезия обуславливает связь между твердым телом и контактирующей с ним жидкостью, а смачивание – результат этой связи.
Адгезия является причиной склеивания двух разных веществ за счет действия физических или химических межмолекулярных сил.
Адгезия – это поверхностное явление, которое заключается в возникновение связи между поверхностными слоями двух разнородных (твердых или жидких) тел (фаз), приведенных в соприкосновение.

16
Когезия – сцепление однородных молекул, атомов или ионов, которое включает все виды межмолекулярного и межатомного при-
тяжения внутри одной фазы.
Когезия определяет существование веществ в конденсированном (твердом и жидком) состоянии. Для твердых тел и жидкостей характерна высокая когезия, а для газов – малая когезия.
Количественно когезию и адгезию характеризуют величиной работы когезии (Wс) и работы адгезии (Wа).
Работа когезии равна энергии, которую нужно затратить на разрыв сил сцепления между молекулами данной фазы.
Численно Wс = 2 (Дж/м2), где - поверхностное натяжение разрываемого вещества на границе с воздухом.
(Дж/м2), где - поверхностное натяжение разрываемого вещества на границе с воздухом.
Работа адгезии (Дж/м2) – это работа, затрачиваемая на отрыв молекул одной фазы от молекул другой фазы. Работа адгезии тем больше, чем больше поверхностное натяжение каждой из фаз на границе с воздухом и чем меньше поверхностное натяжение на границе раздела соприкасающихся фаз. По величине Wа можно судить о прочности склеивания, прилипания.
Адгезийная прочность зависит от следующих факторов:
энергии связи;
полноты контакта;
рельефа поверхности;
условий формирования контакта.
На явлении адгезии основано действие клеев, применяемых в медицине, пломбировочных материалов и связующих веществ, используемых в стоматологической практике.
Адгезия происходит при повреждении стенки кровеносных сосудов, на поверхности тромбоцитов, что запускает механизм свертывания крови. Адгезия является промежуточным этапом многих межклеточных контактов: макрофага и поврежденной клетки, сперматозоида и яйцеклетки и др.
Явления когезии и адгезии играют важную роль во многих технологических процессах, в частности в технологии лекарств. Когезия и адгезия влияют на взаимодействие компонентов в сложных лекарственных формах, на разрушаемость таблеток, прочность покрытия их оболочками, на процессы растворения и, в конечном итоге, на эффективность терапевтического действия.

17
3. Сорбция и ее виды
Сорбция – гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью веществ из окружающей среды.
Сорбент – твердое вещество или жидкость, способное поглощать вещества из окружающей среды.
Сорбтив – это вещество, которое может поглощаться сорбентом.
Сорбат – вещество, поглощенное сорбентом, т.е. находящееся в связи с ним.
В зависимости от степени прочности связывания сорбтива сорбентом сорбция может быть обратимой и необратимой. Если она является обратимой (что бывает чаще), то в системе устанавливается равновесие, которое характеризуется константой сорбционного равновесия (Kc):
сорбция
сорбент + сорбтив сорбционный комплекс
десорбция
|
k сорбции |
|
|
Kс = |
|
|
, |
k |
десорбции |
||
|
|
|
|
если Kс  1, то преобладает процесс сорбции, если Kс << 1, то преобладает процесс десорбции.
1, то преобладает процесс сорбции, если Kс << 1, то преобладает процесс десорбции.
|
|
|
Сорбция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Адсорбция |
|
||
Абсорбция |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Химическая |
|
|
|
|
||
|
|
|
|
|
Физическая |
||||
|
|
|
(хемосорция) |
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Физическая адсорбция – адсорбция, обусловленная межмолекулярным взаимодействием за счет сил Ван-дер-Ваальса: ориентационных, индукционных и дисперсных; характеризуется обратимостью, неспецифичностью и экзотермичностью.
Химическая адсорбция (хемосорбция) – адсорбция, которая осуще-
ствляется при взаимодействии адсорбента с адсорбтивом с образованием химической связи; характеризуется необратимостью, специфичностью, локализованностью.

18
3.1. Абсорбция
Абсорбция – самопроизвольный процесс поглощения веществ, при котором поглощаемые вещества (абсорбтивы) за счет диффузии распространяются по всему объему вещества – поглотителя (абсорбента).
Распределение поглощаемого вещества между контактирующими фазами характеризуются константной абсорбционного равновесия (константа распределения):
K с1 ,
распр |
с 2 |
|
где с1 – концентрация поглощаемого вещества в абсорбенте, с2 – концентрация поглощаемого вещества в окружающей среде.
Константа распределения зависит от:
природы контактирующих фаз
температуры
Абсорбция подчиняется закономерности «подобное с подобным», т.е. полярное вещество хорошо абсорбируется полярной фазой, а неполярное вещество – неполярной фазой.
Например: HCl(г) хорошо абсорбируется водой, а О2 – перфтордекалином (С10F22 – основа эмульсионного кровезаменителя).
Абсорбируемость газа жидкостью зависит от:
Природы газа;
Давления газа;
Температуры;
Присутствия электролитов.
Влияние природы газа:
Чем легче газ сжижается, тем сильнее он поглощается.
Газы-токсиканты хорошо растворяются в воде, что связано не только с полярностью их молекул, но и со способностью газа к химическому взаимодействию с водой.
1 объем воды может при 15°С и давлении 744 мм рт ст растворить в себе, т.е. абсорбировать 1/50 объема атмосферного воздуха, 1 объем углекислоты, 43 объема сернистого газа и 727 объемов аммиака. Объем газа, который про 0° С и давлении 760 мм рт ст поглощается единицею объема жидкости, называется коэффициентом поглощения газа для этой жидкости. Коэффициент
этот для различных газов и различных жидкостей - различен. Чем выше наружное давление и ниже температура, тем больше растворяется в жидкости газа, тем больше коэффициент поглощения.

19
Влияние давления газа:
Абсорбция газов в жидкости подчиняется закону Генри:
При постоянной температуре абсорбция газа в единице объема жидкости прямопропорциональна парциальному давлению этого газа в газовой смеси над жидкостью.
Математическое выражение закона:
с(Х) = k р(Х),
где с(Х) – концентрация газа в жидкости, моль/л; р(Х) – парциальное давление газа в смеси, Па; k – константа абсорбционного равновесия;
р(Х) = р(общ)  n(X).
n(X).
Закон Генри объясняет возникновение профессиональных заболеваний у водолазов, кессонщиков, летчиков, космонавтов, работа которых связана с переходом из среды с большим давлением в среду с меньшим давлением. При этом растворимость газа в крови уменьшается, образуются пузырьки, которые закупоривают капилляры, вызывая кессонную бо-
лезнь.
Влияние температуры:
С увеличением температуры, растворимость (абсорбция) газов уменьшается.
Влияние электролитов:
Абсорбция газов в растворах электролитов подчиняется закону Се-
ченова:
Растворимость газов в жидкостях в присутствии электролитов понижается вследствие высаливания газов.
Математическое выражение закона:
ln |
с0 |
k c c |
|
|
ln |
с |
эл |
, |
|
|
|
|
где с0 – растворимость газа в чистой воде; с – растворимость газа в присутствии электролита kс – константа Сеченова; сэл – концентрация электролита.
Константа Сеченова зависит от:
природы газа;
ионной силы раствора электролита;
температуры.
Понижение растворимости газов в растворе электролитов связано с процессом сольватации ионов.
Уменьшению растворимости газов в воде способствуют также белки, которые подвергаются гидратации, что приводит к уменьшению количество свободных молекул растворителя.

20
Абсорбция происходит при газовом обмене в легких, при процессах питания живых клеток.
3.2.Адсорбция на подвижной поверхности раздела фаз
Всоответствии со II законом термодинамики свободная поверхност-
ная энергия жидкостей стремится к минимуму (Gs →min). В чистых жидкостях уменьшение этой энергии может произойти только путем сокращения поверхности. В растворах свободная поверхностная энергия может понижаться или увеличиваться. Понижение свободной поверхностной энергии происходит за счет уменьшения удельного поверхностного натяжения в результате адсорбции растворенного вещества в поверхностном слое жидкости. Адсорбция растворенных веществ на поверхности жидких адсорбентов описывается уравнением Гиббса, отражающим зависимость между концентрацией вещества на единице поверхности раздела фаз и концентрацией его в растворе, которое имеет вид:
Г = |
c |
|
d |
, Г = |
c |
||
|
|
|
|
|
|
||
RT |
|
dc |
RT c |
||||
где Г – величина адсорбции растворенного вещества, измеряемая количеством этого вещества, приходящегося на единицу площади поверхности адсорбента, моль/м2; с - равновесная молярная концентрация растворенного вещества, моль/л,
которая в узких интевалах измерений рассчитывается как средняя величи-
на |
с |
1 |
с 2 |
; |
|
|||
|
2 |
|
|
|
||||
|
|
|
|
|
|
|
||
|
d |
|
, |
|
|
|
– изменение удельного поверхностного натяжения, вызван- |
|
|
|
|
|
|
|
|||
|
dc |
|
|
|
c |
|||
ное изменением концентрации растворенного вещества в поверхностном слое;
R – газовая постоянная, 8,31 Дж/(моль K).
Величина |
d |
или |
|
называется поверхностной активностью, |
|
|
|
||||
dc |
c |
||||
|
|
|
обозначается q, служит характеристикой поведения растворенного вещества при его адсорбции поверхностью раздела фаз. Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую молекулы растворенного вещества на поверхности.
Если с увеличением концентрации вещества удельное поверхностное натяжение на границе раздела фаз понижается ( 2 < 1,  < 0), то q 0, и такое вещество называют поверхностно-активным (ПАВ). В этом случае адсорбция положительна (Г > 0). Это означает, что концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора.
< 0), то q 0, и такое вещество называют поверхностно-активным (ПАВ). В этом случае адсорбция положительна (Г > 0). Это означает, что концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора.
