
IV.7 CARBOPALLADATION OF ALLENES |
1511 |
followed by an intramolecular carbopalladation of the allene moiety and finally -hydride elimination to provide the tricyclic compound 128 (Scheme 42).[62]
X
|
I or II |
|
|
|
|
I |
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
n_1 |
E |
58% |
|
E |
|
|
|
|
|
|
|
|
||||
|
|
|
|
E |
|
|
|
E |
||
123 (X = I, Br) |
124 |
|
|
|
|
|||||
|
125 |
|
|
126 |
||||||
n = 0−7, 15 |
|
|
|
|
|
|
|
|
|
|
I:5 mol % PdCl2(PPh3)2, K2CO3 (5 equiv), EtOH (10 equiv), DMF.
II:5 mol % PdCl2(PPh3)2, K2CO3 (5 equiv), n-Bu4NCl (1 equiv), DMF. E = CO2Et
Scheme 41
|
|
|
10 mol % Pd(OAc)2 |
Ph |
||
|
|
|
20 mol % PPh3 |
|
||
|
Ph + |
|
K2CO3, Et4NCl, MeCN, reflux |
|
||
|
|
|
|
H |
||
I |
96% |
|
||||
|
|
|||||
Me |
H |
|||||
|
||||||
|
|
|
|
|
||
127
128
Scheme 42
F. INTRAMOLECULAR CARBOPALLADATION OF ALLENES FOLLOWED BY NUCLEOPHILIC TRAPPING
The -allylpalladium intermediate 130, formed by the intramolecular carbopalladation of 129, could be trapped with the enolate of diethyl malonate, with Bu3SnPh, with piperidine, or with phenol to afford a variety of cycloocta-1,3-diene derivatives 131–134
(Scheme 43).[61]
In 1995 Grigg and co-workers reported a similar cascade consisting of an intramolecular carbopalladation and intermolecular nucleophilic trapping (Scheme 44).[63] The regioselectivity of the allylic nucleophilic substitution can be controlled completely by using different bases.
The intermediate -allylpalladium species 138 (Scheme 44) could also be coupled with phenylboronic acid to yield mainly the benzopyridone derivative 139; however, the regioselectivity depends largely on the base used (Scheme 45).[64]
With sodium azide as the trapping reagent, 141 yields cyclic allyl azides, which can immediately undergo an intermolecular 1,3-dipolar cycloaddition with added norbornadiene and the adducts eventually cleave off cyclopentadiene in a retro-Diels–Alder reaction to provide triazoles (Scheme 46).[65] Sodium benzenesulfinate can also be used as a nucleophile.[65]
1512 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
|
|
|
|
|
|
|
|
|
n-Pr |
|
I |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
E |
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
E |
|
|
n-Pr |
|
129 E |
|
Ph |
||||||||||||||
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
n-Pr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-Pr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
E |
|
i |
|
|
|
|
|
|
ii |
|
|
|
|
|
|
E |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
n-Pr |
51% |
|
|
|
|
|
64% |
n-Pr |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
131 |
|
E |
|
|
|
|
|
|
|
PdLnX |
|
|
|
132 E |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
n-Pr |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
OPh |
|
|
n-Pr |
|
|
|
|
|
|
E = COOEt |
|
|
N |
||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
130 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
n-Pr |
|
|
|
|
iii |
|
|
|
|
|
|
n-Pr |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
E |
|
|
|
|
|
iv |
|
|
|
|
|
E |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
54% |
|
|
|
|
56% |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
n-Pr |
E |
|
|
|
|
|
|
n-Pr |
|
|
|
|
|
E |
||||||||||
133 |
E = CO2Et |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
134 |
|||||||||||||||||||
i:I, CH2E2 (3 equiv), 0.05 M, 120 °C, 23 h.
ii:II, PhSn(n-Bu)3 (2.2 equiv), 0.014 M, 120 °C, 11 h.
iii:II, PhOH (5 equiv), 0.013 M, 80 °C, 24 h, 120 °C, 7 h.
iv:II, piperidine (2 equiv), 0.014 M, 80 °C, 9 h.
I = 5% PdCl2(PPh3)2, K2CO3 (5 equiv), EtOH (10 equiv), DMF.
II = 5% PdCl2(PPh3)2, K2CO3 (5 equiv), n-Bu4NCl, DMF.
Scheme 43
|
|
|
|
|
|
K2CO3 |
|
|
|
N |
|
|
||||
|
|
|
|
|
|
|
|
|||||||||
|
I |
10 mol % Pd(OAc)2 |
|
|
|
|
NMe |
|||||||||
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
O 136 91% |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
20 mol % PPh3 |
|
|
|
|
|
|
|
|
|||||
|
|
|
NMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
NH |
|
|
|
|
|
|
|
|
|
N |
||||
135 |
|
|
Ag2CO3 |
|
|
|
|
|
||||||||
|
|
MeCN |
|
|
|
|
||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NMe |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Pd
O 137 77%
NMe
O
138
Scheme 44
 I
I
NMe
O
IV.7 |
CARBOPALLADATION OF ALLENES |
1513 |
|||||||||
|
|
|
|
|
Ph |
|
|
|
|
|
|
5 mol % Pd(OAc)2 |
|
|
|
|
|
|
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
||||
10 mol % PPh3 |
|
|
|
NMe |
+ |
|
|
|
NMe |
|
|
|
|
|
|
|
|
|
|
|
|||
toluene, H2O (2:1) |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
PhB(OH)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
O |
|
|||||
|
|
139 (71%) |
140 (trace) |
|
|||||||
Scheme 45 |
|
|
|
|
|
|
|||||
|
|
N |
|
|
|
|
|
|
|||
|
|
N N n = 0 |
56% |
|
|
|
|
||||
|
|
|
|
|
n = 1 |
54% |
|
|
|
|
|
O
n
143
|
|
|
|
|
|
|
|
|
|
|
MeO2C |
CO2Me |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
N |
||
|
|
|
|
|
|
|
N3 |
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
N N |
|
|
|
10 mol % Pd(PPh3)4 |
|
|
|
DMAD |
|
|
|
|
||||
|
O |
|
|
|
|
O |
n = 0 |
86% |
|||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
NaN3, DMF |
|
|
|
|
|
|
n = 1 |
57% |
||||
|
n |
|
|
n |
|
|
|
n |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
n = 0 |
71% |
|
142 |
|
|
|
|
|
|
||
141 |
|
n = 1 |
58% |
|
144 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 46
G. CARBOPALLADATION OF ALLENES FOLLOWED
BY SKELETAL REARRANGEMENT
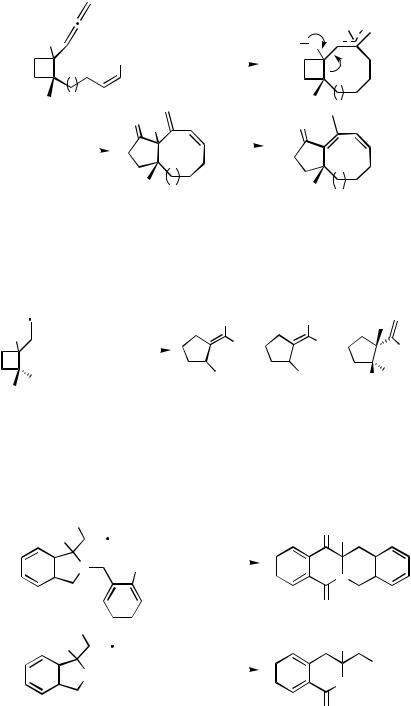
Under the catalysis of Pd(PPh3)4, 1-propadienyl-2-(Z- -iodo-( -1)-alkenyl)cyclobu- tanol 145 afforded the -allylpalladium intermediate 146 after oxidative addition and intramolecular carbopalladation. Nemoto and co-workers observed that the ring strain of the four-membered ring in 146 was released by ring expansion to afford the bicyclo[6.3.0]undecane derivatives 147 and/or 148 with a cyclopentanone moiety (Scheme 47).[66]
An analogous ring expansion was observed upon an intermolecular carbopalladation of the 1-propadienylcyclobutanol 149 with PhPdX formed from phenyl iodide or phenyl triflate (Scheme 48).[66]
Recently, Jeong and Nagao observed a similar ring enlargement of a nitrogen-containing five-membered ring (Scheme 49).[67]
1514 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
XLnPd |
|
||
|
HO |
|
|
10 mol % Pd(PPh3)4 |
H |
O |
|
|||||||
|
|
|
|
I |
Ag2CO3 (1 equiv) |
|
|
|
|
|
|
|
||
|
|
|
n |
toluene, 80 °C |
|
|
|
|
|
|
||||
|
|
|
|
|
n |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
145 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
O H |
|
|
146 |
|
|
|||||||
|
|
|
|
|
O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
147 |
n −1 |
148 |
n −1 |
||||||||
|
|
|
|
|
||||||||||
|
|
n = 1 |
α-hydroxy |
|
|
|
|
|
|
67% |
|
|
|
|
|
|
n = 1 |
β-hydroxy |
|
|
|
|
|
|
63% |
|
|
|
|
|
|
n = 2 |
α-hydroxy 24% |
|
|
|
|
|
|
|||||
|
|
n = 2 |
α-hydroxy |
|
|
|
|
|
|
34% (reflux) |
||||
Scheme 47
|
|
|
|
|
|
|
|
|
|
|
10% Pd(PPh3)4 |
|
O Ph |
|
|
|
O Ph |
|
|
|
O |
|
||||||||||||||||
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
K2CO3 (5 equiv) |
|
|
Me + |
|
Me + |
|
|
|
|
Ph |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
+ |
|
PhX |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
DMF, 80 °C |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-C7H15 |
|||||||||||
|
n-C7H15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-C |
H |
15 |
|
n-C |
H |
15 |
|
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
7 |
|
|
|
|
|
||||||||||||||||||
149 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
150 |
|
|
|
151 |
|
|
|
152 |
|||||||
|
|
X = I |
|
|
β-hydroxy |
|
|
|
12 h |
|
|
|
33% ( 76:24:0 ) |
|
|
|
|
|
||||||||||||||||||||
|
|
X = I |
|
|
β-hydroxy |
|
|
|
20 h |
|
|
|
76% ( 52:0:48 ) |
|
|
|
|
|
||||||||||||||||||||
|
|
X = OTf |
|
|
β-hydroxy |
|
|
|
6 h |
|
|
|
27% ( 62:38:0 ) |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 48 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
5 mol % Pd(PPh3)4 |
|
|
|
O Me |
|
|
|
|
|
||||||||||||||
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K2CO3 (1.2 equiv) |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
I |
|
|
THF, reflux, 16 h |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
72% |
|
|
|
|
|
|
|
N |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 154 |
|
|
|
|
|
|
153 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
5 mol % Pd(PPh3)4 |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ArI (3 equiv) |
|
|
|
|
|
O |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
K2CO3 (1.2 equiv) |
|
|
|
|
Me |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
NR |
|
THF, reflux, 16 h |
|
|
|
|
|
|
|
|
|
Ar |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
68−92% |
|
|
|
|
|
|
|
NR |
|
|
|
|
|
|||||||||||||||
155 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 156 |
|
|
|
|
|
||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
R = alkyl, benzyl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
Ar = phenyl, p-methylphenyl, p-methoxyphenyl |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
Scheme 49
IV.7 CARBOPALLADATION OF ALLENES |
1515 |
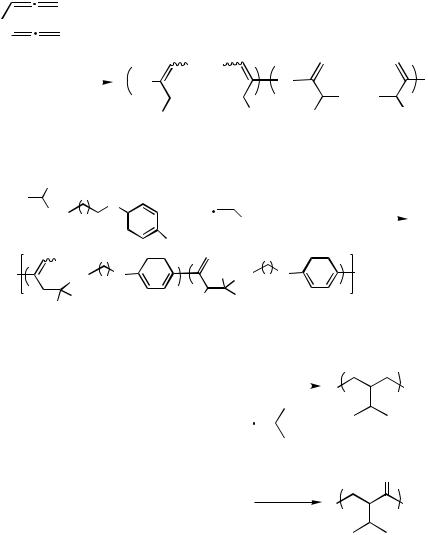
H. POLYMERIZATION REACTIONS INVOLVING
CARBOPALLADATIONS OF ALLENES
The Pd(0)-catalyzed reaction of bis(allene)s, dihaloarenes, and nucleophiles can be applied toward the synthesis of polymers (Scheme 50).[68] The carbon chain between the two allene units ends up as the linker group in the polymer 158.
Aryl halides containing an alkoxy-tethered malonate unit have also been reported to react with allenes yielding a class of polymers 160, which, due to the two regioisomeric modes of the nucleophilic trapping reaction, contained two kinds of repeating units (Scheme 51).[69]
An alternating copolymerization of allene and CO initiated by an acylor methylpalladium complex was developed by Kacker and Sen (Scheme 52).[70]
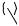 6
6
157 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)6 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
X |
|
Ar |
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
m |
|
Ar |
|
|
|
(CH2)6 |
n |
|||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2 Na+ Nu |
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
|
|
|
|
Nu |
|
|
Nu |
Nu |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Nu = CH(CO2Et)2 |
|
|
|
|
|
|
|
|
|
|
158 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 50 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
CO2Et |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.5 mol % Pd(OAc)2 |
|||||||||||||
R1 |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 mol % dppe |
|
||||||||||||
|
|
|
CO2 |
|
2 |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
+ NaH |
|
|
1,4-dioxane |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
159 |
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
CO2 |
|
|
3O |
|
|
|
|
|
|
|
R1 |
|
3 O |
|
|
|
n |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
CO2 |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
p |
|
|||||||
|
|
|
|
|
|
|
|
|
CO |
Et |
|
|
|
|
|
|
|
|
R |
2 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
R |
|
|
2 |
|
|
|
|
|
|
|
160 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 51 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
|
Pd(MeCN)4(BF4)2 + |
2 PPh3 |
|
|
|
500 psi of CO |
|
|
|
|
|
|
|
m |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
3.8 10 |
−2 |
mmol |
7.6 |
10 |
−2 |
mmol |
|
MeNO2/MeOH (2:1) |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.0 g |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
161
O
5 mol % Pd/C
m
162
Scheme 52
1516 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
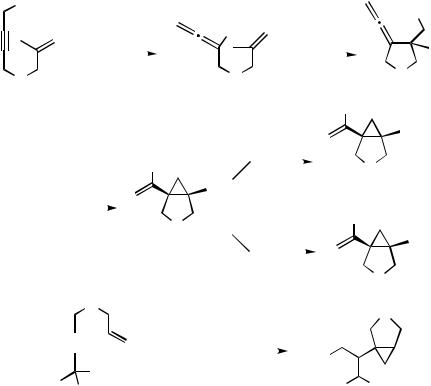
I. CARBOPALLADATION REACTION FORMING Csp2—Pd SPECIES
In all of the reactions discussed above, the carbopalladation of the allene occurred regioselectively in such a way that the substituent of the first formed organopalladium intermediate would be attached to the central carbon atom of the allene moiety to form a - allylpalladium intermediate. However, Grigg et al.[71] and later Oppolzer et al.[72] observed that the intramolecular carbopalladation of the first formed allene 165 proceeded in a completely different manner (Scheme 53). Instead of the formation of a - allylpalladium complex, a reverse regioselectivity to form a Csp2—Pd intermediate was observed.
OCO2Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
XPd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 mol % Pd(OAc)2 |
PdX |
|
|
|
|
|
|
|
||||||||
|
|
20 mol % PPh3 |
|
|
|
|
|
5-exo insertion |
|
|||||||||
|
|
toluene, 85 °C, 16 |
|
h |
N |
|
|
|
|
|
|
|
N |
|||||
N |
|
|
Ref. [72] |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
SO2Ph |
||||||||
SO2Ph |
|
|
|
|
|
|
SO2Ph |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
165 |
||||||
163 |
|
|
|
|
|
|
|
164 |
|
|
|
|
|
CO2Me |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
PdX |
|
CO |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
MeOH |
|
|
|
|
|
N |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO2Ph |
|
|
3-exo insertion |
|
|
|
|
|
|
|
|
|
|
167 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO2Ph |
|
RSnBu3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
166 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
or NaBR4 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO2Ph |
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
168 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.5 mol % Pd2(dba)3 .CHCl3 |
|
O |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
MeO |
|
|
|
|||
|
|
|
|
R |
|
10% PPh3, CO (1 atm) |
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||||||
MeOCO2 |
|
|
|
MeOH |
|
|
|
|
|
R |
|
R |
|
|||||
|
|
|
|
|
|
|
|
|
||||||||||
|
R |
|
Ref. [73] |
|
|
|
|
|
|
|
||||||||
|
|
|
|
R = Me or H |
|
|
|
|
170 |
|
||||||||
|
|
169 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
X = NTs, C(SO2Ph)2, CHSO2Ph
Scheme 53
Obviously, in this case the normal regiochemical preference cannot be achieved due to the geometrical constraints exerted by the attachment of both reacting units to the fivemembered ring. Instead, 3-exo-dig carbopalladation prevails, and the thus formed alkenylpalladium intermediate 166 is trapped by CO and MeOH to yield a bicyclic - cyclopropylacrylate 167 and 170. Other trapping reagents for the intermediate 166 can be applied as well (Scheme 53). In addition to the same type of product 172, the reaction of the propargyl carbonate 171 with two methyl groups adjacent to the carbonate moiety gave

IV.7 CARBOPALLADATION OF ALLENES |
1517 |
a bicyclo[4.3.0]nonenone derivative 173, which must have been formed by CO insertion after the first intramolecular carbapalladation step affording 174, followed by intramolecular acylpalladation to give 175 and reductive elimination, that is, by cyclization of the intermediate acylpalladium intermediate 175 (Scheme 54).[72]
PhO2S |
SO2Ph |
|
|
PhO2S |
SO2Ph |
PhO2S |
SO2Ph |
||||||||||||||
|
|
|
|
|
|
2.5 mol % Pd2(dba)3 |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
10 mol % AsPh3 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
CO, HOAc, 45 °C |
|
|
|
|
+ |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
MeO2C |
AcO |
|
||||||
MeOCO2 |
|
|
|
|
|
|
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
171 |
|
|
|
|
|
|
|
|
|
|
|
172 |
|
31% |
173 |
45% |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
reductive |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
elimination |
|
|
|
|
|
|
|
|
PhO2S |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
SO2Ph |
|
|
|
|
|
PhO2S SO2Ph |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
AcOLnPd II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
PdOAc |
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
175 |
|
||||
|
|
|
|
|
|
174 |
|
|
|
|
|
|
|
|
|
|
|
||||
Scheme 54
This reaction was utilized to synthesize ( )- -thujone (Scheme 55).[72] The two centers of chirality in the cyclopropane ring were controlled in a highly diastereoselective manner by the center of chirality originally present in the starting aldehyde 176.
|
|
|
PhO2S |
SO2Ph |
|
|
|
PhO2S SO2Ph |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
CHO 4 steps |
|
|
Pd2(dba)3, Me2Zn |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTHP |
|
|
|
|
|
Et2O, reflux, 91% |
|
|
|
|
|
H |
||||
176 |
MeOCO2 |
|
|
|
|
|
|
|
|
|
|
|||||
177 |
|
|
|
178 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
PhO2S SO2Ph |
|
|
|
|
|
|
O |
||||||
|
|
|
1. Al-Hg, THF, H2O |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
PtO2, H2, MeCO2Et |
|
2. LDA, MoOPh |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
HOAc, 50 °C, 96% |
H |
60% |
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
179 |
|
|
|
|
|
|
-α-thujone |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
180 |
||||||
Scheme 55

1518 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
In all of the stoichiometric intermolecular reactions of a -allylpalladium complex with an allene to form a new -allylpalladium intermediate, the type of insertion reaction was established by 1H NMR spectroscopy as well as X-ray single crystal structure analy- sis.[1]–[15] However, it is interesting to note that the corresponding intramolecular carbopalladations of allenes displayed two different modes to form either a Csp2 —Pd species or a new -allylpalladium intermediate highly selectively depending largely on the length of the tether between the two moieties (Scheme 56).[73]–[75]
This abnormal insertion mode was applied in a total synthesis of the natural product ( )-isoiridomyrmecin 197 in seven steps starting from 2,3-butadienyl bromide (Scheme 57).[73]
Pd OAc
|
n = 2 |
|
|
n = 3 |
R |
|
PdOAc |
R |
|
|
|
|
|||
R |
|
PdOAc |
|
|
|
|
|
|
|
|
|
|
|
||
181 |
|
182 |
|
|
|
183 |
|
|
|
|
|
|
|
||
R = (CH2)n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PdOAc |
|
10 mol % Pd(PPh3)4 |
PdOAc |
|
|
|
||
|
HOAc, CO |
|
|
|
|
|
|
|
75 °C, 22% |
|
|
|
|
|
|
OAc |
|
|
|
|
|
|
|
184 |
|
|
185 |
|
|
186 |
|
|
|
|
|
O |
|
H |
O |
|
O |
|
H |
|
|
||
|
|
|
|
|
|
||
CO |
|
|
|
|
|
|
|
|
PdOAc |
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PdOAc |
|
|
|
|
187 |
|
188 |
|
|
189 |
|
|
Pd(PPh3)4 |
Me |
H |
|
Me |
H |
|
|
HOAc |
|
|
|
CO3H |
||
|
|
|
|
|
|
||
|
OAC CO, 60 °C |
|
|
PdX |
|
|
|
|
|
|
|
|
|
||
|
28% |
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
190 |
|
|
191 |
|
|
192 |
|
Scheme 56

IV.7 CARBOPALLADATION OF ALLENES |
1519 |
Br |
O |
3 steps |
|
|
|
5 mol % Pd2(dba)3.CHCl3 |
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
OAc |
|
|
|
|
|
|
|
|
|
|
|
|
NMe2 |
|
|
|
|
|
|
|
|
|||
193 |
|
|
|
|
|
|
|
|
|
30 mol % P(2-furyl)3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HOAc, 58% |
|
|
|||||
H |
|
|
|
|
|
|
|
H |
|
|
|
194 |
|
H |
Me |
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
CO2H |
+ |
|
|
|
|
CO2H |
|
3 steps |
O |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
isomer separation |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Me H |
Me H |
|
|
|
|
|
|
Me H |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
197 |
|
|
|||
195 |
196 |
|
Isoiridomyrmecin |
||
|
||
|
Scheme 57 |
J.SUMMARY
1.The intermolecular carbopalladation of allenes has been shown to form -allyl- palladium intermediates.
2.The intramolecular carbopalladations of allenes has been shown to afford either -
allylpalladium intermediates or Csp2—Pd species, depending on the structure of the substrates.
3.-Allylpalladium intermediates described in this section can undergo either a -H elimination or a nucleophilic substitution reaction. Enantioselective nucleophilic substitution can afford the corresponding chiral compounds with high enantiomeric excesses.
In conclusion, with subtle design, carbopalladation of allenes will provide efficient access to dienes, alkenes, monocycles, and oligocycles with functional groups and will show its utility in the synthesis of specific target molecules.
REFERENCES
[1]R. G. Schultz, Tetrahedron Lett., 1964, 301.
[2]R. G. Schultz, Tetrahedron, 1964, 20, 2809.
[3]M. S. Lupin and B. L. Shaw, Tetrahedron Lett., 1964, 883.
[4]R. van Helden, C. F. Kohll, D. Medema, G. Verberg, and T. Honkhoff, Rec. Trav. Chim., 1968, 87, 961.
[5]D. Medema and R. van Helden, Rec. Trav. Chim., 1971, 90, 304.
[6]D. Medema and R. van Helden, Rec. Trav. Chim., 1971, 90, 324.
[7]R. P. Hughes and J. Powell, J. Organomet. Chem., 1969, 20, P17.
[8]R. P. Hughes and J. Powell, J. Organomet. Chem., 1973, 60, 409.
[9]P. Hughes and J. Powell, J. Chem. Soc. Chem. Commun., 1971, 275.
1520 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
[10]R. P. Hughes and J. Powell, J. Organomet. Chem., 1972, 34, C51.
[11]E. Ban, R. P. Hughes, and J. Powell, J. Organomet. Chem., 1974, 69, 455.
[12]R. R. Stevens and G. D. Shier, J. Organomet. Chem., 1970, 21, 495.
[13]H. A. Ankersmit, N. Veldman, A. L. Spek, K. Eriksen, K. Goubitz, K. Vrieze, and G. van Koten, Inorg. Chim. Acta, 1996, 252, 203.
[14]J. H. Groen, C. J. Elsevier, K. Vrieze, W. J. J. Smeets, and A. L. Spek, Organometallics, 1996, 15, 3445.
[15]J. G. P. Delis, J. H. Groen, K. Vrieze, P. W. N. M. van Leeuwen, N. Veldman, and A. L. Spek,
Organometallics, 1997, 16, 551.
[16]I. Shimizu and J. Tsuji, Chem. Lett., 1984, 233.
[17]R. Grigg, S. Brown, V. Sridharan, and M. D. Uttley, Tetrahedron Lett., 1998, 39, 3247.
[18]I. Shimizu, T. Sugiura, and J. Tsuji, J. Org. Chem., 1985, 50, 537.
[19]J. Tsuji, J. Organomet. Chem., 1986, 300, 281.
[20]B. M. Trost, Tetrahedron, 1977, 33, 2615.
[21]B. M. Trost, Acc. Chem. Res., 1980, 13, 385.
[22]M. Ahmar, B. Cazes, and J. Goré, Tetrahedron Lett., 1984, 25, 4505.
[23]M. Ahmar, J.-J. Barieux, B. Cazes, and J. Goré, Tetrahedron, 1987, 43, 513.
[24]B. Friess, B. Cazes, and J. Goré, Bull. Soc. Chim. Fr., 1992, 129, 273.
[25]B. Cazes, Pure Appl. Chem., 1990, 62, 1867–1878.
[26]C. G. Frost, J. Howarth, and J. M. J. Williams, Tetrahedron: Asymmetry, 1992, 3, 1089.
[27]B. Cazes, V. Colovary, and J. Goré, Tetrahedron Lett., 1988, 29, 627.
[28]A. Aniès, B. Cazes, and J. Gorè, J. Chem. Res., (S ), 1996, 116.
[29]P. J. Stang, M. Hanack, and L. R. Subramanian, Synthesis, 1982, 85.
[30]J. E. McMurry and W. J. Scott, Tetrahedron Lett., 1983, 24, 979.
[31]B. Friess, B. Cazes, and J. Goré, Tetrahedron Lett., 1988, 29, 4089.
[32]N. Vicart, B. Cazes, and J. Goré, Tetrahedron Lett., 1995, 36, 5015.
[33]V. Gauthier, B. Cazes, and J. Goré, Tetrahedron Lett., 1991, 32, 915.
[34]V. Gauthier, C. Grandjean, B. Cazes, and J. J. Goré, Bull. Soc. Chim. Fr., 1994, 131, 381.
[35]V. Gauthier, B. Cazes, and J. Gore, Bull. Soc. Chim. Fr., 1996, 133, 563.
[36]N. Chaptal, V. Colovray-Gotteland, C. Grandjean, B. Cazes, and J. Goré, Tetrahedron Lett., 1991, 32, 1795.
[37]N. Kopola, B. Friess, B. Cazes, and J. Goré, Tetrahedron Lett., 1989, 30, 3963.
[38]R. Grigg and V. Savic, Tetrahedron Lett., 1996, 37, 6565.
[39]R. Grigg, V. Sridharan, and C. Terrier, Tetrahedron Lett., 1996, 37, 4221.
[40]N. Vicart, B. Cazes, and J. Goré, Tetrahedron, 1996, 52, 9101.
[41]R. Grigg, S. Brown, V. Sridharan, and M. D. Uttley, Tetrahedron Lett., 1997, 38, 5031.
[42]R. Grigg and R. Pratt, Tetrahedron Lett., 1997, 38, 4489.
[43]K. Hiroi, F. Kato, and A. Yamagata, Chem. Lett., 1998, 397.
[44]R. C. Larock, S. Varaprath, H. H. Lau, and C. A. Fellows, J. Am. Chem. Soc., 1984, 106, 5274.
[45]R. C. Larock, N. G. Berrios-Peña, and C. A. Fried, J. Org. Chem., 1991, 56, 2615.
[46]E. Desarbre and J.-Y. Mérour, Tetrahedron Lett., 1996, 37, 43.
[47]R. C. Larock, Y. He, W. W. Leong, X. Han, M. D. Refvik, and J. M. Zenner, J. Org. Chem., 1998, 63, 2154.
[48]R. C. Larock and J. M. Zenner, J. Org. Chem., 1995, 60, 482.
