
- •Качановский е.А., Ушаков в.Л.
- •Выделение днк.
- •В в е д е н и е
- •Исходный материал
- •Ткани животных
- •Эритроциты
- •Мягкие растительные ткани
- •Бактерии
- •Процедура выделения днк.
- •Контрольные вопросы.
- •Йодные часы.
- •Реакция Белоусова – Жаботинского.
- •Ртутное сердце (амеба).
- •Оптическая активность биомолекул.
- •R-аланин
- •Техника измерения.
- •1. Поляриметр круговой см-2.
- •2. Автоматический поляриметр фотоэлектронный а1-епо.
- •Нуклеозиды
- •Свойства нуклеозидов
- •Минорные нуклеозиды
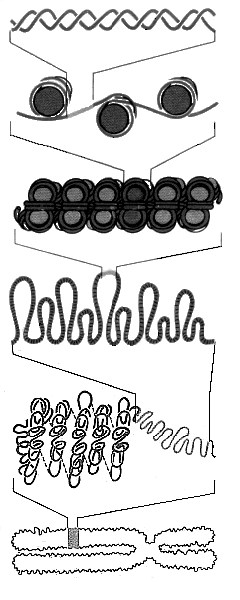
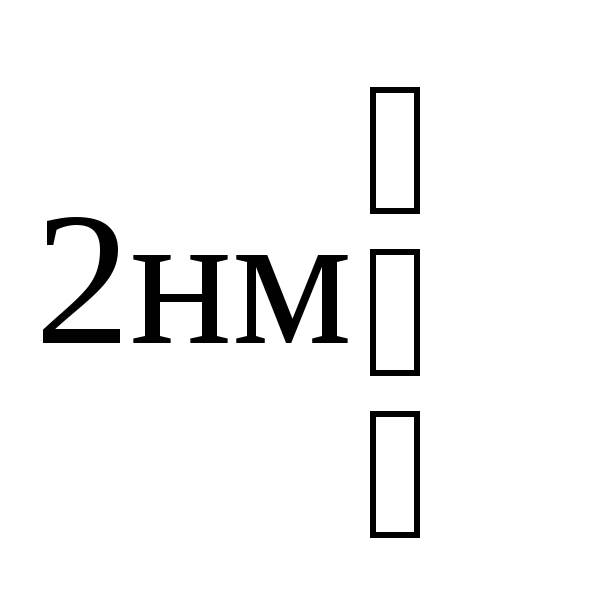
- •1Ыйуровень упаковки в 6,7 раз 2ойуровень упаковки в 40 раз 3ийуровень упаковки (петельный) в 680 раз
1Ыйуровень упаковки в 6,7 раз 2ойуровень упаковки в 40 раз 3ийуровень упаковки (петельный) в 680 раз
КоК
Короткий участок двойной спирали ДНК
(линкерная ДНК)
3
нуклеосомы
Хроматин
в форме "бусин на нити"
(ДНК
"накручена" на белковый гистон)
≈200
нуклеотидов на нуклесому
Хроматиновая
фибрилла 30 нм, состоящая из упакованных
нуклеосом
Часть
хромосомы в растянутом виде
(фибриллы
связаны белками. В основании концов
петель находится ДНК топоизомераза
II)
Конденсированный
участок метафазной хромосомы
Целая
метафазная хромосома
(сверху
покрыта негистоновыми белками
(рибонуклеопротеинами) и РНК)
4ыйуровень
упаковки
в 12000 раз
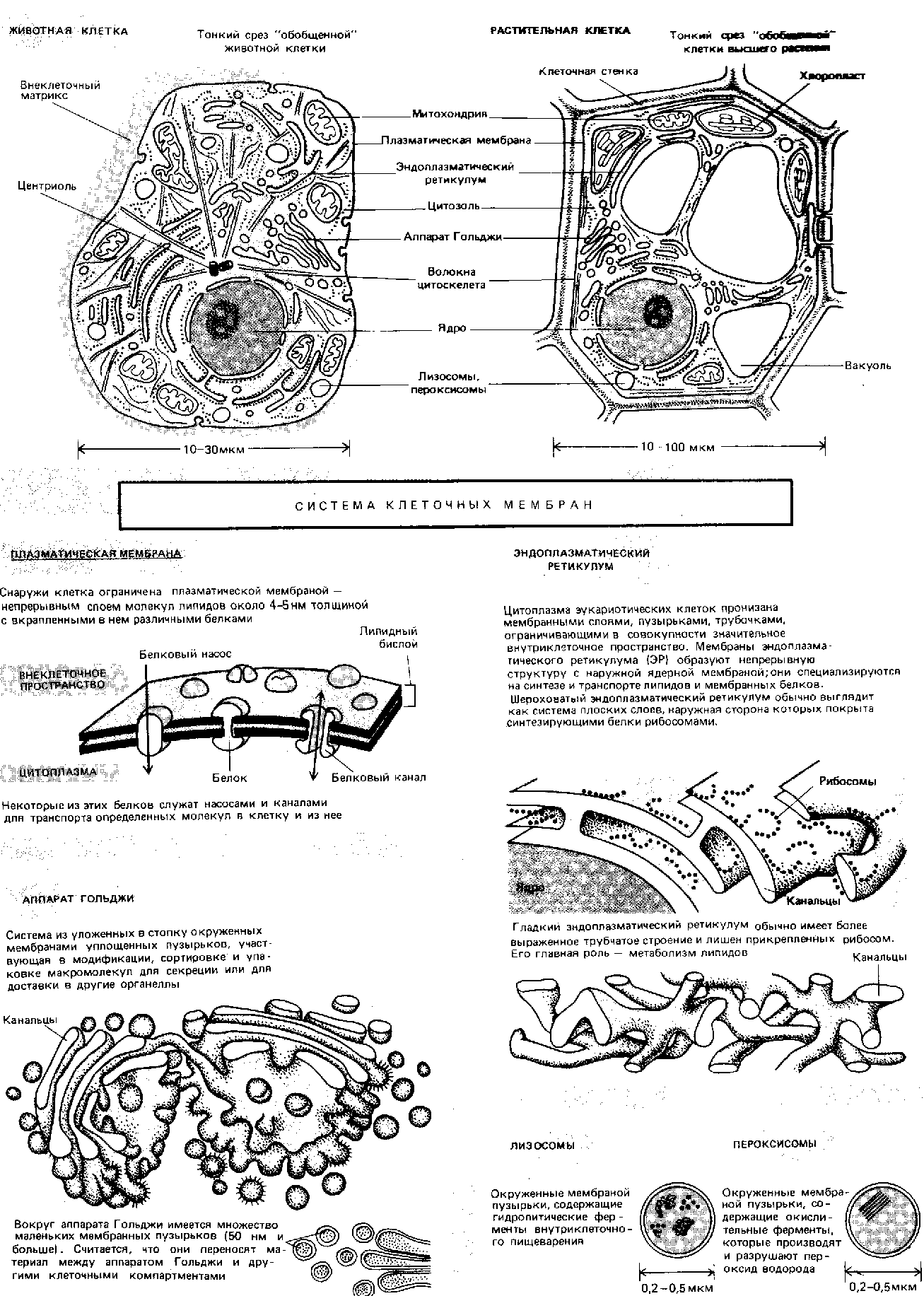
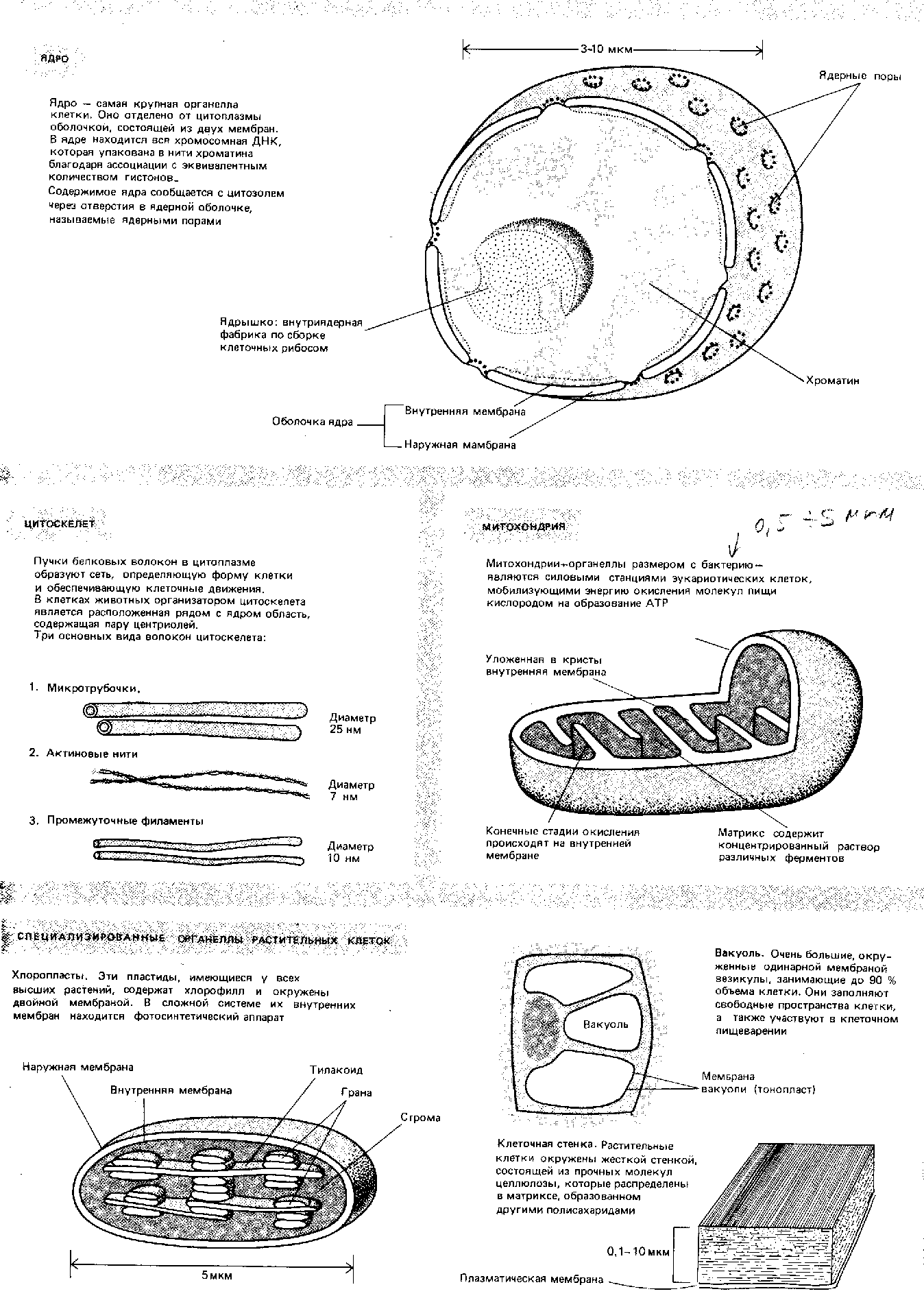
Приложение 2. Состав клетки. (Албертс, 1994).
Приложение 3. Виды и энергия связей в биологических молекулах.
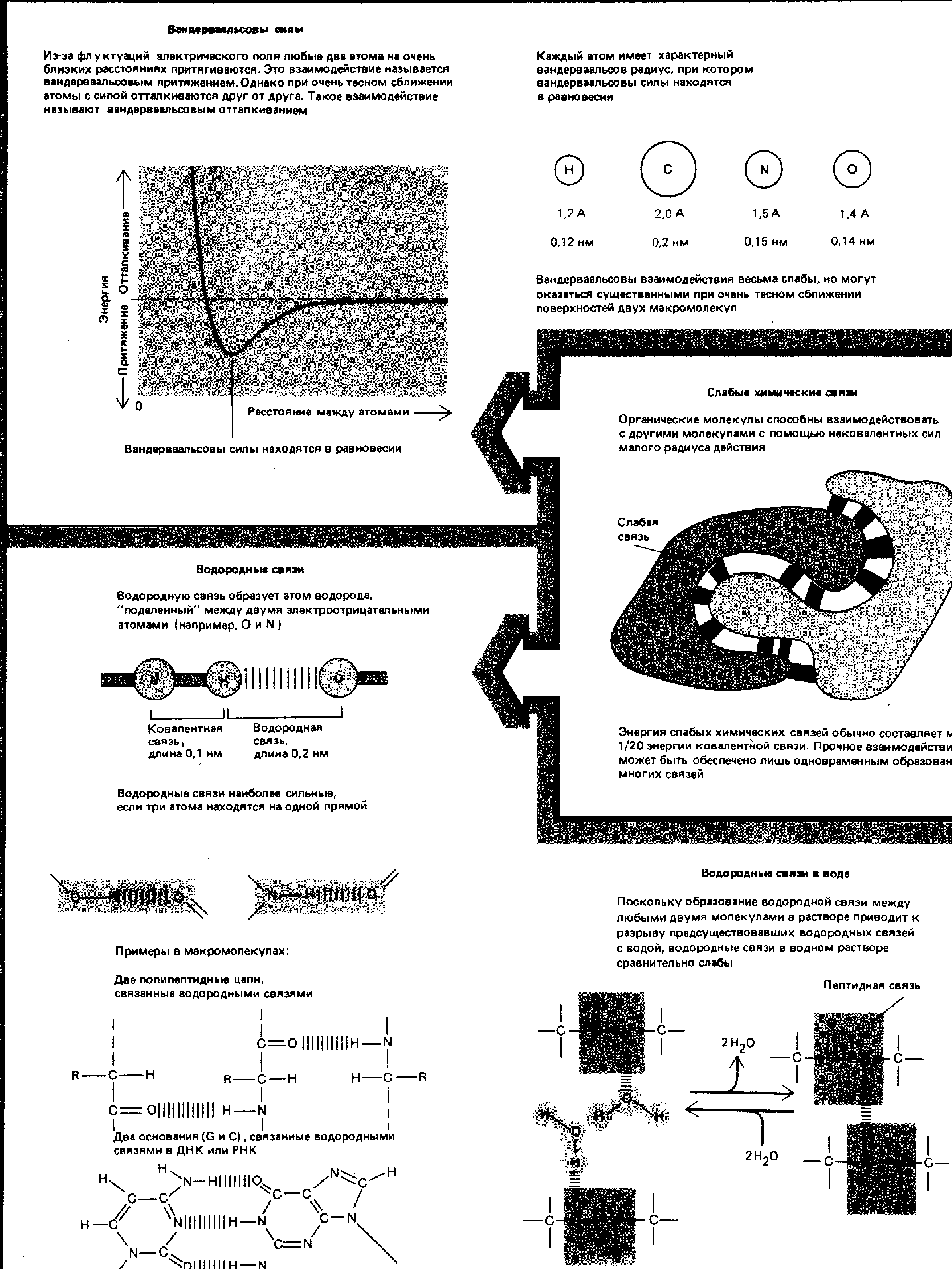
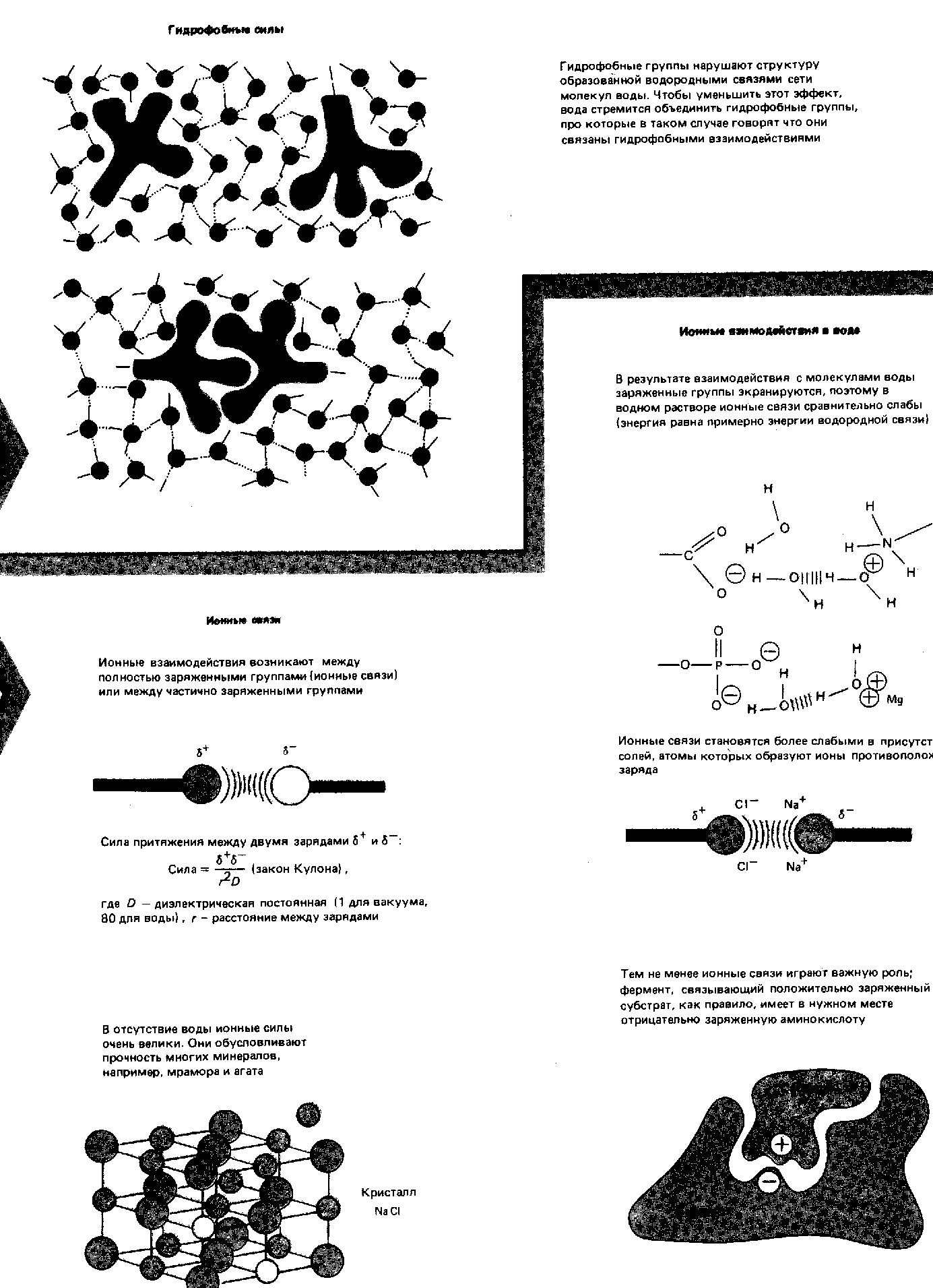
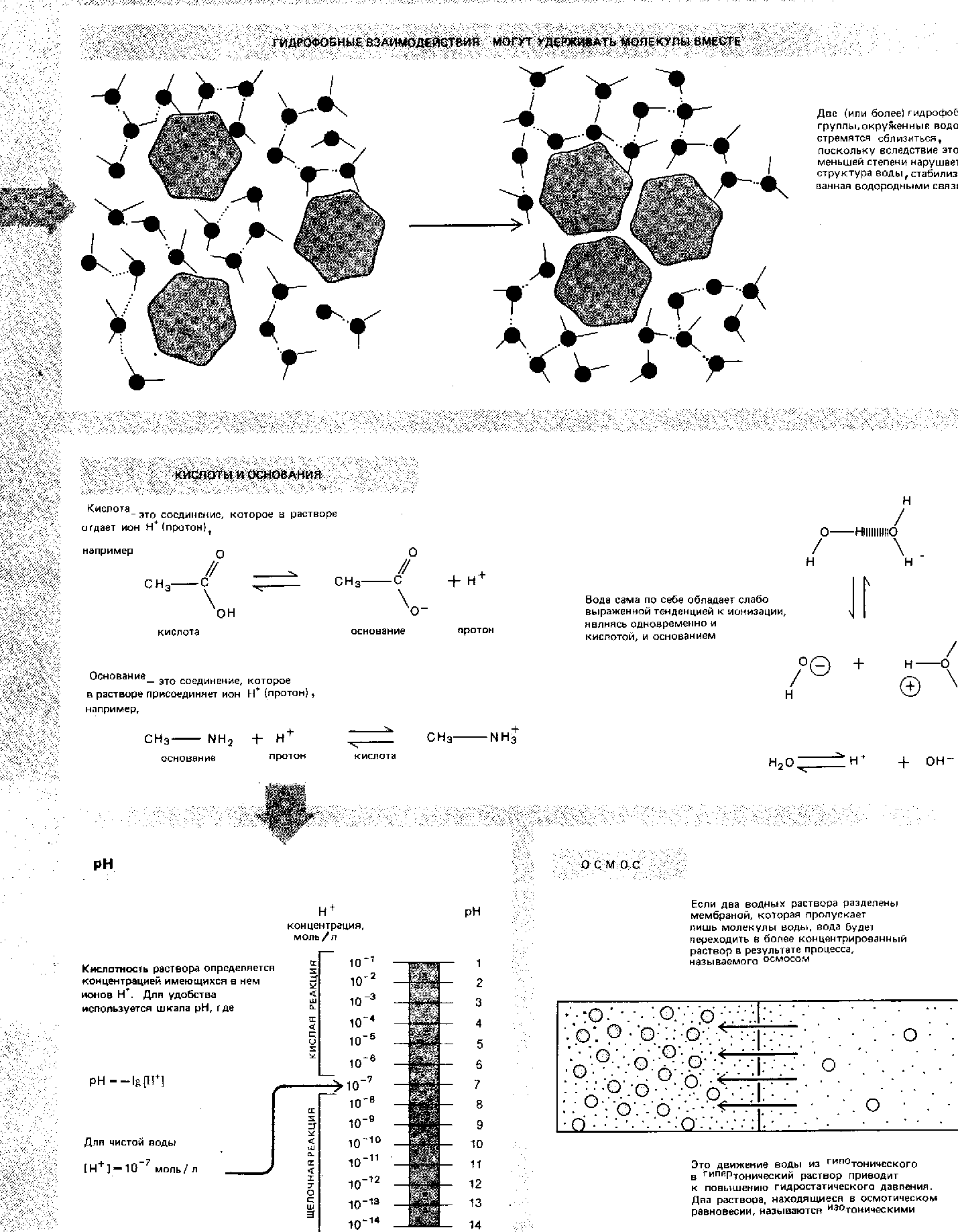
Силы, стабилизирующие третичную структуру глобулярных белков (Ленинжер, 1985).
Вторичную структуру полипептидов формируют и поддерживают: внутрицепочечные водородные связи, которые скрепляют α-спираль и межцепочечные водородные связи, стабилизирующие β-конформацию цепей, образующих складчатые слои. При наличии соответствующей аминокислотной последовательности α -спираль и β-конформация - это самые устойчивые структуры, которые может иметь данный участок цепи; иными словами, они являются структурами с наименьшей свободной энергией. Для стабилизирования третичной структуры глобулярных белков существуют четыре типа взаимодействий, сочетание которых обеспечивает правильное взаимное расположение всех витков и петель в глобулярных белках (рис. 3) при соблюдении нормальных биологических условий (температура, рН, концентрацияионов).
1. Водородные связи между R-группами остатков, расположенных в соседних петлях полипептидной цепи. Например, гидроксильная группа остатка серина в одном участке полипептидной цепи может образовать водородную связь с атомом азота в кольце остатка гистидина, находящегося в соседней петле той же цепи.
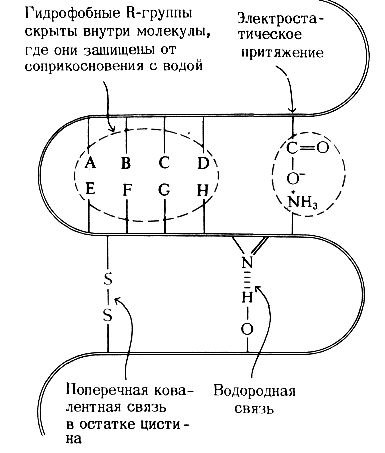
Рис. 3. Силы, стабилизирующие третичную структуру глобулярных белков.
2. Электростатическое притяжение между противоположно R-группами. Например, отрицательно заряженная карбоксильная группа(—СОО—) остатка глутаминовой кислоты может притягиваться положительно заряженной ε-аминогруппой(—NН3+) остатка лизина, расположенного в соседней петле.
3. Гидрофобные взаимодействия. Гидрофобные R-группы некоторых аминокислотных остатков избегают контактов с водным окружением и стремятся собраться вместе внутри глобулярной структуры, где они защищены от соприкосновенияс водой.
4. Ковалентные поперечные связи. Соседние петли полипептидной цепи в некоторых белках, например в рибонуклеазе, содержат остатки цистина, которыеобразуют внутрицзпочечные ковалентные поперечные связи между соседними петлями. Такие ковалентные поперечные связи, конечно, намного прочнее, чем перечисленные выше нековалентные взаимодействия, однакоони встречаются не во всех белках. Следовательно, те белки, у которых нет дисульфидных поперечных связей, поддерживают свойственную им третичную структуру при помощи множества слабых нековалентных взаимодействий и разного рода контактов, в совокупности придающих структуре достаточную прочность. Хотя нативная третичная структура каждого глобулярного белка отвечает минимуму свободной энергии и потому является самой устойчивой конформацией, какую только может принять данная полипептидная цепь, третичную структуру глобулярных белков не следует считать абсолютно жесткой и неподвижной. Многие глобулярные белкив норме претерпевают конформационные изменения при выполнении ими биологических функций. Например, молекула гемоглобина изменяет своюконформацию при связывании кислорода и возвращается к исходной конформации после его освобождения. Кроме того, молекулы многих ферментов претерпевают конформационные изменения при связывании субстратов - это составляет часть их каталитического действия. Полипептидный остов глобулярных белков характеризуется определенной степенью гибкости, вследствие чего эти белки подвержены локальным внутренним флуктуациям, т.е. они как бы «дышат».
Свертывание полипептидных цепейпроисходит с очень высокой скоростью.В живых клетках белки образуются из аминокислот с очень высокой скоростью. Например, в клетках Е.соli полная биологически активная молекула белка, содержащая 100 аминокислотных остатков, может быть построена за 5 с при 37°С. Однако расчеты показывают, что если полипептидная цепь из 100 аминокислотных остатков будет беспорядочно «перебирать» все возможные углы вращения вокруг каждой одинарной связи остова, пока не «найдет» свойственную ей биологически активную конформацию, то на это потребуется по меньшей мере 1050 лет! Таким образом, белки не могут принимать правильную конформацию, сворачиваясь совершенно случайным образом по принципу «проб и ошибок». Должны существовать более короткие и прямые пути. Мы не знаем в точности, как и по какому пути проходит процесс самопроизвольного свертывания белка; начинается ли этот процесс на одном из концов цепи, в середине или же в нескольких точках одновременно. Однако, самопроизвольное свертывание полипептидных цепей в правильную третичную структуру, очевидно, должно быть высококооперативным. Это означает, что если какой-то минимальный отрезок цепи свернулся надлежащим образом, то это сильно увеличивает вероятность правильной укладки всех остальных участков цепи.

Приложение 4. Фосфат и бикарбонат - важные биологические буферные системы. (Ленинжер, 1985).
У всех живых организмов внутриклеточные и внеклеточные жидкости обычно имеют характерную и постоянную величину рН, которая поддерживается с помощью различных биологических систем. Однако первая линия защиты живых организмов, препятствующая изменениям их внутреннего рН, обеспечивается буферными системами. Две наиболее важные буферные системы у млекопитающих - это фосфатная и бикарбонатная системы. Фосфатная буферная система, играющая важную роль в поддержании рН внутриклеточной жидкости, представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РO4-(донора протона) и иона НРО42-(акцептора протона).
Н2РО4- = Н+ + НРО42-
Донор Акцептор
протонапротона
Фосфатная буферная система работает точно так же, как ацетатная, с той разницей, что она функционирует в другом интервале значений рН. Эта система обладает максимальной эффективностьювблизи рН 6,86, поскольку величина рК' ионов Н2РО4-равна 6,86. Фосфатная буферная пара Н2РО4- - НРО42- способна сопротивляться изменениям рН в интервале между 6,1 и 7,7 и может, следовательно, обеспечивать достаточную буферную емкость внутриклеточной жидкости, величина рН которой лежит в пределе 6,9-7,4.
Главной буферной системой плазмы крови служит бикарбонатная система, представляющая собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты (Н2СО3), выполняющей роль донора протона,и бикарбонат-иона (НСО3-), выполняющего роль акцептора протона:
Н2СО3
![]() =
Н+
+ НСО3-
=
Н+
+ НСО3-
Э![]() та
система, которая имеет свою собственную
константу равновесия
та
система, которая имеет свою собственную
константу равновесия
![]() :
:
и функционирует в качестве буфера так же, как и другие сопряженные кислотно-основные пары. Ее уникальная особенность состоит, однако, в том, что один из ее компонентов, а именно угольная кислота (Н2СО3), образуется в результате взаимодействия растворенной в воде (р) двуокиси углерода с водой в соответствии с обратимой реакцией:
С02(р) + Н20 = Н2С03,
константа равновесия,
которой равна
![]() :
:
П![]() оскольку
при нормальных условияхдвуокись
углерода представляет собой газ,
величина [СО2(р)],
т. е. концентрация растворенной
СО2,
определяется равновесием с СО2газовой фазы (г):
оскольку
при нормальных условияхдвуокись
углерода представляет собой газ,
величина [СО2(р)],
т. е. концентрация растворенной
СО2,
определяется равновесием с СО2газовой фазы (г):
С02(г) = С02(р),
характеризуемым константой равновесия К3’, равной
![]()
Величина рН бикарбонатной буферной системы зависит от концентрации растворенных в ней компонентов Н2СО3 и НСОз-, выполняющих роль донора и акцептора протонов. Поскольку, однако, концентрация Н2СО3 в свою очередь зависит от концентрации раствореннойСО2, а последняя - от парциального давления СО2 в газовой фазе, величина рН бикарбонатного буфера, находящегося в контакте с газовой фазой, в конечном счете определяется концентрацией ионов НСОз- в водной фазе и парциальным давлением СО2 в газовой фазе.
Бикарбонатная буферная система функционирует как эффективный физиологический буфер вблизи рН 7,4, потому что донор протона Н2СО3 в плазме крови находится в подвижном равновесии с большим резервным объемом газообразной СО2 в воздушном пространстве легких. В любых условиях, когда кровь почему-либо вынуждена поглощать избыток ионов ОН- и рН повышается, количество угольной кислоты (Н2СО3), частично превратившейся в НСО3- в результате взаимодействия с ионами ОН-, быстро восстанавливается за счет большого запаса газообразной СО2 в легких. СО2 (г) растворяется в крови, образуя СО2 (р), которая вступает в реакцию с водой, что приводит к образованию Н2СО3. И наоборот, когда величина рН крови почему-либо уменьшается, некоторое количество НСО3- буферной системы связывается с избытком ионов Н+ и образуется избыток Н2СО3. Эта Н2СО3 распадается, выделяя растворенную СО2, которая в свою очередь переходит в газовую фазу в легких и в конце концов выдыхается организмом. По мере того как кровь протекает через многочисленные капиллярные сосуды
К
Водная фаза
Н++ НСО3-
Н2СО3
Н2О
+
СО2(р)
Воздушное прост-
ранство в легких
СО2(г)
Рис.
4. Между СО2
в воздушном пространстве легких
и бикарбонатным буфером в плазме крови,
протекающей через капилляры легких,
устанавливается
равновесие. Так как концентрация
растворенной СО2
может быть быстро отрегулирована путем
изменений скорости дыхания, бикарбонатная
буферная система крови находится почти
в равновесии с обширным потенциальными
резервуаром СО2.![]()
![]() + Н2О
+ Н2О![]()
Буферная система крови включает три взаимосвязанных обратимых равновесия между газообразной СО2 в легких и бикарбонат-ионом (НСОз-) в плазме крови (рис. 4). Когда ионы Н+ попадают в кровь при ее протекании через сосуды тканей, их концентрация сразу же повышается. Это приводит к тому, что равновесие реакции 3 (рис. 4) смещается и устанавливается новое равновесие, соответствующее более высокой концентрации Н2СО3, что в свою очередь приводит к повышению концентрации СО2 (р) в крови. В результате давление СО2 в газовой фазе легких тоже повышается и лишняя СО2 выдыхается. Наоборот, когда в плазму крови поступает некоторое количество ионов ОН-, события происходят в обратной последовательности. Понижение концентрации ионов Н+ вызывает диссоциацию части молекул Н2СО3 на ионы Н+ и НСО3-, а это в свою очередь приводит к растворению в плазме крови некоторого дополнительного количества СО2 (г), содержащегося в легких. Таким образом, высокая интенсивность процесса дыхания, т. е. высокая скорость вдыхания воздуха и выдыхания СО2, может обеспечить достаточно быстрые сдвиги этих равновесий, что обусловливает сохранение постоянной величины рН в крови.
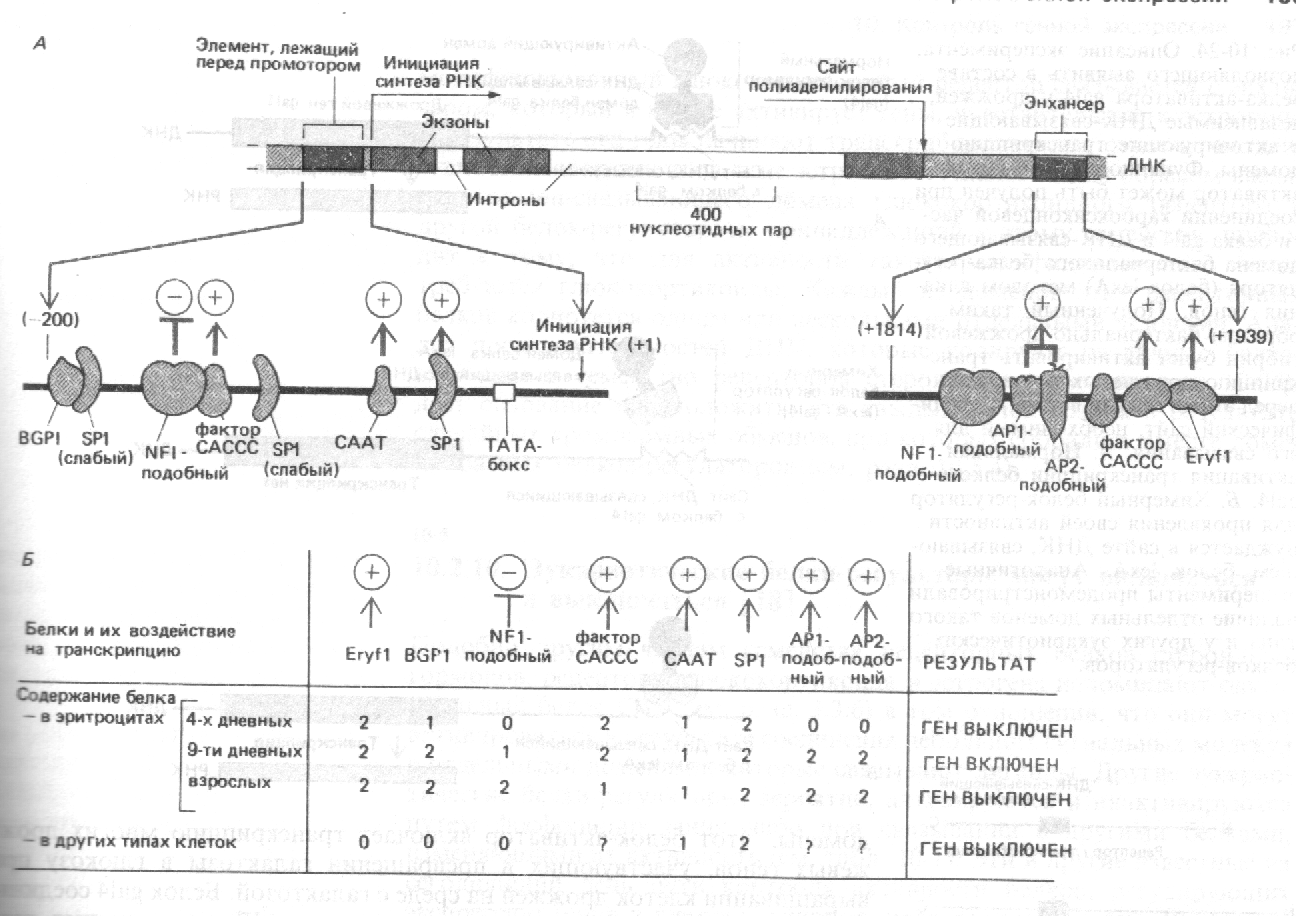
Величина рН плазмы крови поддерживается на удивительно постоянном уровне. В норме плазма крови имеет рН, близкий к 7,40. Нарушение механизмов, регулирующих величину рН, наблюдающиеся, например, при тяжелых формах диабета вследствие ацидоза, обусловленного «перепроизводством» метаболических кислот, вызывает падение рН крови до величины 6,8 и ниже, что в свою очередь, может приводить к непоправимым последствиям и смерти. При некоторых других заболеваниях величина рН крови иногда достигает столь высоких значений, что она уже не поддается нормализации. Поскольку повышение концентрации ионов Н+ всего лишь на 1,18·10-7 М (приблизительная разница между кровью при рН 7,4 и кровью при рН 6,8) может оказаться опасным для жизни, возникает вопрос: какие молекулярные механизмы обеспечивают поддержание величины рН в клетках со столь высокой точностью? Величина рН влияет на многие структурные и функциональные свойства клетки, однако к изменениям рН особенно чувствительна каталитическая активность ферментов. Kаждый из ферментов проявляет максимальную активность при определенном значении рН, которое называется оптимумом рН. Приложение 5.Регуляция транскрипции генов.
Приложение 6. Сигнальные последовательности для регуляции транспорта белков.

Приложение 7. Внутриклеточные посредники.
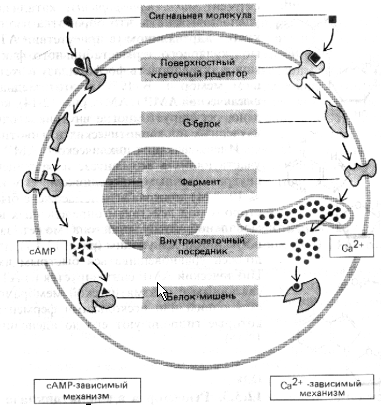
Рис. Два главных механизма, с помощью которых рецепторы клеточной поверхности, сопряженные с G-белками, запускают образование внутриклеточных посредников. В обоих вариантах связывание внеклеточного лиганда изменяет конформацию цитоплазматического домена рецептора так, что он связывается с G-белком, который затем активирует (или ингибирует) определенный фермент плазматической мембраны. В некоторых случаях G-белок взаимодействует не с ферментом, а с ионным каналом. В сАМР-пути активируемый Gs-белком фермент синтезирует циклический АМР. В Са2+-пути с помощью фермента образуется растворимый посредник, который освобождает из внутриклеточных хранилищ ионы Са2+. И сАМР, и Са2+связываются в клетке с другими специфическими белками, изменяя их активность.
С интез
и расщепление cАМФ
интез
и расщепление cАМФ
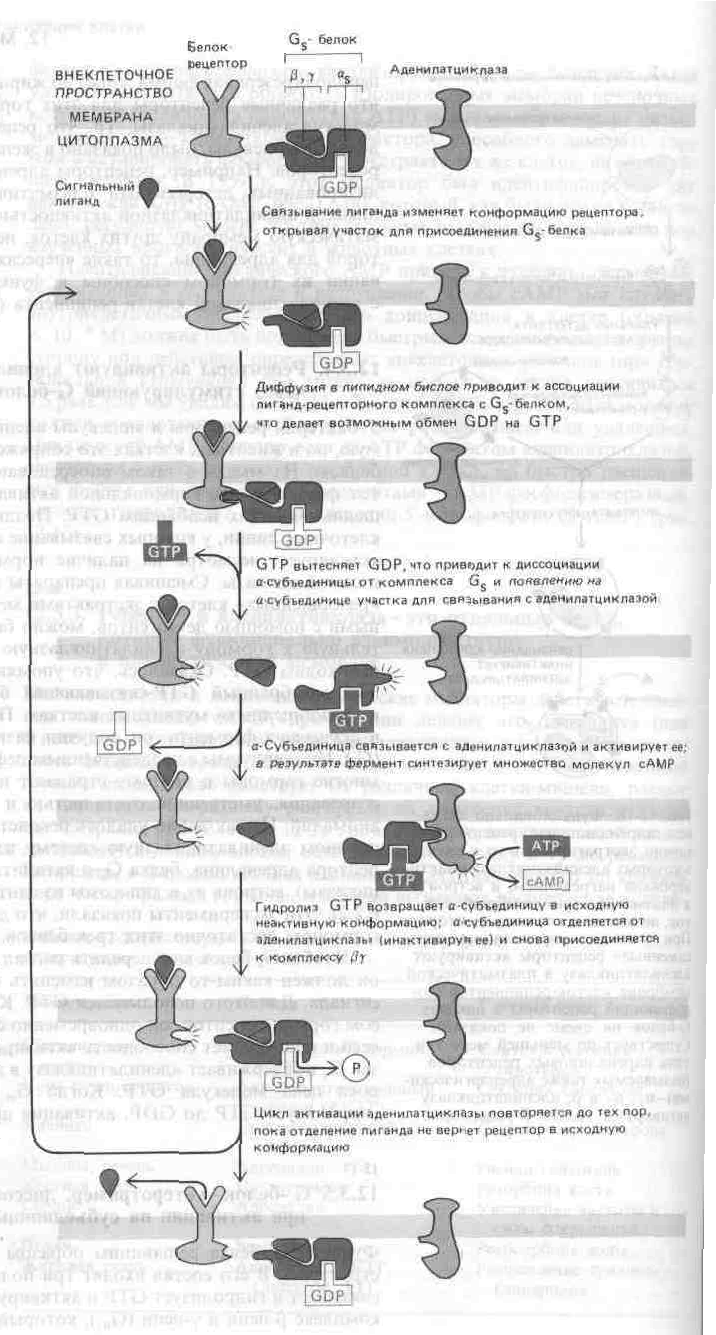
Рис. Современная
модель, иллюстрирующая, каким образом
белковые рецепторы могут
функционально
сопрягаться с аденилатциклазой через
стимулирующий G-белок –Gs.
Пока сигнальный лиганд остается
связанным, рецепторный белок может
активировать все новые молекулыGs-белка,
усиливая таким образом ответ.
Дополнительный механизм усиления
(который в некоторых сигнальных системах
имеет большее значение) заключается в
удержании связанного GTP на-субъединице
Gs-белка на протяжении многих
секунд, так что все это время аденилатциклаза
остается активированной. Согласно
другой модели, аденилатциклаза остается
связанной с Gsи в активированном,
и в неактивном состоянии.
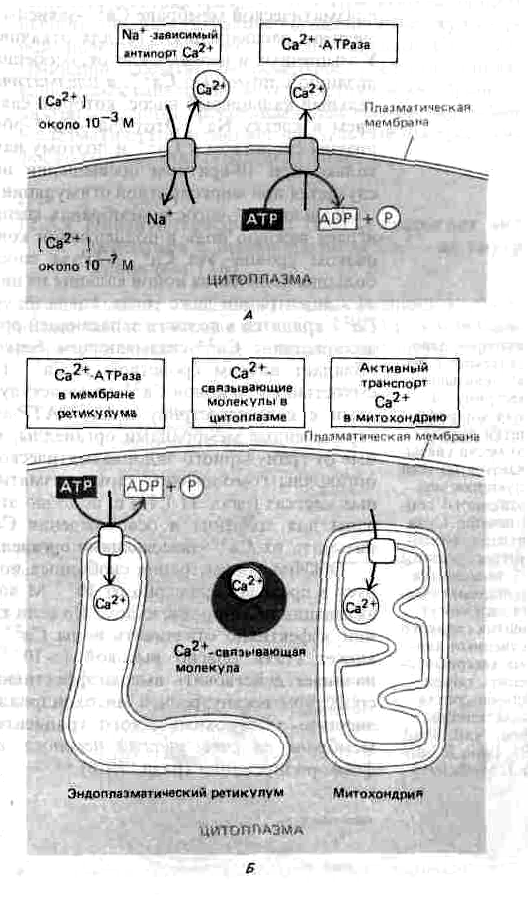
Рис.
Важнейшие механизмы, позволяющие клетке
поддерживать очень
низкую концентрацию свободных
ионов Са2
+
в цитозоле, несмотря
на их высокую концентрацию
во внеклеточной жидкости. Са2+
активно откачивается из цитозоля во
внеклеточное пространство
(А)
и
в окруженные мембраной
внутриклеточные органеллы,
запасающие Са2+
(Б).
Кроме
того, свободные ионы кальция прочно
связываются различными внутриклеточными
молекулами. Митохондрии тоже способны
откачивать
Са из цитозоля, но делают
это эффективно только при очень
высокой концентрации Са2
+,
создающейся
обычно при повреждении
клетки.
Рис.
Две ветви инозитолфосфолипидного пути.
Как полагают, активированный рецептор
связывается со специфическим G-белком
(Gр),
заставляя его -субъединицу
диссоциировать и активировать фосфолипазу
С, которая расщепляет РIР2
с образованием InsP3
и
диацилглицерола. Диациглицерол (при
участии не показанных на схеме связанных
ионов Са2+
и фосфатидилсерина) активирует С-киназу.
Оба фермента - и фосфолипаза С, и С-киназа
-присутствуют в клетках как в растворимой,
так и в мембраносвязанной форме; в
процессе активации одна из них или обе
они перемещаются из цитозоля на
внутреннюю поверхность плазматической
мембраны. Эффект InsP3
можно имитировать экспериментально
на ин-тактных клетках обработкой Са2
+
-ионофором, а эффект диацилглицерола-обработкой
моноацилпроизводными диацилглицерола
или форболовыми эфирами, которые
связываются с С-киназой и активируют
ее.
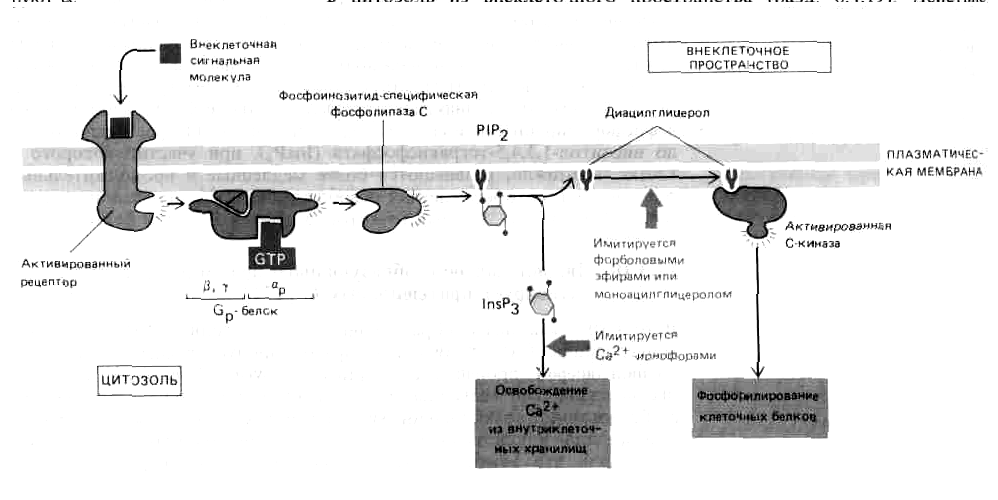

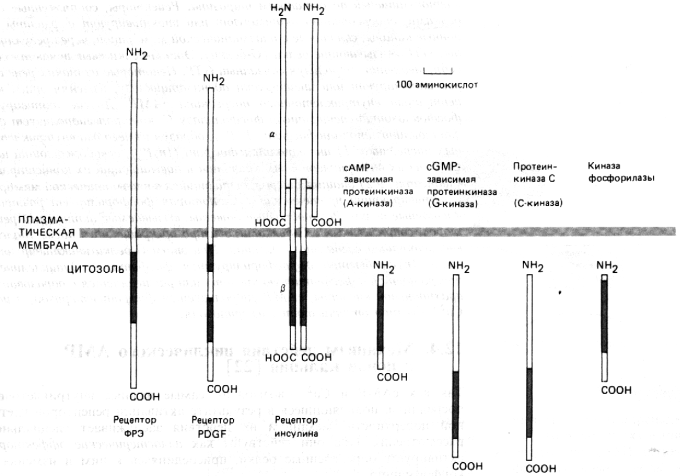
Рис. Современная
модель, иллюстрирующая, каким образом
белковые рецепторы могут
функционально
сопрягаться с аденилатциклазой через
стимулирующий G-белок –Gs.
Пока сигнальный лиганд остается
связанным, рецепторный белок может
активировать все новые молекулыGs-белка,
усиливая таким образом ответ.
Дополнительный механизм усиления
(который в некоторых сигнальных системах
имеет большее значение) заключается в
удержании связанного GTP на-субъединице
Gs-белка на протяжении многих
секунд, так что все это время аденилатциклаза
остается активированной. Согласно
другой модели, аденилатциклаза остается
связанной с Gsи в активированном,
и в неактивном состоянии.
