
физика оптика / Раб. 17
.doc
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ
АКАДЕМИЯ»
Кафедра физики
Лаборатория оптики и физики атома №2(012)
Лабораторная работа № 17
ИЗУЧЕНИЕ СЕРИАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ
В СПЕКТРЕ АТОМА ВОДОРОДА
Переработано: профессор Ульянов А.И.
ассистент Воронцова Е.Н.
Ижевск-2010
РАБОТА №17
ИЗУЧЕНИЕ СЕРИАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ
В СПЕКТРЕ АТОМА ВОДОРОДА
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ:
1. Спектрометр
2. Ртутная лампа,
3. Водородная трубка,
Опытами Резерфорда было установлено, что атом любого химического элемента состоит из положительного заряженного ядра, вокруг которого расположены отрицательно заряженные электроны, таким образом, что в целом атом нейтрален. Ядро, в котором сосредоточена почти вся масса атома, занимает ничтожно малую часть всего его объема. Диаметр ядра порядка 10-15м при размерах атома порядка 10-10 м. Электроны вращаются вокруг ядра в первом приближении по круговым орбитам. Совокупность электронов составляет электронную оболочку атома. Наиболее простым является атом водорода, вокруг ядра которого вращается один электрон.
Рассмотрим атом водорода и сходные с ним ионы (водородоподобные атомы), т.е. предположим, что имеется атомная система, состоящая из ядра с зарядом +Ze и электрона с зарядом -e (Z - порядковый номер элемента в таблице Менделеева). Для водорода Z=1.
Очевидно,
что центростремительной силой,
удерживающей электрон на орбите радиуса
r
является кулоновская сила притяжения
между
электроном
и ядром т.е.:![]()
![]()
![]()
![]()
![]() ,
(1)
,
(1)
где m - масса электрона, v - его скорость, 0 = 8,8510-12 Ф/м - электрическая постоянная.
Электрон, вращаясь в электрическом поле ядра, обладает энергией W, которая складывается из потенциальной Wпот и кинетической Wкин энергий.
Потенциальная энергия электрона отрицательна и равна:
Wпот
= -![]()
![]() (2)
(2)
Кинетическая
энергия электрона равна: Wкин
=
![]() ,
,
или учитывая формулу (1):
Wкин
=
![]() . (3)
. (3)
Тогда полная энергия электрона:
W
= Wпот
+ Wкин
= -
![]() . (4)
. (4)
Согласно электромагнитной теории, вращающийся по орбите электрон возбуждает вокруг себя переменное электромагнитное поле, распространяющееся в пространстве со скоростью света. Это означает, что вращение электрона должно вызвать непрерывное излучение, на которое электрон затрачивает часть своей энергии. Таким образом, согласно классическое теории, энергия электрона все время уменьшается. Из формулы (4) следует, что меньшему значению энергия (с учетом знака) соответствует меньший радиус орбиты электрона. В результате электрон должен упасть на ядро. В действительности же атом является устойчивой системой. Из формулы (1) видно, что с уменьшением радиуса орбиты скорость движения электрона возрастает, т.е. период обращения уменьшается. Это должно привести к непрерывному увеличению частоты излучаемых электромагнитных волн и атом должен излучать сплошной спектр. Однако, в действительности, атом излучает лишь линейчатый спектр. Выход из создавшегося положения был предложен Бором .
Основываясь на гипотезе Планка о квантовом характере излучения и поглощении света, Бор сформулировал законы движения электронов в атоме в виде постулатов.
1. Электрон в атоме может вращаться только по строго определенным - стационарным орбитам, радиус которых определяется из условия:
mvr
= n![]() ,
(5)
,
(5)
где h - постоянная Планка, n = 1, 2, 3.... - квантовые числа, определяющие номер электронной орбиты, mvr - момент импульса электрона. Таким образом, Бор постулировал, что полная энергия электрона в атоме может принимать лишь строго определенные значения.
2. Вращаясь по стационарным орбитам, электрон не излучает энергии.
З. Излучение происходит лишь при переходе электрона из одного стационарного состояния с большим значением энергии W2, в другое стационарное состояние с меньшим значением энергии W1. При этом излучается квант, частота которого определяется из условия:
h = W2 – W1 , (6)
где h - энергия излучаемого кванта.
Из формулы (6) следует, что излучение происходит при переходе электрона с внешних орбит на внутренние. При поглощении атомом определенной порции энергии электрон переходит с внутренних орбит на внешние.
Решив совместно уравнения (5) и (1), получаем следующее выражение для радиуса электронной орбиты:
rn
= n2![]() . (7)
. (7)
Если это значение радиуса орбиты электрона подставить в формулу (4), то получим следующее выражение для полной энергии электрона:
W
= -
![]() .
(8)
.
(8)
Из формулы (8) видно, что энергию электрона в атоме определяет квантовое число n, т. к. остальные величины являются константами.
В общем случае атомная система, состоящая из ядра и одного электрона, переходя из стационарного состояния характеризуемого квантовым числом nk, в состояние с квантовым числом n1, испускает по 3-му постулату Бора линию спектра с частотой:
=
![]()
![]() . (9)
. (9)
Величина
![]() (10) называется постоянной Ридберга.
Тогда формулу (9) можно представить в
виде:
(10) называется постоянной Ридберга.
Тогда формулу (9) можно представить в
виде:
=
R![]() (11)
(11)
ПРИМЕЧАНИЕ: В спектроскопических исследованиях для характеристики линии зачастую пользуются не частотой излучения, а длиной волны , которая связана с частотой излучения формулой = /с, где с - скорость света в вакууме. В этом случае формула (11) сохраняет вид, но постоянная Ридберга приобретает иное значение:
R/ = R/c = 3/289851015/3108 = 1,09737∙ 107 м-1.
Если учесть, что = с\, то формулу (10) можно прео6разовать к виду:
![]() . (12)
. (12)
Вычисленное по формуле (10) значение постоянной Ридберга с большой
точностью совпадает с экспериментальным. В разряженных газах или парах металлов взаимодействие между отдельными атомами незначительно. Поэтому спектры таких газов состоят из отдельных спектральных линий различных длин волн, также подчиняющихся уравнению (12).
Формула (12) является одной из наиболее точных формул физики. Из нее следует, что все линии спектра могут быть объединены в серии. Серией называется совокупность линий, описываемых форму лой (12), при фиксированном значении n1.
Для водорода основными сериями являются серия Лаймана, линии которой лежат в ультрафиолетовой области (n1 = 1; nк = 2, 3, 4, 5....); серия Бальмера, линии которой лежат в видимой области (n1 = 2; nк = 3, 4, 5, 6....) и серия Пашена, линии которой лежат в инфракрасной области (n1 = 3; nк = 4, 5, 6, 7...). Линии этих серий возникают при переходе электрона:
- с вышележащих орбит на первую (n1 = 1) - серия Лаймана:
- с вышележащих орбит на вторую (n1 = 2) - серия Бальмера;
- с вышележащих орбит на третью электронную орбиту (n1 = 1) - серия Пашена).
Поскольку в атоме водорода энергия электрона, также как и номер его орбиты однозначно определяется значением главного квантового числа n, то линии водородного спектра удобно представлять как результат перехода электрона из одного энергетического состояния в другое (рис. 1).

Серия линий Бальмера в видимой области спектра была получена экспериментально еще до создания теории Бора. Она состоит из ряда линий, наиболее яркими из которых являются четыре: красная Н (n1 = 3), зеленая Н (n1 = 4), фиолетовая Н (n1 = 5), фиолетовая Н (n1 = 6).
Для водородоподобных атомов, то есть атомов, которые в электронной оболочке имеют всего лишь один электрон, например, однократно ионизированный атом гелия, сериальная формула имеет вид:
=
RZ2![]() ,
(13)
,
(13)
где Z – зарядовое число атома. Таким образом, теория Бора хорошо объясняет спектры атома водорода и водородоподобных атомов.
Цель настоящей работы заключается в исследовании серии линий Бальмера в видимой области спектра водорода. Эта серия линий возникает при переходе электронов с вышележащих орбит на вторую, а длины волн спектральных линий этой серии удовлетворяют соотношению:
![]() ,
(14)
,
(14)
где nk = 3, 4, 5, 6….., а R/ = 1,09737 107 м-1.
ОПИСАНИЕ УСТАНОВКИ. Работа выполняется на универсальном монохроматоре УМ-2, который используется в качестве спектроскопа. Упрощенная оптическая схема монохроматора показана на рис. 2.
 4 3 2 1
4 3 2 1
5
Рис. 2
Свет от источника 1 через входную щель 2 попадает на объектив коллиматора 3 и параллельным пучком проходит через диспергирующую призму 4. Поворачивая призму 4 на различные углы относительно падающего пучка света, в выходной щели 5 получают изображение щели в свете с различной длиной волны, которое можно наблюдать с помощью окуляра 6.
К ОНСТРУКЦИЯ
СПЕКТРОМЕТРА.
Общий вид спектрометра приведен на рис.
3.
ОНСТРУКЦИЯ
СПЕКТРОМЕТРА.
Общий вид спектрометра приведен на рис.
3.
Рис. 3
Станина 1 спектрометра установлена на рельсе 2, на котором крепятся также другие устройства установки. На призменном столике 3 закреплены призмы, которые с помощью поворотного механизма могут поворачиваться относительно направления подающего луча света. На барабане 4 поворотного механизма нанесены относительные деления - градусы. Отсчет градусов производится против риски визирного устройства 5, скользящего по спиральной канавке. Во время работы шкала и визирное устройство освещаются лампочкой 6 напряжением 3,5 В, которая включается с помощью тумблера 7. Свет от исследуемого источника света попадает на призмы через коллиматор 8. Коллиматор имеет входную щель 9, ширина раскрытия которой от 0 до 4 мм устанавливается с помощью ручки 10. Луч света, пройдя диспергирующие призмы, попадает в объектив зрительной трубы 11 спектрометра, который собирает их в плоскости окуляра 12, через который происходит наблюдение спектральных линий. В фокальной плоскости окуляра зрительной трубы установлен указатель, освещаемой лампочкой. Для регулировки освещения указателя на приборе установлен реостат с выключателем 13. Луч света, проходящий через коллиматор 8, может быть перекрыт заслонкой 14, которая в рабочем положении должна быть открыта.
Р
 ТУТНАЯ
ЛАМПА И ПУЛЬТ ПИТАНИЯ. Для градуировки
прибора служит, установленная на рельсе
(см. рис.
4), ртутная
лампа ДРШ-250М напряжением
127 В.
ТУТНАЯ
ЛАМПА И ПУЛЬТ ПИТАНИЯ. Для градуировки
прибора служит, установленная на рельсе
(см. рис.
4), ртутная
лампа ДРШ-250М напряжением
127 В.
Рис. 4 Рис. 5
Лампа является мощным источником света и закрыта кожухом. Лампа включается с помощью пульта питания (рис. 5). На передней панели пульта питания расположены тумблеры: «Сеть» (1), «Лампа К12» (2), ртутной лампы «Лампа ДРШ» (3), а также пусковые кнопки (4) и (5) для запуска ртутной лампы.
ВОДОРОДНАЯ ТРУБКА. В работах реализовано две различные конструкции крепления и соответственно два варианта электропитания водородной трубки. В одной из работ водородная трубка (1) (см. рис. 6) смонтирована на столике (2), который закреплен на основании (3). Вся конструкция водородной трубки установлена на рельсе, отрегулирована и перемещению не подлежит. Водородная трубка питается от высоковольтной катушки Румкорфа, которая подсоединена к блоку питания, включаемого в сеть 220 В.
Рис. 6

В другой работе водородная трубка установлена вертикально и закрыта пластмассовым кожухом, в котором имеется окно для прохождения света в спектрометр от включенной ртутной лампы. Высоковольтный блок питания водородной трубки также находится под пластмассовым кожухом. Питание водородной трубки осуществляется через пульт управления путем включения тумблера «лампа К12». Водородная трубка установлена на рельсе перед щелью коллиматора, отрегулирована и перемещению не подлежит.
При подаче высокого напряжения на электроды водородной трубки в ней наблюдается свечение розового цвета. ПРЕДУПРЕЖДЕНИЕ: водородная трубка и ртутная лампа установлены в необходимых местах на направляющем рельсе, отрегулированы и перемещению не подлежат.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Настоящая работа состоит из двух упражнений. В первом упражнении по измерениям линейчатых спектров ртутной лампы производится градуировка спектрометра и строится градуировочный график. Во втором упражнении по градуировочному графику определяется длина волны линий в спектре излучения водородной трубки. Затем по измеренным значениям длин волн спектра излучения атома водорода вычисляют постоянную Ридберга.
УПРАЖНЕНИЕ 1
ГРАДУИРОВКА СПЕКТРОМЕТРА. Градуировка спектрометра производят по спектру излучения паров ртути. Цвет линий спектра паров ртути и соответствующие им длины волн приведены в таблице 1.
Таблица 1. Спектральные линии паров ртути.
|
Цвет линии |
Длина волны, нм |
Отсчет по измерительному барабану, дел. |
|
1. Желтая яркая линия (правая из 2-х близко расположенных линий) |
577,0 |
|
|
2. Светло-зеленая яркая |
546,1 |
|
|
3. Голубая (правая более яркая из двух слабо видимых линий) |
491,6 |
|
|
4. Фиолетовая (яркая) |
435,8 |
|
|
5. Фиолетовая слабо заметная (последняя) линия спектра |
404,6 |
|
Для градуировки спектрометра необходимо выполнить следующие операции:
1. Включить ртутную лампу, для чего включить тумблеры «Сеть», «Лампа ДРШ» и, при необходимости, нажать кнопку «Пуск».
2. Включить тумблеры освещения измерительного барабана и указателя 7 и 13 (рис. 3) (реостат должен быть установлен на максимальный свет).
3. При необходимости путем перемещения зрительной трубы 11 и вращения окуляра 12, а также перемещением коллиматора 8 (вращать ручку 15 на рис. 3) добиться резкого изображения спектральных линий и указателя
линий спектра.
4. При необходимости вращением барабанчика 10 (рис. 3) установить ширину входной щели на 0,2-0,5 мм.
5. Вращением измерительного барабана 4 (рис. 3) установить указатель последовательно на видимые линии спектра ртути и снять соответствующий отсчет по измерительному барабану против риски указателя 5 (рис. 3). Результаты измерений записать в таблицу 1. По окончании этой части работы выключить ртутную лампу.
По результатам измерений построить на миллиметровой бумаге градуировочный график, для чего необходимо выбрать пределы изменения измеряемых величин, а затем и удобный в работе масштаб по осям абсцис и ординат соответственно. Например, предел изменения длин волн можно выбрать от 400 до 700 нм, а наименьшее деление масштабной сетки – 20 или 50 нм. На осях градуировочного графика записывать только значения делений масштабной сетки. Относительно масштабной сетки на графике в соответствии с результатами измерений поставить экспериментальные точки, которые необходимо соединить плавной линией.
УПРАЖНЕНИЕ 2
ОПРЕДЕЛЕНИЕ ДЛИН ВОЛН СПЕКТРАЛЬНЫХ ЛИНИЙ
ИЗЛУЧЕНИЯ АТОМА ВОДОРОДА И ВЫЧИСЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА
Включить высоковольтный источник питания водородной трубки. Нормально работающая водородная трубка светится розоватым свечением. При этом в окуляре спектрометра должны отчетливо наблюдаться линии спектра водорода. Наблюдение спектра несколько осложняется тем, что водород при
нормальных условиях является двухатомным газом, а нужный нам спектр излучается атомарным водородом.
Поиск нужных линий спектра атомов водорода надо начинать с красной интенсивной линии H. Её легко найти и она не может быть спутана с молекулярными полосами спектра. Вторая линия Н - зелено-голубая. В промежутке между Н и Н лежат ряд краcножелтых молекулярных полос, но слабых по сравнению с обеими нужными нам линиями. Третья линия Н -фиолетовая, тождественная по окраске с известной фиолетовой линией спектра ртути. Этой линии предшествует две слабые размазанные молекулярные фиолетовые полосы. Четвертая линия спектра атома водорода Н видна очень слабо.
Измерить длины волн опознанных спектральных линий атома водорода. Для этого вращением измерительного барабана установить указатель на выбранную спектральную линию, по измерительному барабану сделать соответствующий отсчет и записать его в таблицу 2.
Таблица 2. Спектральные линии атома водорода.
|
Цвет линий |
Отсчет по измерительному барабану, дел. |
Длина волны, нм |
|
1. Ярко-красная |
|
|
|
2. Зеленая |
|
|
|
3. Фиолетовая |
|
|
Закончив
измерения, выключить высоковольтный
источник питания
![]() водородной
трубки.
водородной
трубки.
Определение длин волн спектральных линий водорода осуществляется по измеренной в первом упражнении градуировочной кривой. По градуировочной кривой определить длины волн каждой линии спектра водорода. Результаты измерений занести в таблицу 2.
Постоянную Ридберга для каждой длины волны вычислить формуле:
![]()
![]()
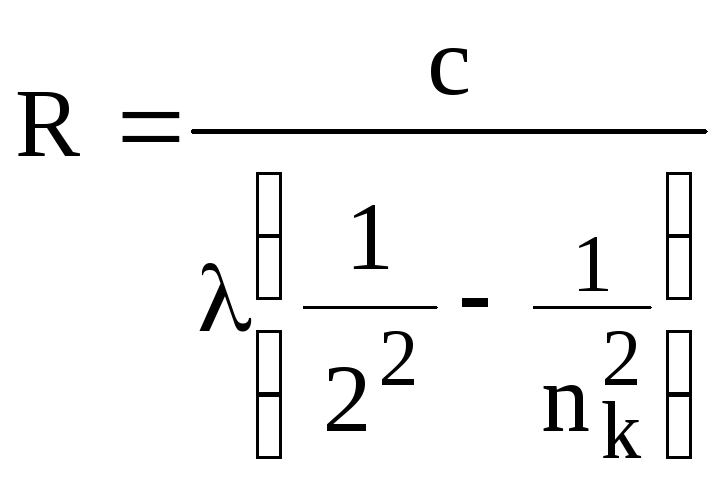 .
.
В этой формуле с – скорость света, nk = 3 для линии Н (ярко-красная линия), nk = 4 для линии H (зеленая линия) и nk = 5 для линии H (фиолетовая линия). Определить среднее значение постоянной Ридберга, рассчитать случайную погрешность. Результаты вычислений занести в таблицу 3.
Таблица 3. Вычисление постоянной Ридберга
|
№ |
R, с-1 |
Cреднее значение <R>, с-1 |
R, с-1 |
Среднее значение <R>, с-1 |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
Окончательный результат записать в форме: R = (<R> <R>) с-1.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему непрерывно излучающий электромагнитные волны электрон согласно классической электродиниамике должен упасть на ядро?
2. Сформулируйте постулаты Бора.
З. Объясните смысл отрицательанго значения полной энергии электрона в атоме.
4. Объясните природу линейчатого спектра атома водорода?
5. По какой формуле вычисляются длины волн линий водородного спектра в инфракрасной, видимой и ультрафиолетовой областях спектра?
ЛИТЕРАТУРА:
1.Я.В. Савельев. Курс общее физики, т. 3, 2000
2. К.А. Путилов. Курс физики, т. 3, 1968
3. Р.Г. Геворкян. Курс общей физики, 1972
4. Р.И. Грабовский. Курс физики, 1980
5. Г.А.Зисман. Курс общей физики, 1972
