
Химическая термодинамика
§ 4. Расчет изменения энтропии в различных процессах
1. Расчет изменения энтропии в процессе фазового перехода
Процессы фазового перехода (плавление, испарение, возгонка и др.) проходят при постоянной температуре (Т=const). Изменение энтропии рассчитывают по уравнениям:
 ; (4.1)
; (4.1)
 , (4.2)
, (4.2)
где ΔUф.п. и ΔНф.п. – теплоты фазового перехода; Т – абсолютная температура фазового перехода; n – число моль.
2. Расчет изменения энтропии при нагревании жидких или твердых веществ от Т1 до Т2
а) процесс протекает при постоянных значениях объема и теплоемкости (V, CV = const):
 , (4.3)
, (4.3)
б) процесс протекает при постоянных значениях давления и теплоемкости (р, Cр = const):
 , (4.4)
, (4.4)
в) процесс протекает при постоянном давлении (р = const), теплоемкость зависит от температуры (Cр = а+bT+cT2):
 . (4.5)
. (4.5)
3. Расчет изменения энтропии при нагревание идеального газа от Т1 до Т2
а) процесс протекает при постоянной теплоемкости газа (CV = const):
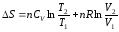 , (4.6)
, (4.6)
б) при протекании процесса теплоемкость зависит от температуры (CV = а+bT+cT2):
 . (4.7)
. (4.7)
4. Расчет изменения энтропии в обратимо работающем электрохимическом элементе
Изменение энтропии при необратимой химической реакции, протекающей при постоянном давлении и температуре, например, в обратимо работающем электрохимическом элементе, рассчитывается по уравнению
 , (4.8)
, (4.8)
где ΔН
– тепловой эффект химической реакции;
 – максимально полезная работа химической
реакции, то есть работа химической
реакции, которую можно определить,
например, по ЭДС обратимо работающего
электрохимического элемента (
– максимально полезная работа химической
реакции, то есть работа химической
реакции, которую можно определить,
например, по ЭДС обратимо работающего
электрохимического элемента ( );
z
– число электронов, участвующих в
электродной реакции на одну реагирующую
частицу; F
– постоянная
Фарадея, равная 96500 Кл; Е
– электродвижущая сила электрохимического
элемента.
);
z
– число электронов, участвующих в
электродной реакции на одну реагирующую
частицу; F
– постоянная
Фарадея, равная 96500 Кл; Е
– электродвижущая сила электрохимического
элемента.
Примеры выполнения задания
Пример 4.1.
Рассчитайте изменение энтропии при нагревании 1 моль Cd от 25 °С до 727 °С, если температура и теплота плавления кадмия соответственно равны 321 °С и 6109 Дж/моль. Зависимость изменения теплоемкости от температуры для Cd(т) выражена уравнением:
 .
.
Теплоемкость
жидкого кадмия
 .
.
Решение:
Данный процесс состоит из трех стадий: 1) нагревание твердого кадмия от 25 °С до температуры плавления 321 °С; 2) плавление кадмия при 321 °С; 3) нагревание жидкого кадмия от 321 °С до 727 °С.
1) Изменение энтропии в первой стадии:
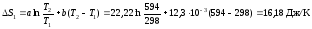 .
.
2) Изменение энтропии в процессе фазового перехода:

3) Изменение энтропии в третьей стадии:
 .
.
4) Общий прирост энтропии составит:
 .
.
Пример 4.2.
Рассчитайте
изменение энтропии в процессе превращения
0,2 моль воды в пар
при изменении
температуры от 0 °С до 150 °С, если удельная
теплота испарения воды составляет
2,255 кДж/г. Теплоемкость жидкой воды не
зависит от температуры
 .
Зависимость изменения теплоемкости
для водяного пара от температуры выражена
уравнением:
.
Зависимость изменения теплоемкости
для водяного пара от температуры выражена
уравнением:
 .
.
Решение:
Данный процесс состоит из трех стадий: 1) нагревание жидкой воды от 0 °С до температуры испарения 100 °С; 2) испарение воды при 100 °С; 3) нагревание водяного пара от 100 °С до 150 °С.
1) Изменение энтропии в первой стадии:
 .
.
2) Изменение энтропии в процессе фазового перехода:
 .
.
3) Изменение энтропии в третьей стадии:
 .
.
4) Общий прирост энтропии составит:
 .
.
