
Шпоры физика(2 семестр )
.docx
 ее
движ.Внешн слой жидк, примыкающ к п-сти
трубы,из-за сил молекул. сцепления
прилип к ней и остаетсянеподвиж ее
движ.Внешн слой жидк, примыкающ к п-сти
трубы,из-за сил молекул. сцепления
прилип к ней и остаетсянеподвиж последующих
слоев тем больше,чем больше их расстояние
до п-сти трубы,при этом наибольшей последующих
слоев тем больше,чем больше их расстояние
до п-сти трубы,при этом наибольшей
 обладает слой,кот.движ.вдоль оси
трубы.При турбулентно
течении частицы
жидк.приобретают составляющие
обладает слой,кот.движ.вдоль оси
трубы.При турбулентно
течении частицы
жидк.приобретают составляющие
 ,
кот.ḻ течению, и они могут двигаться
из одного слоя в др. ,
кот.ḻ течению, и они могут двигаться
из одного слоя в др. частиц
жидк.быстро возрастает по мере удаления
от п-сти трубы, затем изменяется
незначительно.Т.к частицы жидк.могут
перейти из одного слоя в др, то их частиц
жидк.быстро возрастает по мере удаления
от п-сти трубы, затем изменяется
незначительно.Т.к частицы жидк.могут
перейти из одного слоя в др, то их
 в различных слоях мало отличаются.Из-за
большого градиента
в различных слоях мало отличаются.Из-за
большого градиента
 у п-сти трубы обычно происходит
образование вихрей.
у п-сти трубы обычно происходит
образование вихрей.
|
|
|
Wk0=
|
Вну́тренняя эне́ргия тела (или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекул. Внутренняя энергия является однозначной функцией состояния системы. Коли́чество теплоты́ — энергия, кот. получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. |
 .
.
|
|
 )v, )v,
где(
|
|
 = =
|
Pаспред.Больц.ср.число
частиц с полной энергией Ei (<ni>= Постоянная Z находится
из условия, что сумма ni по
всем возможным значениям i=
заданному полному числу частиц n в
системе: Kогда движение частиц подчиняется класс.механике, энергию Ei можно считать состоящей из кинет.энергииEi1=Ei(кин) частицы, внутренней энергииEI2=Ei(вн) и потенциальной энергииEi3=Ei(пот) во внешнем поле, зависящей от положения частицы в пр-ве: Ei=Ei1+Ei2+Ei3 |
|
|
|
|
|
|
|
Участок левее т.F — нормал.жидкость.т.F — кипен.Прямая FG — равновесие жидк.и газообр.фазы.УчастокFA—перегретая жидк.Участок F′A — растянутая жидкость (p<0). Участок AC — аналит.продолжение изотермы, физ. невозможен.Участок CG — переохлажд. пар. Точка G — точка росы. Участок правее точки G — нормальный газ.К — критическая изотермаK -крит.точка.верхние3— сверхкритические изотермы 
|
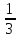 n<v><ƛ> n<v><ƛ>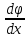 dSdt
является общим уравнением переноса
физической величины ϕ.Под
ср.длиной свободного пробега понимают
ср.расстояние,кот.проходит м-ла между
2 последовательными соударениями.За
секунду м-ла в ср.проходит расстояние,
численно =ее ср.скорости<v>.
Если за это же время она испытает в
среднем<v>столкновений
с др. м-лами, то ее ср.длина свободного
пробега <ƛ>=<v>\<v> dSdt
является общим уравнением переноса
физической величины ϕ.Под
ср.длиной свободного пробега понимают
ср.расстояние,кот.проходит м-ла между
2 последовательными соударениями.За
секунду м-ла в ср.проходит расстояние,
численно =ее ср.скорости<v>.
Если за это же время она испытает в
среднем<v>столкновений
с др. м-лами, то ее ср.длина свободного
пробега <ƛ>=<v>\<v>
|
 dS.С
т.зрения молекулярно-кинет.теории.ὴ= dS.С
т.зрения молекулярно-кинет.теории.ὴ= ρƛvcр.арифм. ρƛvcр.арифм.
|
20бДвижение тел в жидк.и газах.У-е Стокса 21аДавление газа ст.зрения молек-кинет теории 21бу-е состояния идеального газа 22амолек-кинет смысл абсол.теммпературы 22бЧисло степен.свобод.З.равнораспред.энергии 23аЭнергия.Внутр.энергия.Кол-во теплоты 23б1ое начало термодинамики 24аРабота соверш.газом при измен.обьема 24бТеплоемкость идеальных газов 25аТермические коэффициенты и их связь 25бприменение 1ого начала термодин 26ау-е адиабаты 26бПолитропические процессы 27аРаспределение Максвелла 27ббарометрическая формула 28аРаспределение Больцмана 28бПодьемная сила 29аОбратимые и необратимые процессы 29бТепловая машина 30ацикл карно 30б2 начало термодинамики 31аэнтропия как ф-я состояния термодин с-мы 31бматем.формулир.2 нач.термодин. 32астатистич.смысл и св-ва энтропии 32бИзменение энтропии в процессах идеаль.газа 33а3начало термодинамики 33бРеальные газы.Силы межмолекул взаимод. 34аУ-е Ван-дер-Вальса 34бИзотермы у-я Ван-дер-Вальса 35бИзотермы реального газа 36аИзотермы жидкости 36бЯвление переноса.Ср.длинна свобод.пробега 37аДиффузия в газах.З Фика 37бЯвление внутр.трен.газа.З Ньютона 38аТеплопроводность З.Фурье |


 RT
RT kT;p=
kT;p= nm0v02=
nm0v02=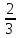 n
n →p=
→p= nWk0
vcp.KB.=
nWk0
vcp.KB.=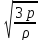
 =0Изменен.полной
энергии с-мы в квазистатичес.процессе=
кол-ву Q,
сообщён.с-ме, в сумме с изменением
энергии,кол-вом в-ва N при хим.потенциале μ,
и A’,
совершён.над с-мой внешн.силами
и полями,за вычетом А ,
совершён.самой с-мой против внешних
сил
=0Изменен.полной
энергии с-мы в квазистатичес.процессе=
кол-ву Q,
сообщён.с-ме, в сумме с изменением
энергии,кол-вом в-ва N при хим.потенциале μ,
и A’,
совершён.над с-мой внешн.силами
и полями,за вычетом А ,
совершён.самой с-мой против внешних
сил v– частная
производная,характеризующая
изменения давления p,если
температура вещества повышается на
один градус, а объем остается постоянным,
давление p
является
функцией температуры.
v– частная
производная,характеризующая
изменения давления p,если
температура вещества повышается на
один градус, а объем остается постоянным,
давление p
является
функцией температуры.
 показатель
политропы (Cp и Cv — теплоёмкости
газа ). у-е
политропы в ином виде: pT^
показатель
политропы (Cp и Cv — теплоёмкости
газа ). у-е
политропы в ином виде: pT^ =const
илиVT
=const
илиVT = const.
у-е П. п. идеального газа включает
частные случаи у-я: адиабаты С
=0,
n = Cp/Cv, , изобары (С =
Ср,
n = 0), изохоры (С
= Cv,
n = ¥)
и изотермы (С
= ¥, n =
1).
Работа А идеального
газа в П. п. против внешнего давления
A=
= const.
у-е П. п. идеального газа включает
частные случаи у-я: адиабаты С
=0,
n = Cp/Cv, , изобары (С =
Ср,
n = 0), изохоры (С
= Cv,
n = ¥)
и изотермы (С
= ¥, n =
1).
Работа А идеального
газа в П. п. против внешнего давления
A= (p1V1-p2V2)
(p1V1-p2V2) 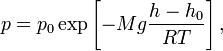
 e-Ei/kвТNi)
e-Ei/kвТNi)
 где:Y —
это подъёмная сила,P —
это тяга,
где:Y —
это подъёмная сила,P —
это тяга, =
=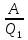 Понятно,
что КПД машины всегда меньше единицы,
поскольку не все кол-во полученного
тепла переходит в полезную работу.
Понятно,
что КПД машины всегда меньше единицы,
поскольку не все кол-во полученного
тепла переходит в полезную работу. .
где q
– подводимая
(извне) или отводимая от рабочего
тела теплота;
s,
Дж/(кг.К) –
удельная энтропия, являющаяся
параметром состояния
.
где q
– подводимая
(извне) или отводимая от рабочего
тела теплота;
s,
Дж/(кг.К) –
удельная энтропия, являющаяся
параметром состояния
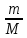 RT
,Zr =
Zr (p,T)k
сжимаем.
газа;Межмолекул.
взаимод.имеет электростатич.
природу.Перв.
предполож.существ.Ван-дер-Ваальс1873для
объяснен.св-в реальн.газов и
жидк.В наиболее широком смысле под
ним можно понимать такие взаимод.
между люб.частицами при кот.не происх.
образован.хим,ковалент.или ме.связей.Эти
взаимод. существенно слабее ковалент.и
не приводят к существен.перестройке
электрон. строения взаимод.частиц.
RT
,Zr =
Zr (p,T)k
сжимаем.
газа;Межмолекул.
взаимод.имеет электростатич.
природу.Перв.
предполож.существ.Ван-дер-Ваальс1873для
объяснен.св-в реальн.газов и
жидк.В наиболее широком смысле под
ним можно понимать такие взаимод.
между люб.частицами при кот.не происх.
образован.хим,ковалент.или ме.связей.Эти
взаимод. существенно слабее ковалент.и
не приводят к существен.перестройке
электрон. строения взаимод.частиц. dSdt
dSdt От
давления коэффициент теплопроводн.
жидк. практическине зависит.
Теплопроводн.газовприувелич.температуры
возрастает.К теплопровод.газов
изменяется в пределах от 0,005 до 0,6
От
давления коэффициент теплопроводн.
жидк. практическине зависит.
Теплопроводн.газовприувелич.температуры
возрастает.К теплопровод.газов
изменяется в пределах от 0,005 до 0,6
 и не зависит од давления.Фурье
установил закон- δQ=-X
и не зависит од давления.Фурье
установил закон- δQ=-X dSdt
dSdt